El síndrome de tako-tsubo (STT), aunque hay algún caso publicado anterior, fue descrito por primera vez en 1990 por Sato et al.1. Dadas sus características y curiosidades ha despertado considerable interés en los investigadores en las últimas décadas. En este artículo repasaremos de manera sucinta algunos aspectos, con orientación práctica, sobre esta enfermedad (o mejor, conjunto de enfermedades).
El STT se considera como una disfunción aguda más o menos extensa, pero reversible, del ventrículo izquierdo (VI). Su nombre proviene de la forma que adopta en sístole el VI en la fase aguda, que se asemeja a la típica vasija utilizada en Japón para cazar pulpos1,2. El STT ha recibido multitud de nombres, entre otros: cardiomiopatía inducida por estrés, discinesia apical transitoria o síndrome de corazón roto. Su incidencia exacta es de difícil estimación, pues varía según estudios.
Afecta más al género femenino que al masculino, en una proporción de 9:1, con predominio de mujeres posmenopáusicas y clínicamente imita un síndrome coronario agudo (SCA).
Muchas veces cursa con un desencadenante, que puede ser un estrés físico o psíquico (tabla 1) y se acompaña de un dolor torácico intenso, alteraciones electrocardiográficas del segmento ST y ondas T con trastornos de la contractilidad segmentaria y disfunción del VI. Es típica la ausencia de enfermedad coronaria responsable que pueda justificar el cuadro clínico. Los trastornos de la contractilidad son generalmente transitorios y reversibles en días o pocas semanas. Así, dentro de los diagnósticos iniciales de SCA podemos observar una incidencia de STT del 2,2%, en Estados Unidos, del 0,3-2,3% en Alemania y del 1,2% en España, según datos del registro nacional sobre la enfermedad (RETAKO)3,4.
Algunos desencadenantes asociados al síndrome de tako-tsubo
| Psíquicos |
| Muerte o enfermedad de un familiar |
| Malas noticias de cualquier tipo |
| Tormenta o situación climática |
| Discusiones con personas del entorno, amigos, familiares, vecinos, jefe |
| Presentaciones en público (médicos, etc.) |
| Juicios, problemas legales |
| Accidentes de tráfico |
| Caída casual con imposibilidad para levantarse (frecuente en ancianos) |
| Pérdida económica, apuestas, negocios, despido |
| Cambio de domicilio |
| Fiesta sorpresa, lotería u otras situaciones positivas («corazón feliz») |
| Físicos |
| Hipertiroidismo y tirotoxicosis |
| Crisis epiléptica |
| Crisis asmática |
| Cirugía cardiaca |
| Cirugía no cardiaca de cualquier tipo. Recuperación postanestésica |
| Implante de marcapasos |
| Enfermedad coadyuvante importante, sepsis... |
| Dolor intenso, fracturas, crisis renoureterales, picaduras de insectos, etc. |
| Retirada de opioides y otras drogas de abuso |
| Sobredosis con nortriptilina |
| Abuso de cocaína, anfetaminas u otros betamiméticos |
| Pruebas de estrés, como ergometría, farmacológicas (dobutamina) |
| Tromboembolismo de pulmón |
| Parada cardiaca recuperada (tratamiento con epinefrina) |
La fisiopatología del STT aún no está esclarecida en su totalidad. En un principio, las hipótesis se basaron en la isquemia por vasoespasmo o rotura de placa no obstructiva con trombolisis espontánea y embolización distal5, también surgieron otras hipótesis como la presencia de una anatomía peculiar (una coronaria descendente anterior larga que recorre el ápex y la cara diafragmática justificaría el extenso trastorno de contractilidad segmentaria más allá del territorio típico de la descendente anterior6), obstrucción del tracto de salida y otras teorías4.
Estas propuestas fueron posteriormente refutadas, siendo el mecanismo más aceptado el referente a la toxicidad o «hiperrespuesta» miocárdica a niveles elevados de catecolaminas circulantes, que provocarían una sobrecarga intracelular de calcio. La base de esta teoría apunta, a modo de respuesta defensiva y entre otros efectos, que ante un estímulo supranormal catecolaminérgico, los adrenorreceptores cambian su respuesta mediada por proteínas G estimuladoras a proteínas G inhibidoras, evitando la apoptosis celular y produciendo un déficit contráctil transitorio.
Los receptores se encuentran distribuidos de manera asimétrica, con mayor densidad en las zonas más discinéticas lo que explicaría la asimetría en la afectación miocárdica.
En algunos casos, la hipercontractibilidad secundaria de los segmentos basales favorece una obstrucción funcional del tracto de salida del VI (TSVI) que incrementa la presión telediastólica y propicia secundariamente otros problemas potenciales (insuficiencia mitral, insuficiencia cardiaca [IC], trombos apicales, etc.)7.
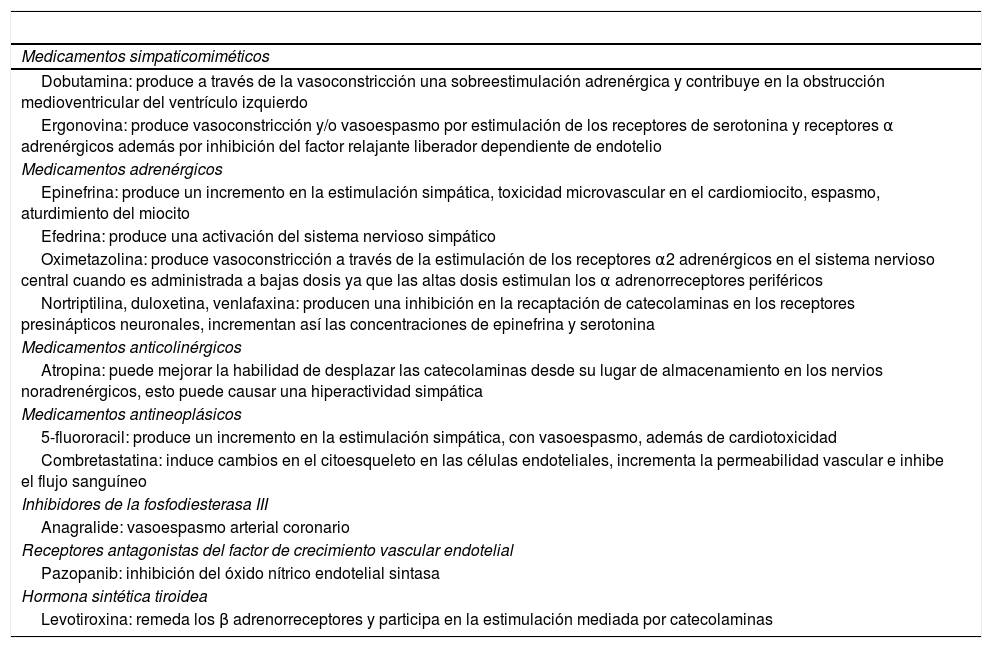
En la tabla 2 se muestran algunos medicamentos relacionados con la génesis del STT.
Algunos de los medicamentos más frecuentes y su mecanismo fisiopatológico propuesto
| Medicamentos simpaticomiméticos |
| Dobutamina: produce a través de la vasoconstricción una sobreestimulación adrenérgica y contribuye en la obstrucción medioventricular del ventrículo izquierdo |
| Ergonovina: produce vasoconstricción y/o vasoespasmo por estimulación de los receptores de serotonina y receptores α adrenérgicos además por inhibición del factor relajante liberador dependiente de endotelio |
| Medicamentos adrenérgicos |
| Epinefrina: produce un incremento en la estimulación simpática, toxicidad microvascular en el cardiomiocito, espasmo, aturdimiento del miocito |
| Efedrina: produce una activación del sistema nervioso simpático |
| Oximetazolina: produce vasoconstricción a través de la estimulación de los receptores α2 adrenérgicos en el sistema nervioso central cuando es administrada a bajas dosis ya que las altas dosis estimulan los α adrenorreceptores periféricos |
| Nortriptilina, duloxetina, venlafaxina: producen una inhibición en la recaptación de catecolaminas en los receptores presinápticos neuronales, incrementan así las concentraciones de epinefrina y serotonina |
| Medicamentos anticolinérgicos |
| Atropina: puede mejorar la habilidad de desplazar las catecolaminas desde su lugar de almacenamiento en los nervios noradrenérgicos, esto puede causar una hiperactividad simpática |
| Medicamentos antineoplásicos |
| 5-fluororacil: produce un incremento en la estimulación simpática, con vasoespasmo, además de cardiotoxicidad |
| Combretastatina: induce cambios en el citoesqueleto en las células endoteliales, incrementa la permeabilidad vascular e inhibe el flujo sanguíneo |
| Inhibidores de la fosfodiesterasa III |
| Anagralide: vasoespasmo arterial coronario |
| Receptores antagonistas del factor de crecimiento vascular endotelial |
| Pazopanib: inhibición del óxido nítrico endotelial sintasa |
| Hormona sintética tiroidea |
| Levotiroxina: remeda los β adrenorreceptores y participa en la estimulación mediada por catecolaminas |
Recientemente se han descrito casos familiares con STT además de variantes genéticas que podrían implicar una predisposición genética al STT y que incrementarían la sensibilidad a las catecolaminas. Asimismo, la recurrencia del STT, en un 5-10% de los pacientes, podría indicar una vulnerabilidad mediada genéticamente (en su modo de producir catecolaminas o de responder a ellas, con un efecto concreto del eje neurocardiaco)8.
Clasificación y diagnósticoDesde su primera descripción, típicamente con acinesia apical e hipercontractilidad basal del VI, se han descrito varios tipos basados en la anatomía ventricular en fase aguda, así destacamos8–10:
- -
Forma típica (acinesia apical). La más frecuente, más del 80% de los pacientes, afecta el ápex y segmentos medioventriculares, que se encuentran hipo/discinéticos y con hipercontractilidad de los segmentos basales.
- -
Formas atípicas10. 1) Medioventricular: afecta los segmentos medios del VI, con movilidad apical normal. Supone aproximadamente un 14% de los pacientes; 2) Forma basal (reversa o invertida): afecta a un 2% de los pacientes, generalmente mujeres jóvenes con hipocinesia de los segmentos basales del VI con hipercontractilidad del ápex y ausencia de obstrucción del TSVI9. Esta se observa típicamente en el feocromocitoma; 3) Formas focales: supone un 1,5% de los pacientes, afecta principalmente a un solo segmento del VI, por ejemplo la cara lateral o cara inferior.
- -
Con afección del ventrículo derecho. Parece más frecuente de lo que se piensa, en algunas series con resonancia se ha visto casi en un tercio de los casos8,10.
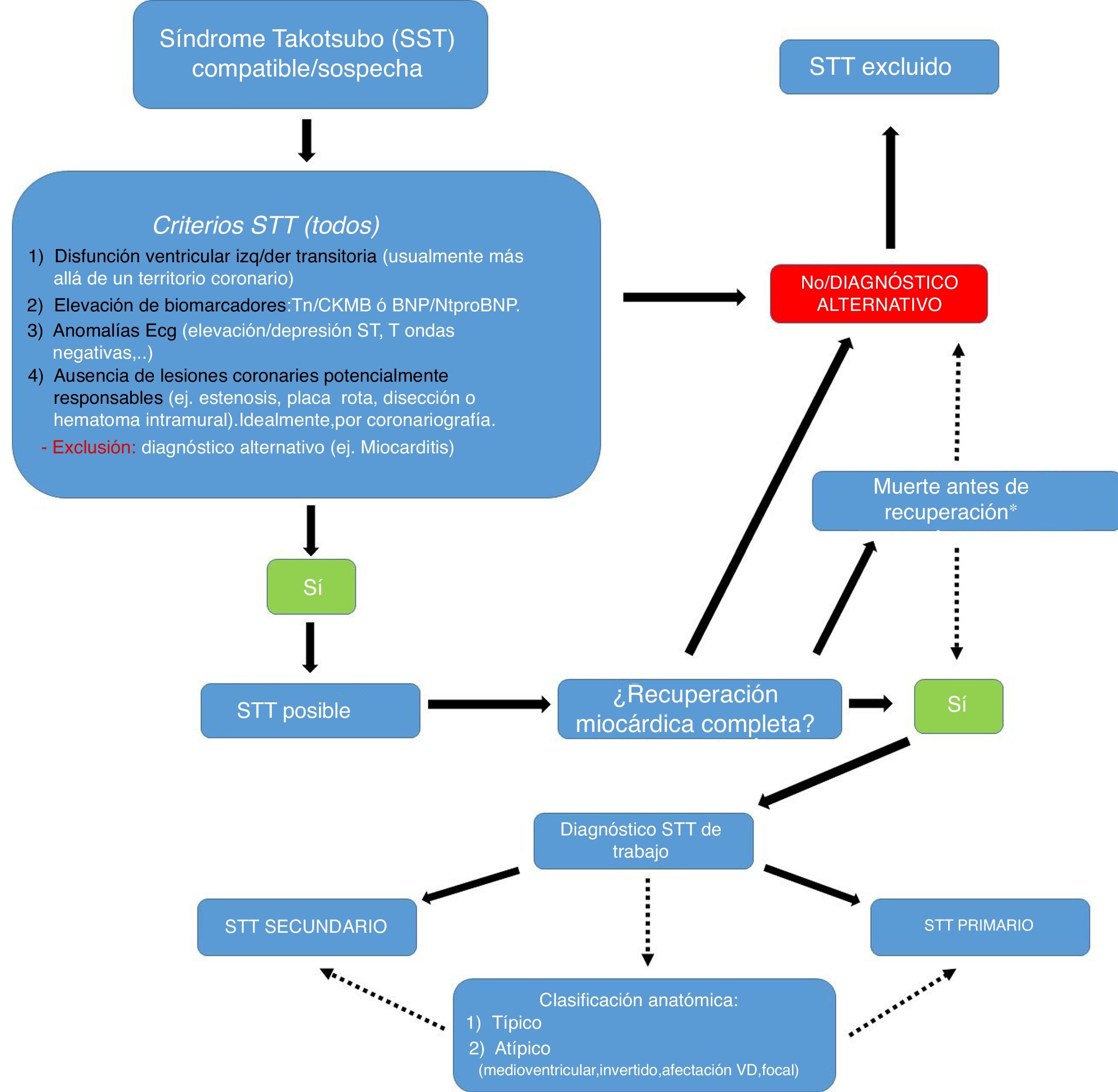
No obstante, y con la finalidad de establecer una orientación pronóstica, desde el registro RETAKO (fig. 1), se propuso adicionalmente la siguiente clasificación de trabajo en función de las circunstancias desencadenantes3,11:
- -
Forma primaria. La forma primaria es aquella en que no se logra identificar una causa específica o se identifica un estrés psíquico de fuerte intensidad, por ejemplo la muerte de un familiar o una discusión. A este nivel, aunque menos frecuentemente, incluso una situación estresante positiva puede desencadenar el STT.
- -
Forma secundaria. En estos pacientes es identificable una situación de estrés físico, como una enfermedad o comorbilidad grave concomitante, por ejemplo una crisis asmática, cirugía mayor, hemorragia subaracnoidea, politraumatismo, además de algunos medicamentos que favorecerían la génesis del STT como los medicamentos simpaticomiméticos (dobutamina), adrenérgicos (epinefrina), anticolinérgicos (atropina), algunos neuropsiquiátricos, etc. Estas formas secundarias condicionan un peor pronóstico, generalmente en función de la patología de base (p. ej., parada cardiaca, asma, cáncer, cirugía…). Desde su descripción se han propuesto diferentes criterios diagnósticos (japoneses, italianos, etc.) según cada grupo de investigación. En el registro español empleamos los criterios de la Clínica Mayo modificados5,11 (fig. 1).
Propuesta de algoritmo de trabajo. VD: ventrículo derecho. *Si un paciente fallece antes de alcanzar un diagnóstico síndrome de tako-tsubo (STT) de seguridad (antes de que se normalicen sus anomalías ventriculares), se establecerá uno de sospecha en base a su perfil clínico y los resultados de las diferentes pruebas. Modificado con permiso de Dias et al.8.
Las manifestaciones clínicas típicamente imitan a un SCA por lo que cursa con un cuadro doloroso torácico (80% en el registro RETAKO) además de disnea y cortejo vegetativo. Las palpitaciones, IC izquierda o derecha y shock en el ingreso se relacionan más a su forma secundaria. El uso durante el ingreso de tratamiento intensivo antitrombótico y ansiolíticos es más frecuente en su forma primaria, mientras que en su forma secundaria es frecuente el uso de inotrópicos e incluso soporte mecánico ventilatorio o asistencia ventricular8.
Pruebas complementariasAnalíticasAl ser una entidad que imita un SCA el STT cursa con una elevación de biomarcadores; así observamos una elevación de troponinas, creatincinasa y creatincinasa-MB; sin embargo los niveles entre estas 2 entidades no fueron significativos en el registro InterTAK10. En otros grupos, como el nuestro, se aprecia una modesta elevación de biomarcadores de necrosis, que contrasta con las extensas anomalías segmentarias del VI. Además contamos con otros biomarcadores como la determinación del péptido natriurético cerebral (análisis de BNP o porción terminal del NT-proBNP) o catecolaminas circulantes (metanefrinas). De hecho, algunos grupos consideran el BNP elevado como un criterio adicional de STT. Recientemente, se ha descrito la proporción de troponina T ultrasensible/creatincinasa-MB como un parámetro prometedor que lograría distinguir el STT del infarto de miocardio (IM)8.
Como novedad, el uso de microARN en un reciente estudio logra establecer una diferencia cualitativa significativa entre los niveles circulantes para STT respecto al SCA. Dichas diferencias indican una conexión del STT con desordenes neuropsiquiátricos12.
ElectrocardiogramaEl electrocardiograma muestra en las primeras fases del STT una elevación del punto J y del segmento ST en derivaciones, generalmente de V3 a V6, posteriormente existe una inversión de la onda T y una prolongación del intervalo QT. Tras unas semanas, los cambios se normalizan completamente aunque es habitual que tarde más en normalizarse que las anomalías segmentarias demostradas en el ecocardiograma.
En el registro RETAKO el 89% de los enfermos presentaban un electrocardiograma anormal al inicio de los síntomas, pero solo un 61% tenía el segmento ST elevado. Las ondas T negativas gigantes, típicas de la enfermedad reflejan el grado de edema miocárdico ya que las anomalías segmentarias mejoran más precozmente. Es excepcional el desarrollo y persistencia de ondas Q patológicas. Las anomalías eléctricas en la repolarización pueden observarse incluso en pacientes con estimulación continua por marcapasos4,13.
EcocardiogramaEl ecocardiograma nos brinda información diagnóstica y pronóstica, permite la localización del segmento afectado, el diagnóstico diferencial con otras patologías y descartar posibles complicaciones (derrame pericárdico, obstrucción del TSVI, trombo apical, etc.).
CoronariografíaLa coronariografía es fundamental en esta patología ya que se llega a su diagnóstico por descarte de otras patologías. En el STT no hay enfermedad arterial coronaria (EAC) significativa ni otras patologías que podrían justificar el cuadro; los criterios de la Clínica Mayo requerían ausencia de EAC grave pero fueron modificados pues ambas patologías pueden ser concomitantes. De hecho, en el registro de 1.750 pacientes con STT de Templin et al., el 15,3% presentaban EAC significativa en la coronariografía10.
Las técnicas de imagen intracoronaria han permitido demostrar en algunos casos la existencia de rotura de placas y otros problemas intracoronarios que pueden explicar un cuadro capaz de mimetizar un STT (p. ej., hematoma intramural, etc.)8.
En el 38% de los casos incluidos en RETAKO, la coronariografía se llevó a cabo de manera emergente con intención de realizar una angioplastia primaria; en esta serie la fracción de eyección del VI media por ventriculografía fue del 47,27±12,48%4.
Resonancia magnéticaLa resonancia magnética cardiaca es una prueba que nos permite diferenciar el STT del IM, con la evidencia de una necrosis miocárdica en las imágenes a través de ausencia de realce tardío de gadolinio presente en el IM y la presencia de edema miocárdico en el STT con posterior normalización de la fracción de eyección del VI.
Además, las técnicas de medicina nuclear han descrito defectos transitorios metabólicos y de perfusión, alteraciones en el metabolismo de ácidos grasos o de la captación de 123I-MIBG (metil-yodo-bencil-guanidina) o BMIPP (ácido fenil-yodo-pentadecanoico), con distribución anómala de receptores o moduladores celulares (predominio adrenérgicos).
También se ha estudiado el STT mediante biopsia endomiocárdica donde podemos objetivar cambios inflamatorios peculiares (linfocitos, leucocitos y macrófagos) y las típicas bandas de contracción presentes en el STT y en lesiones miocárdicas por catecolaminas como las presentes en la hemorragia subaracnoidea, con posterior reorganización del citoesqueleto y de las proteínas contráctiles14.
Pronóstico y tratamientoDesde sus comienzos siempre se ha referido un pronóstico favorable para el STT, sin embargo recientes estudios difieren de este paradigma. El registro InterTAK comunica una mortalidad al año de un 5,6%8,10. La mortalidad hospitalaria es del 3-5% mayor en sexo masculino y resulta similar al IM con EAC significativa. Los predictores de mortalidad hospitalaria incluyen la edad (>70 años), inestabilidad hemodinámica (shock cardiogénico, uso de catecolaminas), desencadenante físico, sexo masculino y parada cardiaca10. Las formas secundarias presentan claramente una peor evolución8.
Respecto al tratamiento, no existe una terapéutica específica para el STT; varía según la forma de presentación y comorbilidades pero ante la sospecha diagnóstica el paciente es remitido para una coronariografía emergente. Es importante para descartar una oclusión coronaria y su correspondiente angioplastia primaria; por tal motivo el paciente recibirá doble antiagregación plaquetaria, nitratos, anticoagulantes y bloqueadores beta (BB), además de una monitorización estrecha ante el potencial desarrollo de IC, shock cardiogénico o arritmias malignas.
Numerosos estudios han investigado el uso farmacológico de los inhibidores de la enzima de conversión de la angiotensina y los antagonistas del receptor de la angiotensina mostrando una mortalidad menor 1:4 respecto a los no tratados con éstos medicamentos. Brunetti et al. demostraron que la recurrencia del STT también es menor con el uso de inhibidores de la enzima de conversión de la angiotensina o los antagonistas del receptor de la angiotensina, pero estos datos deben ser cuidadosamente interpretados con un tratamiento individualizado a cada paciente.
El papel de los BB también ha sido estudiado aunque no demuestran una prevención clara ante la recurrencia del STT. Templin et al. indican igual mortalidad a un año en pacientes no tratados con BB10. Sin embargo, un reciente análisis de RETAKO en pacientes con shock cardiogénico en el contexto de un STT, con una mortalidad elevada a corto y mediano plazo, indica un potencial beneficio con el uso de BB al alta hospitalaria en pacientes que habían presentado shock durante el ingreso15. Hay que añadir que el shock cardiogénico se presenta en un 9-15% de los pacientes que desarrollan STT y un 4-9% presentan parada cardiaca o necesitan reanimación cardiopulmonar respectivamente.
Como medicamento preferido para tratar la IC, además del soporte habitual, mencionaríamos el levosimendán, con las precauciones necesarias en cuanto al estado de volemia y vigilancia de arritmias: quedan, en principio, los inotrópicos catecolaminérgicos habituales relegados a un segundo lugar dado el mecanismo fisiopatológico del STT.
En algunos casos el uso de soporte mecánico circulatorio se debe tener en cuenta (balón de contrapulsación intraaórtica, oxigenador extracorpóreo de membrana o cualquier tipo de asistencia ventricular izquierda, dando preferencia a las percutáneas) entre otras opciones. Como precaución, en este punto hay que destacar que es preciso vigilar la potencial aparición de obstrucción del TSVI (o corregirla) si vamos a emplear dispositivos que aumenten el gradiente transaórtico (como el balón de contrapulsación).
El uso de la doble terapia antiplaquetaria tampoco mostró diferencias significativas respecto a recurrencia o eventos adversos4, aunque el uso de antiagregación simple, considerando el perfil de los enfermos con STT podría ser de utilidad.
El tratamiento mediante ansiolíticos o antidepresivos aún no está firmemente esclarecido, además algunos medicamentos (antidepresivos tricíclicos, serotonina/norepinefrina) pueden estar contraindicados por riesgo de recurrencia del STT. La psicoterapia y las medidas para disminuir el estrés son medidas recomendadas en general pero no existe evidencia al respecto8.
ComplicacionesLas complicaciones en el STT varían según su presentación clínica y es recomendable un tratamiento personalizado ante cada situación. Podemos citar como más frecuente la IC aguda, que en registros varían del 12-45%, seguido de obstrucción del TSVI con un 10-25%, insuficiencia mitral con un 14-25% y un shock cardiogénico con un 6-20%; estos factores conllevan a una elevación del BNP y elevada presión telediastólica del VI.
Las arritmias en el STT son variables. Se han descrito series con bradiarritmias, enfermedad del nodo sinusal con un 1,3-1,9%, fibrilación auricular con un 4,7%, asistolia, taquicardia supraventricular, taquicardia ventricular no sostenida (tanto monomórfica como torsade de pointes), fibrilación ventricular y hasta la muerte súbita.
La incidencia de fenómenos tromboembólicos es variable. La incidencia de trombo ventricular y accidente cerebrovascular oscila entre un 2,5-8% y un 1-5%, respectivamente. Lógicamente, la presencia de un trombo apical apunta a la necesidad de tratar al paciente con anticoagulación. Esto suele ser transitorio, pues los trombos generalmente desaparecen con la medicación y la resolución de las anomalías contráctiles de VI.
Reflexiones finalesHan pasado más de 3 décadas desde la publicación del primer caso con STT8, la incidencia de esta enfermedad se ha globalizado, y nos hallamos ante una patología compleja que requiere una terapia multidisciplinar e individualizada para cada caso. Muchas veces ante una misma expresión clínica coexisten diversas fisiopatologías, constituyendo un verdadero síndrome, repleto de fenocopias.
Hemos realizado una somera revisión actualizada priorizando los últimos estudios de la literatura científica, remarcando que, aunque aún no se ha logrado desentrañar completamente esta enfermedad, hemos avanzado bastante y hemos aprendido a no subestimarla ni catalogarla siempre como entidad benigna.
Conflicto de interesesNo se declara ninguno en relación con el presente trabajo.