La disfunción sistólica de ventrículo izquierdo (DSVI) es una entidad prevalente, que requiere para su diagnóstico del empleo de tiempo y recursos técnicos especializados. Nuestro objetivo fue construir una puntuación sencilla para el diagnóstico de DSVI basada en variables electrocardiográficas.
MétodosSe recogieron de forma prospectiva los electrocardiogramas de 300 pacientes de consultas de cardiología de un hospital terciario español (150 con DSVI y 150 con función sistólica normal). Se evaluó la asociación de diferentes variables electrocardiográficas con la presencia de DSVI y aquellas variables estadísticamente significativas se incluyeron en un modelo de regresión logística multivariable, con el que se construyó una puntuación predictiva para el diagnóstico de DSVI. Se realizó una validación externa del modelo en 2 muestras, con alta y baja prevalencia de DSVI.
ResultadosLas variables incluidas en el modelo fueron: el número de ondas Q patológicas, la duración de onda R en V6 (≥1,5mm), la presencia de melladuras en onda S y el bloqueo completo de rama izquierda. El área bajo la curva ROC de nuestra puntuación (QRS-L) fue de 0,81 (IC95%, 0,76-0,85). La validación externa del modelo obtuvo un valor predictivo negativo muy elevado (95%) en la muestra con baja prevalencia de DSVI, con lo que su aplicación es especialmente útil para descartar DSVI en poblaciones con baja prevalencia de la misma.
ConclusionesEl QRS-L es una puntuación electrocardiográfica sencilla y rápida que permite descartar la presencia de DSVI en poblaciones con baja prevalencia, evitándose pruebas complementarias más complejas y costosas.
Left ventricular systolic dysfunction (LVSD) is a highly prevalent condition that requires time and specialised technical resources to be diagnosed. This study aims to develop a score based on electrocardiographic variables for the diagnosis of LVSD.
MethodsThe electrocardiograms were prospectively collected from 300 patients followed-up in a Cardiology outpatient clinic at a tertiary care hospital (150 patients with LVSD and 150 with normal systolic function). Different electrocardiographic variables related to the presence of LVSD were evaluated and those statistically significant were included in a multivariate logistic regression model used to assemble a predictive score for LVSD diagnosis. An external validation of the model was performed on 2 samples, one with a high and another one with a low LVSD prevalence.
ResultsThe variables included in the model were: number of pathological Q waves, R wave length in V6 (≥1.5mm), presence of fragmented S waves, and presence of left bundle branch block. The score for the area under the ROC curve (QRS-L) was 0.81 (95% CI, 0.76-0.85). The external validation achieved a very high negative predictive value (95%) in the sample with a low prevalence of LVSD. Therefore, the QRS-L score is especially useful to rule out LVSD in low LVSD prevalence populations.
ConclusionsThe QRS-L score is an easy and quick-to-apply score that can rule out the presence of LVSD in populations with a low prevalence of LVSD, thus avoiding the use of additional, more complex, and expensive tests.
La disfunción sistólica ventricular izquierda (DSVI) es una entidad grave y relativamente frecuente en la práctica clínica habitual1. Para su tratamiento se dispone tanto de medidas farmacológicas como no farmacológicas, entre ellas el uso de dispositivos de estimulación cardiaca, que han demostrado mejoría sintomática y de la supervivencia en estos enfermos, así como disminución de los ingresos hospitalarios2. No obstante, para su implantación adecuada es necesario realizar un diagnóstico correcto previo.
Cualquier médico que trate a pacientes que puedan, potencialmente, presentar DSVI debe, por tanto, hacer frente al diagnóstico de la disfunción ventricular durante la práctica clínica diaria. Para ello se dispone de diversas herramientas, y la más utilizada, por la certeza en el diagnóstico y por la relativa disponibilidad que presenta, es el ecocardiograma transtorácico. Su realización, pese a ser más asequible que otras pruebas de mayor complejidad y coste, requiere de tiempo y personal especializado y su empleo como herramienta de cribado poblacional no es coste-efectivo3,4.
En trabajos previos, se ha propuesto la utilidad del péptido natriurético como marcador para el cribado de DSVI, con resultados prometedores5. Esta valoración requiere, no obstante, de extracción de una muestra de sangre y procesamiento de la misma para obtener la información requerida, con el coste, tiempo e incomodidad para el paciente y para el normal funcionamiento de una consulta ambulatoria que ello plantea.
Por el contrario, el electrocardiograma (ECG) supone una estrategia rápida para guiar la toma de decisiones clínicas y representa una herramienta de bajo coste y alta disponibilidad en cualquier consulta6, rápida y fácil de realizar. Es un dato conocido, además, que la DSVI se asocia frecuentemente con anormalidades en el ECG7,8.
El objetivo de nuestro estudio fue, por tanto, identificar predictores electrocardiográficos de DSVI y elaborar con ellos una herramienta práctica y rápida para descartar la presencia de disfunción ventricular en una consulta de cardiología general o de medicina interna.
MétodosDiseño y población del estudioSe recogieron de forma prospectiva y consecutiva entre septiembre de 2016 y febrero de 2017 los ECG de 300 pacientes adultos valorados en consultas de cardiología de un hospital terciario español, de los cuales 150 pacientes presentaban DSVI y 150 tenían función sistólica ventricular izquierda preservada.
Se definió la presencia de DSVI como una fracción de eyección del ventrículo izquierdo (FEVI) <50%9 observada en ecocardiografía transtorácica mediante el método de Simpson2. Esta prueba se obtenía de la historia del paciente y debía ser reciente (12 meses previos) y haberse realizado en el propio centro.
Evaluación electrocardiográficaA cada paciente se le realizó un ECG de 12 derivaciones estándar, con velocidad 25mm/s y voltaje 10mm/mV. En cada ECG se determinaron, mediante medición directa, los diferentes parámetros estudiados en cada una de las derivaciones: amplitud, duración, profundidad, componente positivo y componente negativo de onda P, supra- e infradesnivelación del segmento ST, duración y profundidad de onda Q, duración, amplitud y presencia o no de melladuras en onda R, duración, profundidad y presencia o no de melladuras en onda S, presencia de T negativa, relación entre R y S, duración total de QRS, tipo de ritmo y alteraciones de la conducción intraventricular. La medición de los parámetros electrocardiográficos fue llevada a cabo por un único operador, cardiólogo, con experiencia en electrocardiografía. Dicho investigador era ciego a los resultados de la ecocardiografía, y asimismo, los operadores que realizaron los estudios ecocardiográficos desconocían los resultados de los ECG.
Se definió la presencia de ondas Q patológicas como el hallazgo de ondas Q de cualquier morfología en las derivaciones V1, V2 o V3, o la presencia de ondas Q de más de 40ms de duración y 0,2mV de profundidad (o >25% de la siguiente onda R) en el resto de derivaciones10-13 (salvo en aVR).
Las melladuras («fragmentación» del QRS) se definieron como irregularidades que alteraban visualmente la línea recta de la vertiente ascendente o descendente de la onda R u onda S del QRS14.
La presencia o ausencia de bloqueo de rama izquierda (BRI) se estableció según los criterios clásicos utilizados en la práctica clínica habitual para identificar BRI (QRS>120ms, QS o rS en V1, onda R monofásica sin onda Q en V6 y DI)15, siempre priorizándose la facilidad de su identificación.
Además de las variables electrocardiográficas, se recogieron variables epidemiológicas y clínicas de los pacientes, entre ellas: edad, sexo, factores de riesgo cardiovascular y patología cardiovascular relevante previa.
Análisis estadísticoConstrucción del modeloLas variables cuantitativas continuas se presentan como media±desviación estándar, y se compararon mediante el test de la t de Student. Las variables cualitativas categóricas se expresan como número absoluto y porcentaje, y se compararon mediante la prueba χ2 y el test de Fisher en los casos necesarios.
Para construir el modelo predictivo, se realizó inicialmente un análisis univariable en el cual se evaluó la asociación de las diferentes medidas electrocardiográficas recogidas con el diagnóstico de DSVI. Aquellas variables estadísticamente significativas en el análisis univariable, y que resultaron clínicamente relevantes (por su facilidad de identificación y de medida), se incluyeron en un modelo de regresión logística multivariable.
El modelo final se construyó mediante el método de todos los subconjuntos, seleccionándose el mejor modelo a partir de todas las posibles ecuaciones, y empleándose como principales indicadores de la capacidad predictiva del modelo la discriminación (determinada mediante el área bajo la curva ROC), la calibración (determinada por la bondad de ajuste mediante el método de Hosmer-Lemeshow) y el índice de información de Akaike. Además, se evaluó la presencia de multicolinealidad mediante la prueba de factor de inflación de la varianza.
La puntuación QRS-LPara crear un sistema de puntuación simplificado y de fácil aplicación, la puntuación QRS-L, se utilizaron valores de 1 y 0 en función de la presencia o ausencia de cada una de las diferentes variables incluidas. La puntuación de cada paciente se calculó simplemente sumando los puntos de acuerdo con la presencia de cada variable del modelo. Por tanto, para un ECG que no presentaba ninguna de las variables del modelo, su puntuación QRS-L fue 0, mientras que para aquel con las 4 variables presentes, la puntuación total fue 4. El punto de corte de la puntuación con mejor relación sensibilidad/especificidad para detectar DSVI obtenido mediante el área bajo la curva ROC fue de 2.
Validación externa de los modelosSe evaluó la capacidad diagnóstica de la puntuación QRS-L en 2 nuevas muestras, 50 ECG consecutivos de pacientes evaluados en una consulta de cardiología convencional y otros 50 ECG de pacientes seguidos en consultas de la unidad de insuficiencia cardiaca de nuestro centro, con el objetivo de valorar el comportamiento del modelo en grupos con prevalencias diferentes de DSVI. En ambas muestras se necesitaba que los pacientes dispusieran de un ecocardiograma durante el último año a partir del cual establecer la presencia o no de disfunción ventricular.
El objetivo de elegir estas 2 muestras diferentes fue evaluar el comportamiento de nuestra puntuación al ser aplicada a poblaciones con diferente prevalencia de DSVI.
La aplicación de la puntuación en estos 2 grupos de pacientes fue llevada a cabo por 2 residentes de cardiología de forma independiente. Estos residentes desconocían si los ECG provenían de pacientes con DSVI o sin ella y se instruyeron en cómo debían hacer las mediciones con indicaciones breves y simples, empleándose menos de 30 segundos en realizar en un ECG las mediciones necesarias para el cálculo de la puntuación.
La capacidad predictiva de la puntuación en estas 2 poblaciones se evaluó mediante análisis del área bajo la curva ROC.
Todas las pruebas estadísticas fueron bilaterales, y se consideró el resultado estadísticamente significativo si el valor de la p≤0,05. El análisis estadístico se realizó utilizando el programa Stata v.12 (StataCorp, College Station, Texas, Estados Unidos).
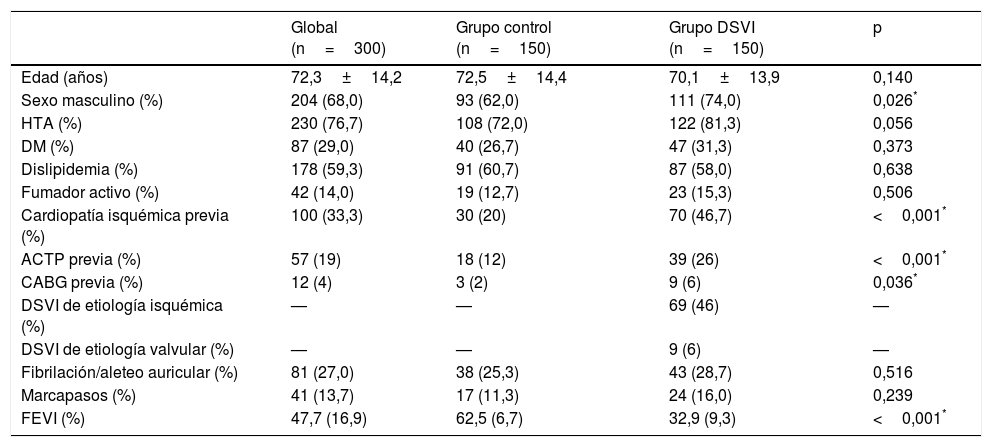
ResultadosCaracterísticas basalesLa muestra estudiada, cuyas características quedan reflejadas en la tabla 1, tenía una edad media de 71,3 años, con un 68% de varones. Un 76,7% de la muestra presentaba hipertensión arterial, un 29% de los pacientes eran diabéticos y un 59,3% tenía dislipidemia. Dichas características se distribuyeron de forma similar en ambos grupos (con la salvedad de que en el grupo de DSVI el porcentaje de varones, síndrome coronario agudo y revascularización previa era ligeramente mayor).
Características basales de la muestra de 300 pacientes
| Global (n=300) | Grupo control (n=150) | Grupo DSVI (n=150) | p | |
|---|---|---|---|---|
| Edad (años) | 72,3±14,2 | 72,5±14,4 | 70,1±13,9 | 0,140 |
| Sexo masculino (%) | 204 (68,0) | 93 (62,0) | 111 (74,0) | 0,026* |
| HTA (%) | 230 (76,7) | 108 (72,0) | 122 (81,3) | 0,056 |
| DM (%) | 87 (29,0) | 40 (26,7) | 47 (31,3) | 0,373 |
| Dislipidemia (%) | 178 (59,3) | 91 (60,7) | 87 (58,0) | 0,638 |
| Fumador activo (%) | 42 (14,0) | 19 (12,7) | 23 (15,3) | 0,506 |
| Cardiopatía isquémica previa (%) | 100 (33,3) | 30 (20) | 70 (46,7) | <0,001* |
| ACTP previa (%) | 57 (19) | 18 (12) | 39 (26) | <0,001* |
| CABG previa (%) | 12 (4) | 3 (2) | 9 (6) | 0,036* |
| DSVI de etiología isquémica (%) | — | — | 69 (46) | — |
| DSVI de etiología valvular (%) | — | — | 9 (6) | — |
| Fibrilación/aleteo auricular (%) | 81 (27,0) | 38 (25,3) | 43 (28,7) | 0,516 |
| Marcapasos (%) | 41 (13,7) | 17 (11,3) | 24 (16,0) | 0,239 |
| FEVI (%) | 47,7 (16,9) | 62,5 (6,7) | 32,9 (9,3) | <0,001* |
ACTP: angioplastia coronaria transluminar percutánea; CABG: cirugía de revascularización coronaria; DM: diabetes mellitus; DSVI: disfunción sistólica ventricular izquierda; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial.
Los datos expresan como n (%) o media±desviación estándar.
Además, un 27% de los pacientes presentaba fibrilación auricular y un 13,7% era portador de marcapasos. El grupo con DSVI presentaba una FEVI media de un 32,9%, mientras que la media de FEVI en el grupo control fue del 62,5%. La etiología más frecuente de DSVI fue la cardiopatía isquémica, que se dio en el 46% de los pacientes.
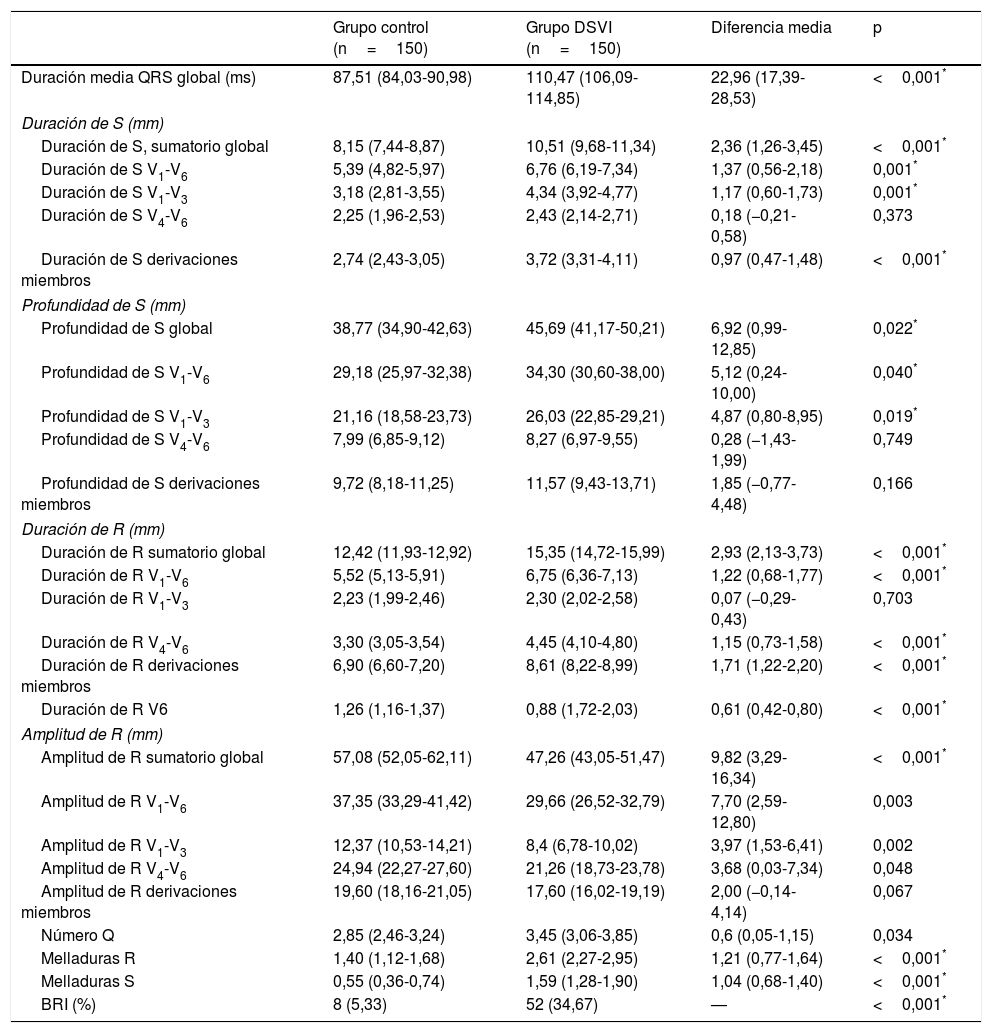
Análisis univariable para disfunción ventricularEn el grupo con DSVI se observó que la duración media del QRS fue mayor que en el grupo control (110,5 frente a 87,5ms; p<0,001). La mayor duración del QRS en los pacientes con DSVI se observó en cada una de las 12 derivaciones estándar por separado (tabla 2), así como en las subdivisiones V1-V6, V1-V3, V4-V6 y derivaciones de los miembros.
Análisis univariable de diferentes parámetros medidos en el electrocardiograma
| Grupo control (n=150) | Grupo DSVI (n=150) | Diferencia media | p | |
|---|---|---|---|---|
| Duración media QRS global (ms) | 87,51 (84,03-90,98) | 110,47 (106,09-114,85) | 22,96 (17,39-28,53) | <0,001* |
| Duración de S (mm) | ||||
| Duración de S, sumatorio global | 8,15 (7,44-8,87) | 10,51 (9,68-11,34) | 2,36 (1,26-3,45) | <0,001* |
| Duración de S V1-V6 | 5,39 (4,82-5,97) | 6,76 (6,19-7,34) | 1,37 (0,56-2,18) | 0,001* |
| Duración de S V1-V3 | 3,18 (2,81-3,55) | 4,34 (3,92-4,77) | 1,17 (0,60-1,73) | 0,001* |
| Duración de S V4-V6 | 2,25 (1,96-2,53) | 2,43 (2,14-2,71) | 0,18 (−0,21-0,58) | 0,373 |
| Duración de S derivaciones miembros | 2,74 (2,43-3,05) | 3,72 (3,31-4,11) | 0,97 (0,47-1,48) | <0,001* |
| Profundidad de S (mm) | ||||
| Profundidad de S global | 38,77 (34,90-42,63) | 45,69 (41,17-50,21) | 6,92 (0,99-12,85) | 0,022* |
| Profundidad de S V1-V6 | 29,18 (25,97-32,38) | 34,30 (30,60-38,00) | 5,12 (0,24-10,00) | 0,040* |
| Profundidad de S V1-V3 | 21,16 (18,58-23,73) | 26,03 (22,85-29,21) | 4,87 (0,80-8,95) | 0,019* |
| Profundidad de S V4-V6 | 7,99 (6,85-9,12) | 8,27 (6,97-9,55) | 0,28 (−1,43-1,99) | 0,749 |
| Profundidad de S derivaciones miembros | 9,72 (8,18-11,25) | 11,57 (9,43-13,71) | 1,85 (−0,77-4,48) | 0,166 |
| Duración de R (mm) | ||||
| Duración de R sumatorio global | 12,42 (11,93-12,92) | 15,35 (14,72-15,99) | 2,93 (2,13-3,73) | <0,001* |
| Duración de R V1-V6 | 5,52 (5,13-5,91) | 6,75 (6,36-7,13) | 1,22 (0,68-1,77) | <0,001* |
| Duración de R V1-V3 | 2,23 (1,99-2,46) | 2,30 (2,02-2,58) | 0,07 (−0,29-0,43) | 0,703 |
| Duración de R V4-V6 | 3,30 (3,05-3,54) | 4,45 (4,10-4,80) | 1,15 (0,73-1,58) | <0,001* |
| Duración de R derivaciones miembros | 6,90 (6,60-7,20) | 8,61 (8,22-8,99) | 1,71 (1,22-2,20) | <0,001* |
| Duración de R V6 | 1,26 (1,16-1,37) | 0,88 (1,72-2,03) | 0,61 (0,42-0,80) | <0,001* |
| Amplitud de R (mm) | ||||
| Amplitud de R sumatorio global | 57,08 (52,05-62,11) | 47,26 (43,05-51,47) | 9,82 (3,29-16,34) | <0,001* |
| Amplitud de R V1-V6 | 37,35 (33,29-41,42) | 29,66 (26,52-32,79) | 7,70 (2,59-12,80) | 0,003 |
| Amplitud de R V1-V3 | 12,37 (10,53-14,21) | 8,4 (6,78-10,02) | 3,97 (1,53-6,41) | 0,002 |
| Amplitud de R V4-V6 | 24,94 (22,27-27,60) | 21,26 (18,73-23,78) | 3,68 (0,03-7,34) | 0,048 |
| Amplitud de R derivaciones miembros | 19,60 (18,16-21,05) | 17,60 (16,02-19,19) | 2,00 (−0,14-4,14) | 0,067 |
| Número Q | 2,85 (2,46-3,24) | 3,45 (3,06-3,85) | 0,6 (0,05-1,15) | 0,034 |
| Melladuras R | 1,40 (1,12-1,68) | 2,61 (2,27-2,95) | 1,21 (0,77-1,64) | <0,001* |
| Melladuras S | 0,55 (0,36-0,74) | 1,59 (1,28-1,90) | 1,04 (0,68-1,40) | <0,001* |
| BRI (%) | 8 (5,33) | 52 (34,67) | — | <0,001* |
BRI: bloqueo de rama izquierda; Grupo control: grupo sin disfunción ventricular; Grupo DSVI: grupo con disfunción sistólica de ventrículo izquierdo.
Las variables se expresan como medias (intervalo de confianza del 95%) o como número absoluto (%).
Respecto a los diferentes elementos del complejo QRS, en los pacientes del grupo con DSVI se observó una mayor duración de las ondas S (sumatorio del total de derivaciones, sumatorio de derivaciones precordiales V1-V6, precordiales derechas V1-V3, y derivaciones de miembros), así como mayor profundidad de ondas S (sumatorio del total de derivaciones, de precordiales y de precordiales derechas), y mayor duración de la onda R (total de derivaciones, precordiales izquierdas V4-V6, y derivaciones de miembros). La amplitud de la onda R fue menor en el grupo de DSVI (sumatorio del total de derivaciones, de precordiales, precordiales izquierdas, precordiales derechas y derivaciones de miembros) que en el grupo control (tabla 2).
Se observó, además, un mayor número de ondas Q patológicas en aquellos pacientes con DSVI que en el grupo control (3,5 frente a 2,9; p<0,001).
Respecto a las alteraciones de la conducción, la presencia de BRI fue más frecuente en los pacientes con DSVI (34,7 frente al 5,3%; p<0,001).
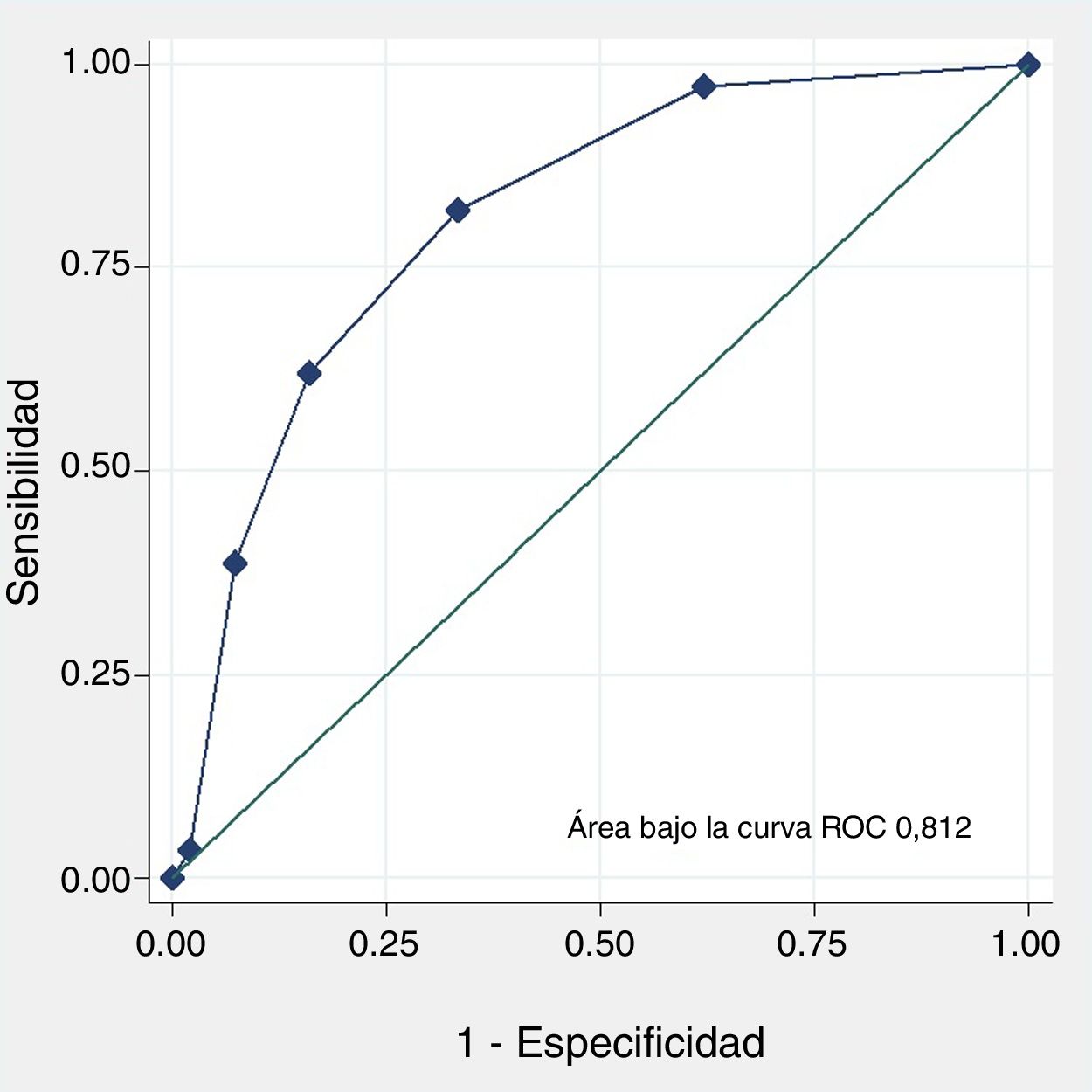
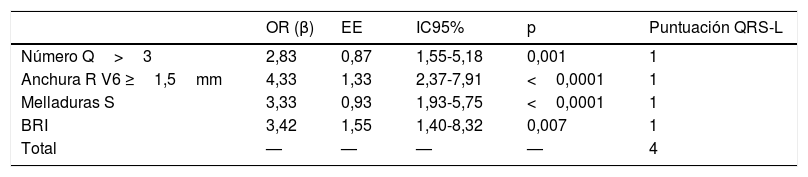
Modelo predictivo de disfunción sistólica ventricular izquierdaLas variables que se asociaron de forma independiente con la presencia de DSVI en el análisis multivariable, y que formaron parte del modelo final fueron: presencia de más de 3 ondas Q patológicas, duración de onda R en V6 superior a 60ms (1,5mm), presencia o ausencia de melladuras en onda S y presencia o ausencia de BRI (tabla 3). La discriminación del modelo fue buena (área bajo la curva ROC de 0,82; intervalo de confianza del 95% [IC95%], 0,77-0,86), al igual que la calibración (p de Hosmer-Lemeshow=0,258).
Variables electrocardiográficas predictoras independientes de disfunción ventricular izquierda obtenidas en el análisis de regresión logística, y su correspondiente sistema de puntuación
| OR (β) | EE | IC95% | p | Puntuación QRS-L | |
|---|---|---|---|---|---|
| Número Q>3 | 2,83 | 0,87 | 1,55-5,18 | 0,001 | 1 |
| Anchura R V6 ≥1,5mm | 4,33 | 1,33 | 2,37-7,91 | <0,0001 | 1 |
| Melladuras S | 3,33 | 0,93 | 1,93-5,75 | <0,0001 | 1 |
| BRI | 3,42 | 1,55 | 1,40-8,32 | 0,007 | 1 |
| Total | — | — | — | — | 4 |
BRI: bloqueo de rama izquierda; EE: error estándar; OR/coeficiente β: odds ratio.
Para facilitar la aplicación práctica del modelo, se desarrolló un sistema de puntuación binario, otorgando valores de 0 o 1 en función de la presencia o ausencia de cada variable (tabla 3). Dicha puntuación obtuvo una muy buena capacidad predictiva, con un área bajo la curva ROC de 0,81 (IC95%, 0,76-0,85) (fig. 1).
El punto de corte de la puntuación QRS-L con mejor relación sensibilidad/especificidad para detectar DSVI fue de 2, lográndose una sensibilidad del 82%, una especificidad del 67%, un valor predictivo positivo del 71% y un valor predictivo negativo del 79%.
El riesgo predicho de presentar DSVI de acuerdo con la presencia de las diferentes variables predictoras electrocardiográficas y la puntuación obtenida en la puntuación QRS-L se presenta en la figura 2.
Un ejemplo del cálculo de la puntuación QRS-L en 2 pacientes diferentes, con y sin DSVI, se muestra en el material adicional.
Validación externa de la puntuaciónEn la muestra obtenida en la consulta de cardiología se observó una prevalencia de un 8% de disfunción ventricular. Al aplicar nuestra puntuación, y usándose como punto de corte para el diagnóstico de disfunción ventricular una puntuación ≥2, se obtuvo una sensibilidad del 50%, una especificidad del 83%, un valor predictivo positivo del 20% y un valor predictivo negativo del 95%. El área bajo la curva ROC en esta población resultó de 0,66 (IC95%, 0,51-0,79).
En la muestra obtenida en la consulta de la unidad de insuficiencia cardiaca, con una prevalencia de disfunción ventricular de un 50%, se obtuvieron valores de sensibilidad del 69%, especificidad del 76%, valor predictivo negativo del 64% y valor predictivo positivo del 80%. En esta muestra el área bajo la curva ROC fue de 0,73 (IC95%, 0,58-0,84).
DiscusiónEn el presente trabajo se ha desarrollado y validado una puntuación electrocardiográfica, QRS-L, que permite descartar de forma rápida la presencia de DSVI al realizar simplemente un ECG de 12 derivaciones. La puntuación QRS-L incluye 4 parámetros electrocardiográficos simples: número de ondas Q patológicas; duración de onda R en V6>60ms (1,5mm); presencia de melladuras en la onda S y presencia de BRI. Todas ellas son fáciles de reconocer y rápidas de medir en un ECG basal realizado en la propia consulta.
Con respecto a la detección de BRI, y pese a que hay varias definiciones del mismo que buscan un diagnóstico lo más preciso posible16, se decidió elegir la definición clásica de BRI (QRS>120ms, QS o rS en V1, onda R sin Q en V6 y DI) por ser más sencilla y comúnmente conocida.
Es interesante analizar cómo la capacidad predictiva de nuestro modelo varía dependiendo de la prevalencia de DSVI de la población a la que se aplica. En la muestra de desarrollo de la puntuación y en la muestra de validación de consulta de la unidad de insuficiencia cardiaca (alta prevalencia de DSVI) los valores predictivos positivo y negativo son similares (80 y 64%, respectivamente), mientras que al aplicar nuestra puntuación a la muestra de validación de la consulta de cardiología general (baja prevalencia de DSVI, similar a la que se presenta en la población general17), el valor predictivo negativo del modelo se incrementó notablemente (95%), mientras que su valor predictivo positivo se redujo (20%). En consecuencia, esta última muestra parece una diana perfecta para descartar DSVI mediante nuestra puntuación.
De estos hallazgos se puede extrapolar que, si bien nuestra puntuación es útil prediciendo la presencia de DSVI en una población con alta prevalencia de disfunción ventricular, su utilidad es aún mayor para descartar la presencia de DSVI al ser aplicada a una población con prevalencia baja, similar a la que se puede encontrar en la población general (cercana al 5%17) y que es comparable a una consulta de cardiología general o de atención primaria.
El cribado y el diagnóstico precoz de la DSVI mediante ECG ya se ha abordado previamente en la literatura. Hay diversos trabajos que trataron de valorar algoritmos diagnósticos electrocardiográficos para identificar a dichos pacientes con mayor o menor éxito, si bien en ningún caso se realizó validación externa de los mismos.
En algunos casos estos trabajos se han centrado exclusivamente en muestras con prevalencia alta de DSVI8,18, obteniéndose una escasa utilidad adicional del ECG sobre la clínica en el cribado de DSVI; o en pacientes de características específicas, como es el caso de poblaciones ancianas19, con resultados prometedores pero que no permiten su extrapolación a la población general.
En otros estudios, pese a lograr buena capacidad predictiva, se proponen multitud de parámetros electrocardiográficos, para los que es preciso tener conocimientos avanzados de electrocardiografía y buscar activamente cada uno de ellos, lo que incrementa la complejidad de los algoritmos20.
Hay también varios artículos en los que se proponen algoritmos que implican determinación de valores analíticos16-21, hecho que aumenta el tiempo y el coste del proceso.
En el caso de nuestra puntuación, si bien se analizaron los signos electrocardiográficos ya propuestos en trabajos previos, se seleccionaron 4 parámetros que son sencillos de medir en el ECG basal, y que combinados en el modelo consiguen una buena capacidad predictiva. La medición de estas 4 variables se puede realizar de forma rápida y no precisa de un periodo de entrenamiento previo, como se ha demostrado en la validación externa del modelo, que fue realizada por cardiólogos en formación.
Esta facilidad para la medición de los parámetros electrocardiográficos hace que la puntuación propuesta en el presente trabajo suponga una herramienta muy atractiva para el cribado de DSVI en consultas, por 3 razones fundamentales: no son necesarios conocimientos electrocardiográficos especializados, consume poco tiempo y recursos técnicos, y tiene un elevado valor predictivo negativo para excluir DSVI en esta población.
Por todo ello, se considera que el algoritmo que se propone permite descartar de manera razonable la presencia de DSVI en este tipo de pacientes, lo que puede contribuir a disminuir el número de estudios de imagen y estudios analíticos innecesarios y a identificar a aquellos pacientes que se puedan beneficiar de un estudio más exhaustivo.
LimitacionesNuestro trabajo presenta varias limitaciones. En primer lugar, los artefactos de estimulación del ECG en pacientes portadores de marcapasos, que alteran la morfología del QRS basal, pueden suponer falsos positivos. La muestra para desarrollar la puntuación incluía pacientes con marcapasos, pero la proporción de los mismos fue baja (13%). Los pacientes en ambas muestras de validación presentaban conducción ventricular propia.
Además, signos electrocardiográficos complejos, y combinaciones de parámetros en múltiples derivaciones, no se incluyeron en el modelo, con el objetivo de facilitar la aplicación práctica y rápida de la escala y limitar el número de cálculos que podrían ser engorrosos y difíciles de interpretar. Entre ellos se encuentran parámetros potencialmente interesantes como predictores de DSVI, como la dispersión de los complejos QRS22, pero que han quedado fuera de este trabajo por el objetivo de sencillez ya discutido.
Por último, la capacidad predictiva de nuestra puntuación para descartar DSVI es limitada en muestras con alta prevalencia de DSVI, por su alta tasa de falsos negativos, y en este ámbito no debe emplearse como herramienta de cribado.
ConclusionesLa puntuación QRS-L es un algoritmo sencillo que permite descartar de forma rápida la presencia de DSVI con un alto valor predictivo negativo en pacientes no seleccionados de consultas de cardiología general y medicina interna.
Por lo tanto, nuestra puntuación podría ser útil para identificar a los pacientes que se beneficiarían de un estudio más exhaustivo.
Conflicto de interesesNinguno.
- -
En la actualidad se sabe que el ECG de un paciente con disfunción ventricular raramente es normal por completo, por lo que parece interesante basar un posible diagnóstico precoz de dicha patología en una técnica tan sencilla y económica.
- -
En ese ámbito ya se ha trabajado para aportar posibles esquemas electrocardiográficos apoyados por otras técnicas diagnósticas de cara a realizar un cribado precoz de dicha patología. No obstante, los estudios previos al respecto planteaban esquemas complejos y engorrosos para realizar dicho cribado, siendo poco prácticos y en muchos casos ineficientes o poco aplicables a la población general.
- -
Nuestro trabajo aporta un sistema rápido y muy sencillo (puntuación QRS-L), obtenido a partir de una muestra propia de pacientes, y basado en parámetros electrocardiográficos fáciles de recordar y de aplicar, útil para descartar disfunción ventricular en pacientes valorados en consultas externas de cardiología.
- -
La puntuación QRS-L permite identificar a los pacientes que no precisan de técnicas diagnósticas más complejas, y seleccionar aquellos que se benefician de pruebas de mayor complejidad y coste.