Es necesario mejorar la estratificación del riesgo de muerte súbita (MS) en pacientes con miocardiopatía dilatada (MCD). El objetivo de nuestro estudio fue evaluar predictores clínicos y de cardiorresonancia magnética que identifiquen a los pacientes con MCD con mayor riesgo de MS.
MétodosEstudio multicéntrico y retrospectivo. Se incluyó a 386 pacientes con MCD y fracción de eyección del ventrículo izquierdo <50%. Se evaluaron parámetros clínicos y de cardiorresonancia, analizando el realce tardío de gadolinio (RTG) según su patrón y localización. El evento primario se definió como un compuesto de MS y MS abortada. Los eventos se asignaron mediante revisión de historia clínica y dispositivos.
ResultadosTras un seguimiento de 4,9 años (P25-75: 3,1-7,1) se registraron 27 eventos primarios (6,98%). En los modelos multivariantes se asociaron a un mayor riesgo del evento primario: síncope, tiempo de evolución de MCD> 1 año, presencia de RTG, patrón subepicárdico de RTG, coexistencia de múltiples patrones de RTG, RTG en múltiples localizaciones y fracción de eyección biventricular <35%. Los modelos multivariantes mostraron un índice C de 0,90 a 0,91 (IC95%, 0,84-0,96), con una buena calibración.
ConclusionesEn nuestro estudio, aparte de la presencia de RTG, algunos parámetros clínicos (síncope y tiempo de evolución de la MCD> 1 año), la caracterización del RTG y la fracción de eyección biventricular <35% identificaron a los pacientes con MCD con mayor riesgo de MS o MS abortada. Nuestros modelos predictivos mostraron una excelente precisión. Estudios prospectivos serán necesarios para confirmar estos datos.
Sudden cardiac death (SCD) risk stratification needs to be improved in patients with dilated cardiomyopathy (DCM). The aim of our study was to identify clinical and cardiac magnetic resonance predictors that could identify patients with DCM at higher risk of SCD.
MethodsMulticenter, retrospective study. We included 386 patients with DCM and left ventricular ejection fraction <50%. The presence of late gadolinium enhancement (LGE) was evaluated and then characterized according to its pattern and location. Primary event was defined as a composite of SCD and aborted SCD. Events were assigned through clinical records review.
ResultsAfter a 4.9-year follow-up (P25-75: 3.1-7.1) 27 primary events (6.98%) were registered. In multivariate models the following variables were associated with higher risk of the primary event: History of syncope, time since diagnosis of DCM> 1 year, LGE presence, subepicardial pattern of LGE, multiple coexisiting LGE patterns, LGE in multiple locations and biventricular ejection fraction <35%. Multivariate competing risk models showed C-index of 0.90 to 0.91 (95%CI, 0.84-0.96), with good calibration.
ConclusionsIn patients with DCM, beyond LGE presence, clinical parameters (syncope and DCM evolution time> 1 year), characterization of LGE and biventricular ejection fraction <35% identified patients with DCM at higher risk of SCD/aborted SCD. Our SCD predictive competing risks models showed excellent accuracy. Further studies will be needed to confirm these results.
Es necesario mejorar la estratificación del riesgo de muerte súbita cardiaca (MS) en pacientes con miocardiopatía dilatada (MCD), especialmente a raíz de estudios como el ensayo DANISH1.
El riesgo de MS ha disminuido desde los estudios iniciales debido a las mejoras en el tratamiento médico y la terapia de resincronización cardiaca. Las indicaciones actuales de un desfibrilador automático implantable en prevención primaria, que se basan principalmente en la presencia de una fracción de eyección del ventrículo izquierdo (FEVI) de <35% y la clase funcional2, no son suficientes para identificar a la mayoría de los pacientes que presentan una MS3. Además, la MCD engloba un grupo heterogéneo de cardiopatías con diferentes riesgos arrítmicos. Mientras se sigue investigando sobre las diferentes etiologías y factores genéticos de las enfermedades de este grupo, los datos morfológicos y funcionales proporcionados por la cardiorresonancia magnética (CRM) pueden ayudar a identificar subgrupos de pacientes con mayor riesgo de MS. Numerosos estudios han señalado que la presencia de realce tardío de gadolinio (RTG) se asocia a un mayor riesgo de MS4-7, aunque su influencia cuantitativa sigue siendo controvertida5,6. Además, pocos estudios han examinado la relación entre la caracterización cualitativa del RTG y el riesgo de MS5,8,9.
Por lo tanto, el presente estudio tuvo como objetivo evaluar qué predictores clínicos y de CRM pueden ayudar a identificar a los pacientes con MCD y FEVI <50% con mayor riesgo de MS. El estudio se centró en una caracterización cualitativa del RTG que permitiera un amplio uso en la mayoría de los centros con CRM.
MétodosDiseño del estudioEste estudio retrospectivo, multicéntrico y observacional se realizó en 5 centros hospitalarios de la misma comunidad autónoma. Se realizó un seguimiento prospectivo de los pacientes para detectar eventos después de la CRM. El protocolo del estudio fue aprobado por el Comité de Ética autonómico. Al ser un estudio observacional y retrospectivo, el Comité de Ética de la Investigación con Medicamentos de Euskadi permitió la exención de recabar el consentimiento informado a los pacientes, manteniendo siempre su anonimato mediante la codificación de los datos. El mismo Comité, de acuerdo con la ley 14/2007 de Investigación Biomédica, principios éticos de la Declaración de Helsinki y el resto de los principios éticos y legislación aplicable, ha emitido un informe favorable a la realización de este estudio.
Población a estudioSe incluyó a 386 pacientes con MCD tratados en los 5 centros del estudio entre 2005 y 2018. Los datos se obtuvieron de los registros de CRM de cada centro. Los criterios de inclusión fueron los siguientes: a) diagnóstico clínico de MCD basado en la presencia de disfunción sistólica del ventrículo izquierdo10 (es decir, FEVI <50% determinada por CRM), en ausencia de enfermedad arterial coronaria que pudiera explicar el grado de disfunción; b) disponibilidad de estudio de CRM con imágenes de RTG y c) edad ≥ 18 años.
Los criterios de exclusión fueron la cardiopatía isquémica como causa de la disfunción del ventrículo izquierdo, el antecedente de infarto de miocardio, la presencia de RTG subendocárdico aislado en la CRM, la etiología valvular, la miocarditis aguda, la miocardiopatía hipertrófica, la miocardiopatía restrictiva, la sospecha de enfermedad infiltrativa, la miocardiopatía arritmogénica con afectación aislada del ventrículo derecho y la taquimiocardiopatía.
La presencia de cardiopatía isquémica significativa se descartó mediante angiografía coronaria invasiva (207 pacientes), angio-TC de arterias coronarias (24 pacientes) o pruebas de detección de isquemia (19 pacientes). En 23 casos, debido al bajo riesgo de enfermedad arterial coronaria, no se realizaron pruebas adicionales. En el resto de los pacientes no se realizaron otras pruebas al no presentar realce isquémico en la CRM.
Imágenes de cardiorresonancia magnéticaTodos los estudios de CRM se efectuaron en los 5 centros hospitalarios participantes con escáneres clínicos de 1,5 T, de acuerdo con la práctica institucional local.
Se utilizaron protocolos de adquisición estandarizados con sincronización del electrocardiograma y de la apnea posrespiratoria, con secuencias de precesión libre en estado estacionario (SSFP) de eje corto y vistas convencionales de eje largo (2 cámaras, 4 cámaras y 3 cámaras). Se tomaron secuencias de inversión-recuperación adquiridas 10-15 min después de la administración intravenosa del agente de contraste de gadolinio a una dosis de 0,1-0,2 mmol/kg para el realce tardío.
El posprocesado de las imágenes se hizo de acuerdo con los procedimientos habituales de cada centro. Expertos en cardiorresonancia de cardiología y radiología realizaron el análisis y la interpretación de los estudios.
La presencia de RTG se valoró de manera cualitativa (evaluación visual) de acuerdo con métodos previamente publicados11. Según su patrón mural se clasificó como subendocárdico, intramiocárdico, subepicárdico o transmural; según su localización, como anterior, lateral, inferolateral, inferior y septal. Se excluyó del estudio a los pacientes con realce subendocárdico aislado. Las pequeñas captaciones puntiformes de RTG que se observan con frecuencia en los puntos de inserción del ventrículo derecho en el septo interventricular no se consideraron patológicas.
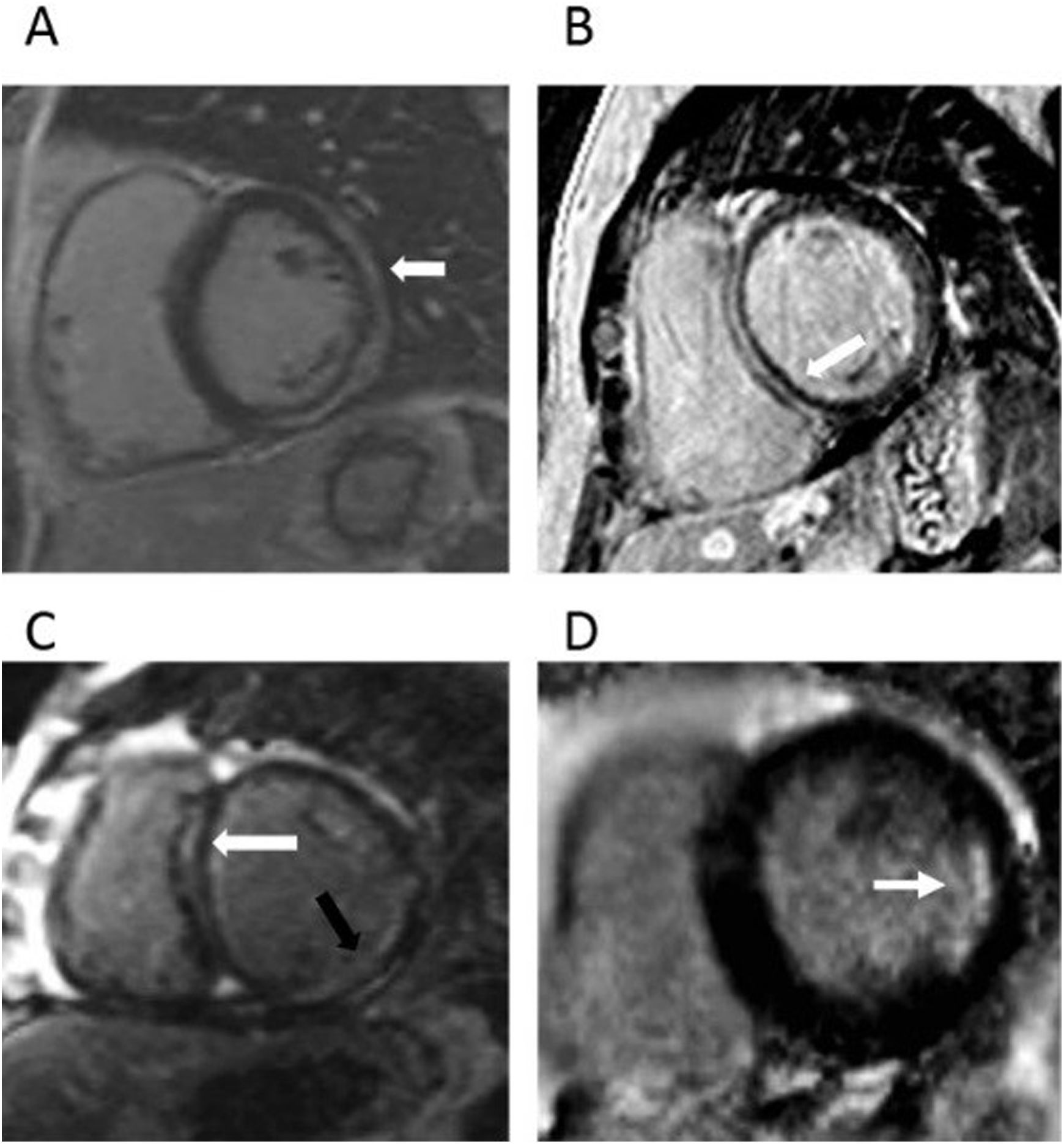
Se notificaron los patrones RTG concomitantes en los casos en que estuvieran presentes, pudiendo, por tanto, coexistir hasta 4 tipos diferentes. Asimismo, se contabilizó el número de localizaciones con realce tardío, en el caso de observarse más de una (fig. 1).
Patrones de realce tardío de gadolinio. A) Patrón subepicárdico de realce tardío de gadolinio (RTG) (flecha). B) Patrón intramiocárdico de RTG (flecha). C) Patrón intamiocárdico septal (flecha blanca) y patrón subendocárdico lateral (flecha negra) coexistentes en un mismo paciente. D) Patrón subencodárdico aislado (flecha).
Se revisaron retrospectivamente las historias clínicas entre mayo de 2019 y marzo de 2020. El periodo de seguimiento comenzó en la fecha en que se realizó el estudio de CRM y terminó cuando se produjo un evento o el último contacto con el paciente. Cada centro participante revisó y recogió los datos de los pacientes, que se enviaron al centro coordinador de forma anónima para su análisis.
En caso de duda sobre la causa de la muerte, un comité formado por 2 cardiólogos del centro coordinador, que desconocían los datos de la CRM, determinaba la causa de la muerte, con el apoyo de la sección de electrofisiología para la revisión de los registros de dispositivos si era necesario.
El evento primario fue un compuesto que incluía tanto la MS como la MS abortada. La MS se definió como la muerte natural instantánea o la que se produce hasta una hora después del inicio de los síntomas cardiacos en ausencia de deterioro progresivo, así como la muerte durante el sueño o en las 24 h siguientes a la última vez que se le vio con vida. La MS abortada se definió como una descarga apropiada del desfibrilador automático implantable, una reanimación cardiopulmonar exitosa tras una fibrilación ventricular o una taquicardia ventricular sostenida con compromiso hemodinámico y necesidad de cardioversión.
Análisis estadísticoLas características y las variables de resultado de la cohorte de pacientes se presentan como frecuencias y porcentajes, medias±desviaciones estándar, o medianas y rangos intercuartílicos, según corresponda.
Se compararon las variables sociodemográficas y clínicas entre los pacientes con y sin realce. Para ello, se utilizó el test de χ2 (o el test exacto de Fisher, si fuera necesario) para las variables categóricas, mientras que para las variables continuas se utilizó la prueba no paramétrica de Wilcoxon para muestras independientes.
Se evaluó la mortalidad del paciente, tanto la mortalidad específica por MS o MS abortada como por otras causas (tabla 1 del material adicional). Más precisamente, nuestro evento de interés se consideró un evento combinado de MS o MS abortada. Se generaron curvas de incidencia acumulada de MS según la presencia de RTG, y se evaluaron las diferencias entre los 2 grupos mediante el test de Gray. Se desarrollaron modelos de regresión de riesgos competitivos Fine-Gray univariantes y multivariantes12,13 para determinar si las variables sociodemográficas, las características clínicas y los hallazgos de la CRM se asociaban significativamente con un mayor riesgo del evento primario. Además de las variables anteriores, se evaluó la influencia de la interacción entre la FEVI y la fracción de eyección del ventrículo derecho (FEVD). Con el fin de evaluar la influencia del RTG en sus distintos aspectos (presencia/ausencia de RTG; tipo de patrón de RTG: subepicárdico, intramiocárdico, otros patrones RTG; número de patrones de RTG y número de localizaciones de RTG: 0, 1 o múltiple), se desarrolló un modelo multivariante para cada uno de estos aspectos del RTG. Esto es debido a que, al considerar al menos 2 aspectos del RTG arriba mencionados en el mismo modelo, se produce una sobrestimación de los riesgos correspondientes. En cada uno de los modelos multivariantes se consideraron variables independientes aquellas con valores de p<0,20. El modelo final se obtuvo mediante el procedimiento backward. Este modelo se ajustó por edad y sexo del paciente. El supuesto de proporcionalidad de las razones de riesgo (HR) del modelo se estableció mediante los residuos de Schoenfeld. Todos los resultados se expresaron en términos de HR y su correspondiente intervalo de confianza del 95% (IC95%). Para evaluar la capacidad discriminativa del modelo, se calculó el índice C de Harrell (un valor C> 0,80 se considera bueno) y se evaluó la calibración de los modelos multivariantes mediante la prueba de Gronnesby y Borgan (un valor p> 0,05 indica una buena calibración). Se utilizó la técnica de remuestreo (bootstrap) para evaluar el grado de estabilidad del estadístico C utilizando 1.000 réplicas.
Todos los cálculos estadísticos se hicieron y todas las figuras se generaron utilizando R 4.0.3. La significación estadística se fijó en p<0,05.
ResultadosCaracterísticas básicas de la población del estudioLa cohorte final incluyó a 386 pacientes con una edad media de 59 años (desviación estándar: 13-46) (fig. 1 del material adicional y tabla 1). Un total de 269 (69%) pacientes eran varones. La mediana de la FEVI fue del 32,60% (P25-75: 24-42), y el 44% de la muestra presentaba una FEVI> 35%. El 34% de la población presentaba RTG en la CRM. Durante el seguimiento, se implantó un desfibrilador automático en prevención primaria en 48 pacientes, y terapia de resincronización cardiaca en 36 pacientes. Hubo una pérdida de seguimiento y no se pudo determinar la causa de la muerte en 2 pacientes, por lo que se excluyeron del estudio.
Características basales de los pacientes según la presencia de RTG
| RTG −(n=255) | RTG +(n=131) | Total(n=386) | p | |
|---|---|---|---|---|
| Parámetros clínicos y sociodemográficos | ||||
| Varones | 159 (62,4) | 110 (83,9) | 269 (69,7) | <0,01 |
| Edad, años | 59,2±13,0 | 58,6±14,4 | 58,9±13,5 | 0,77 |
| Edad ≤ 67 años | 169 (66,3) | 98 (74,8) | 267 (69,2) | 0,10 |
| Fumador | 53 (22,6) | 38 (30,9) | 91 (25,4) | 0,14 |
| Hipertensión | 127 (51,6) | 72 (56,3) | 199 (53,2) | 0,44 |
| Dislipidemia | 87 (35,4) | 53 (43,1) | 140 (37,9) | 0,17 |
| Diabetes mellitus | 41 (16,5) | 31 (24,8) | 72 (19,3) | 0,07 |
| Abuso de alcohol* | 42 (17,4) | 31 (25) | 73 (19,9) | 0,21 |
| AP de síncope | 19 (7,5) | 11 (8,5) | 30 (7,9) | 0,84 |
| AP de palpitaciones | 31 (12,4) | 10 (7,6) | 41 (10,8) | 0,17 |
| AP de fibrilación auricular | 60 (24,1) | 47 (36,2) | 107 (28,2) | 0,02 |
| AP de muerte súbita abortada | 4 (1,6) | 1 (0,8) | 5 (1,3) | 0,66 |
| AP de taquicardia ventricular | 7 (2,8) | 10 (7,6) | 17 (4,5) | 0,04 |
| AP de insuficiencia cardiaca | 98 (40) | 49 (39,2) | 147 (39,7) | 0,91 |
| Historia familiar de MCD | 17 (6,7) | 12 (9,2) | 29 (7,5) | 0,42 |
| Tiempo evolución MCD, años | 1,11±3,0 | 2,39±5,0 | 1,54±3,9 | 0,35 |
| Tiempo evolución MCD, | 0,02 | |||
| <1 año | 208 (81,6) | 93 (71,0) | 301 (78,0) | |
| ≥1 año | 47 (18,4) | 38 (29,0) | 85 (22,0) | |
| NYHA | 0,56 | |||
| I | 57 (31,5) | 31 (35,2) | 88 (32,7) | |
| II | 84 (46,4) | 33 (37,5) | 117 (43,5) | |
| III | 38 (19,9) | 22 (25) | 58 (21,6) | |
| IV | 3 (2,2) | 2 (2,3) | 6 (2,2) | |
| PAS, mmHg | 130 [119-141] | 130 [118-140] | 130 [119-140] | 0,98 |
| FC, lpm | 81 [70-98] | 79,50 [68-98] | 80 [70-98] | 0,31 |
| Creatinina | 0,9 [0,8-1,1] | 1,0 [0,8-1,2] | 0,9 [0,8-1,2] | 0,03 |
| BRIHH | 103 (41,4) | 36 (28,1) | 139 (36,9) | 0,01 |
| QRS> 140 ms | 19 (7,5) | 9 (6,9) | 28 (7,3) | 1 |
| IECA/ARA-2 | 200 (79,1) | 117 (90) | 317 (82,8) | 0,01 |
| BB | 191 (75,5) | 106 (81,5) | 297 (77,6) | 0,20 |
| ARM | 97 (37,9) | 72 (55,4) | 168 (43,9) | <0,01 |
| Amiodarona | 7 (2,8) | 5 (3,9) | 12 (3,1) | 0,55 |
| Sacubitrilo-valsartán | 1 (0,4) | 1 (0,8) | 2 (0,5) | 1 |
| DAI | 40 (15,7) | 19 (14,5) | 59 (15,3) | 0,88 |
| TRC | 30 (11,8) | 9 (6,9) | 39 (10,1) | 0,16 |
| Parámetros de CRM | ||||
| FEVI % | 33 [26-41] | 30 [22-40] | 33,0 [24-42] | 0,07 |
| FEVI ≥35% | 117 (47,2) | 50 (38,5) | 167 (44,2) | 0,13 |
| VTDVI, ml/m2 | 117 [98-150] | 127 [108-153] | 121 [101-152] | 0,06 |
| VTSVI, ml/m2 | 73 [59-112] | 86 [66-122] | 79 [60-113] | 0,02 |
| Masa, g/m2 | 79 [67-98] | 88 [71-103] | 83 [68-99] | 0,06 |
| FEVD % | 48 [39-59] | 44 [35-53] | 47 [36-58] | 0,01 |
| FEVD <35% | 34 (16,7) | 28 (24,8) | 62 (19,6) | 0,10 |
| VTDVD, ml/m2 | 78 [64-99] | 91 [70-114] | 81 [29-63] | 0,01 |
| FEVI combinado con FEVD | 0,08 | |||
| FEVI ≥ 35%, | 102 (50,3) | 42 (37,2) | 144 (45,6) | |
| FEVI <35%, FEVD ≥ 35% | 68 (33,5) | 46 (40,7) | 114 (36,1) | |
| FEVI <35%, FEVD <35% | 33 (16,3) | 25 (22,1) | 58 (18,4) | |
AP: antecedente personal; ARM: antagonista del receptor mineralocorticoide; BB: bloqueadores beta; BRIHH: bloqueo de rama izquierda del haz de His; CRM: cardiorresonancia magnética; DAI: desfibrilador automático implantable; FC: frecuencia cardiaca; FEVD: fracción de eyección de ventrículo derecho; FEVI: fracción de eyección de ventrículo izquierdo; IC95%: intervalo de confianza del 95%; IECA/ARA-2: inhibidor de la enzima de conversión de angiotensina/antagonista del receptor de angiotensina II; MCD: miocardiopatía dilatada; NYHA: New York Heart Association; PAS: presión arterial sistólica; sHR: sub-hazard ratio; TRC: terapia de resincronización cardiaca; VTDVIi: volumen telediastólico de ventrículo izquierdo indexado; VTSVIi: volumen telesistólico de ventrículo izquierdo indexado; VTDVDi: volumen telediastólico de ventrículo derecho indexado; VTSVDi: volumen telesistólico de ventrículo derecho indexado.
Abuso de alcohol: más de 3 bebidas en cualquier día o más de 7 bebidas a la semana para los varones mayores de 65 años y para las mujeres, y más de 4 bebidas en cualquier día o más de 14 bebidas a la semana para los varones de 65 años o menos.
Los datos expresan n (%), media±desviación estándar o mediana [rango intercuartílico].
Los pacientes con RTG eran más frecuentemente varones, tenían una mayor incidencia de fibrilación auricular y más antecedentes de miocarditis que los que no presentaban RTG. Asimismo, tenían una FEVD inferior y unos mayores volúmenes biventriculares, junto con una FEVI inferior (no significativa), que los que no tenían RTG. Por último, el tratamiento era más intensivo inicialmente en los pacientes con RTG.
El patrón de RTG más frecuente fue el intramiocárdico (116 pacientes, 88,6%), seguido del subepicárdico (30 pacientes, 22,9%), el transmural (10 pacientes, 7,6%) y el subendocárdico (6 pacientes, 4,6%). Los pacientes con un patrón transmural tenían áreas de RTG con extensión limitada y 7/10 también presentaban patrones no isquémicos en otras localizaciones. Además, en todos estos pacientes se descartó la presencia de una enfermedad arterial coronaria significativa. La distribución de los patrones de RTG se muestra en la tabla 2 del material adicional.
Evento primario: modelos predictivos de riesgos competitivos de muerte súbita y muerte súbita abortadaTras una mediana de seguimiento de 4,9 años (P25-75: 3,1-7,1), 27 pacientes presentaron el evento primario (6,98% de la muestra total): 12 pacientes presentaron una MS y 15 presentaron una MS abortada (13 pacientes con una descarga adecuada del desfibrilador automático implantable, un paciente con una MS recuperada por ritmo desfibrilable y un paciente con una taquicardia ventricular hemodinámicamente inestable que requirió una cardioversión eléctrica externa). Un número significativo de eventos primarios 9/27 (33,3%) ocurrió en pacientes con FEVI ≥ 35-50%. Aunque no constituía un objetivo del estudio, también se evaluaron la mortalidad por cualquier causa (66/386, 17%) y la mortalidad cardiovascular (41/386, 10,6%).
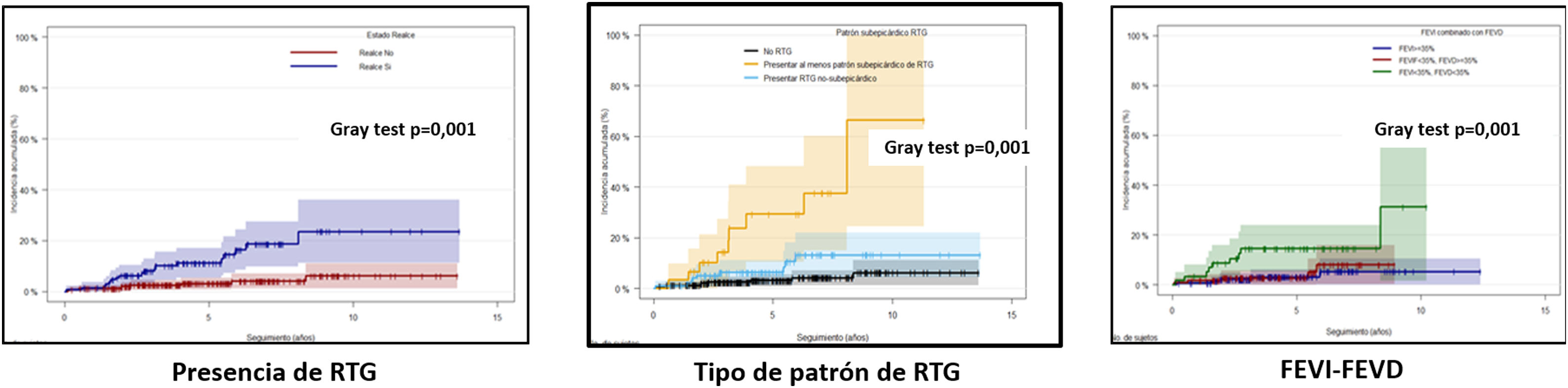
Las variables clínicas y de CRM asociadas al evento primario en el análisis univariante se muestran en la tabla 2. La presencia de RTG subepicárdico (aislado o asociado a otros patrones) se asoció a un mayor riesgo de evento primario que la presencia de RTG intramiocárdico (aislado o asociado a otros patrones), con valores de sub-hazard ratio (sHR) de 10,09 (IC95%, 4,07-25,03; p<0,01) y 4,16 (IC95%, 1,84-9,41; p=<0,01), respectivamente (referencia: pacientes sin RTG). La figura 2 muestra las incidencias acumuladas del evento primario según la presencia de RTG, el tipo de patrón de RTG y la función sistólica de ambos ventrículos (variable combinada FEVI-FEVD categorizada).
Análisis univariante de riesgos competitivos para el evento primario (muerte súbita/muerte súbita abortada)
| Sin evento primario (n=359) | Evento primario (n=27) | sHR (IC95%) | p | |
|---|---|---|---|---|
| Parámetros clínicos y sociodemográficos | ||||
| Varones | 246 (91,5) | 23 (8,6) | 2,61 (0,89-7,69) | 0,08 |
| Edad, años | 59±13 | 53±15 | 0,97 (0,94-0,99) | 0,03 |
| Edad ≤ 67 años | 245 (91,8) | 22 (8,2) | 2,03 (0,77-5,34) | 0,15 |
| Tiempo evolución MCD, años | 0 (0-0,5) | 0,2 (0-10,9) | 1,12 (1,07-1,18) | <0,01 |
| Tiempo evolución MCD> 1 año | 73 (85,9) | 12 (14,1) | 2,64 (1,00-6,98) | 0,05 |
| Historia familiar de MCD | 24 (82,8) | 5 (17,2) | 3,07 (1,18-8,05) | 0,02 |
| AP de síncope | 22 (73,3) | 8 (26,7) | 5,36 (2,37-12,10) | <0,01 |
| AP de taquicardia ventricular | 13 (76,5) | 4 (23,5) | 3,72 (1,30-10,7) | 0,02 |
| DAI | 7 (63,6) | 4 (36,4) | 6,46 (2,20-18,80) | <0,01 |
| TRC | 1 (33,3) | 2 (66,7) | 13,4 (2,99-59,9) | <0,01 |
| Amiodarona | 8 (66,7) | 4 (33,3) | 6,41 (2,19-18,80) | <0,01 |
| PAS, mmHg | 130 [120-142] | 120 [107-134] | 0,97 (0,95-0,99) | 0,01 |
| FC, lpm | 81 [70-99] | 71 [58-87] | 0,98 (0,95-1,00) | 0,07 |
| Creatinina, mg/dl | 0,9 [0,8-1,1] | 1,0 [0,9-1,2] | 1,81 (0,86-3,87) | 0,13 |
| QRS> 140 ms | 24 (85,7) | 4 (14,3) | 2,16 (0,65-7,15) | 0,21 |
| Parámetros morfofuncionales de CRM | ||||
| FEVI, % | 33 [25-42] | 27 [19-40] | 0,97 (0,93-1,02) | 0,20 |
| VTDVIi, ml/m2 | 120 [100-150] | 135 [115-174] | 1,01 (1,00-1,02) | <0,01 |
| VTSVIi, ml/m2 | 77 [60-113] | 96 [71-127] | 1,01 (1,00-1,02) | <0,01 |
| FEVD, % | 47 [37-58] | 36 [21-52] | 0,98 (0,94-1,01) | 0,20 |
| FEVD | ||||
| ≥35% | 245 (96,1) | 10 (3,9) | Ref. | |
| <35% | 53 (85,5) | 9 (14,5) | 3,52 (1,43-8,66) | <0,01 |
| VTDVDi, ml/m2 | 79 [66-103] | 96 [89-142] | 1,01 (1,01-1,02) | <0,01 |
| VTSVDi-ml/m2 | 41 [28-63] | 63 [35-77] | 1,01 (0,99-1,02) | 0,11 |
| FEVI combinado con FEVD | ||||
| FEVI ≥35% | 139 (96,5) | 5 (3,5) | Ref. | |
| FEVI <35%, FEVD ≥35% | 109 (95,6) | 5 (4,4) | 1,35 (0,39-4,65) | 0,63 |
| FEVI <35%, FEVD <35% | 49 (84,5) | 9 (15,5) | 4,55 (1,53-13,55) | <0,01 |
| Parámetros de RTG | ||||
| Presencia de RTG | 113 (86,3) | 18 (13,7) | 4,14 (1,86-9,22) | <0,01 |
| Patrón subepicárdico de RTG | ||||
| Ausencia de RTG | 246 (96,5) | 9 (3,5) | Ref, | |
| RTG subepicárdico | 21 (70,0) | 9 (30,0) | 10,09 (4,07-25,03) | <0,01 |
| Otros patrones de RTG | 92 (91,1) | 9 (8,9) | 2,62 (1,04-6,61) | <0,01 |
| Patrón intramiocárdico de RTG | ||||
| Ausencia de RTG | 246 (96,5) | 9 (3,5) | Ref. | |
| RTG intramiocárdico | 100 (86,2) | 16 (13,8) | 4,16 (1,84-9,41) | <0,01 |
| Otros patrones de RTG | 13 (86,7) | 2 (13,3) | 4,03 (0,95-17,17) | 0,06 |
| Número de patrones de RTG | ||||
| 0 | 246 (96,5) | 9 (3,5) | Ref. | |
| 1 | 92 (89,3) | 11 (10,7) | 3,17 (1,31-7,65) | 0,01 |
| Múltiples | 21 (75,0) | 7 (25,0) | 8,04 (3,01-21,50) | <0,01 |
| Número de localizaciones de RTG | ||||
| 0 | 246 (96,5) | 9 (3,5) | Ref. | |
| 1 | 73 (89,0) | 9 (11,0) | 3,32 (1,32-8,39) | 0,01 |
| Múltiples | 40 (81,6) | 9 (18,4) | 5,50 (2,20-13,75) | <0,01 |
AP: antecedente personal; CRM: cardiorresonancia magnética. DAI: desfibrilador automático implantable; FC: frecuencia cardiaca; FEVD: fracción de eyección de ventrículo derecho; FEVI: fracción de eyección de ventrículo izquierdo; IC95%: intervalo de confianza del 95%; MCD: miocardiopatía dilatada; NYHA: New York Heart Association; PAS: presión arterial sistólica; Ref.: referencia; RTG: realce tardío de gadolinio; sHR: sub-hazard ratio; TRC: terapia de resincronización cardiaca; VTDVIi: volumen telediastólico de ventrículo izquierdo indexado; VTSVIi: volumen telesistólico de ventrículo izquierdo indexado; VTDVDi: volumen telediastólico de ventrículo derecho indexado; VTSVDi: volumen telesistólico de ventrículo derecho indexado.
Los datos expresan n (%), media±desviación estándar o mediana [rango intercuartílico].
Incidencia acumulada de evento primario (muerte súbita/muerte súbita abortada) según presencia de RTG, tipo de patrón de RTG y fracción de eyección biventricular.
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; RTG: realce tardío de gadolinio.
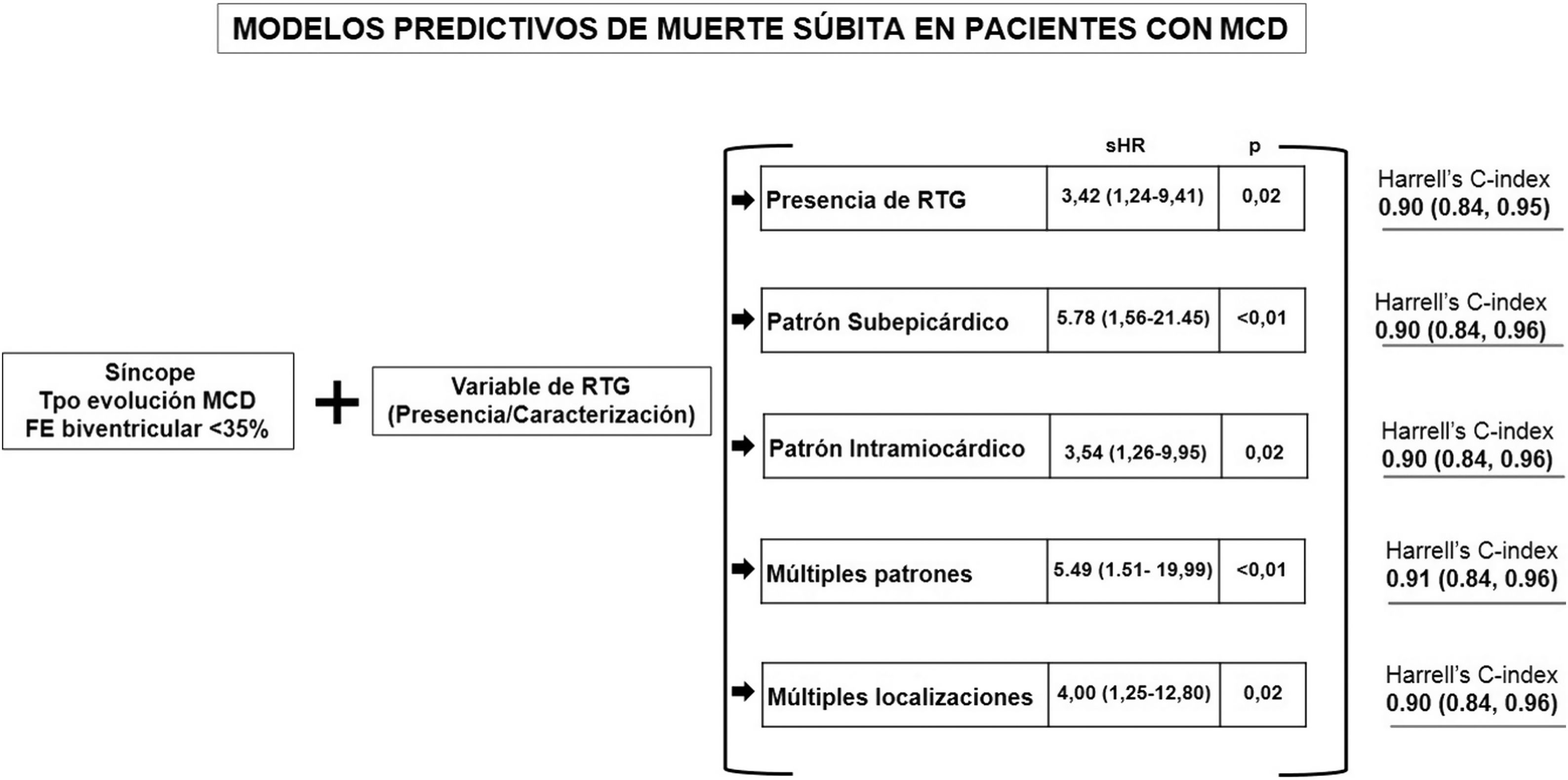
Los modelos multivariantes mostrados en la tabla 3 y figura 3 reflejan las variables clínicas y de CRM predictoras del evento primario, ajustadas por edad y sexo. Todos los modelos se componen de un máximo de 4 covariables: síncope, tiempo de evolución de la MD, una variable de RTG y la FEVI combinada con la FEVD. Para poder evaluar el RTG con base en su presencia, tipo de patrón, número de patrones y número de localizaciones, se generaron modelos diferentes, ya que estas covariables no pueden coexistir en el mismo modelo.
Análisis multivariante de riesgos competitivos para el evento primario (muerte súbita/muerte súbita abortada) con un tiempo mediano de seguimiento de 4,9 años [3,1-7,1]
| Modelo 1(Presencia de RTG) | Modelo 2(Tipo de patrón RTG)Ref: no RTG | Modelo 3(Tipo de patrón RTG)Ref: no RTG | Modelo 4(Número de patrones RTG)Ref: 0, no RTG | Modelo 5(Número de localizaciones de RTG)Ref: 0, no RTG | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| sHR (IC95%) | p | sHR (IC95%) | p | sHR (IC95%) | p | sHR (IC95%) | p | sHR (IC95%) | p | |
| Síncope | 10,66 (3,44-33,05) | <0,01 | 7,44 (1,90-29,18) | <0,01 | 10,95 (3,52-34,13) | <0,01 | 8,92 (2,63-30,31) | <0,01 | 9,88 (3,05-31,73) | <0,01 |
| Tiempo evolución MCD> 1 año | 4,02 (1,55-10,45) | <0,01 | 3,98 (1,42-11,16) | <0,01 | 3,95 (1,52-10,24) | <0,01 | * | * | 3,94 (1,44-10,76) | <0,01 |
| Variable de RTG | 3,42 (1,24-9,41) | 0,02 | RTG subepicárdico | RTG intramiocárdico | ≥2 patrones | ≥ 2 localizaciones | ||||
| 5,78 (1,56-21,45) | <0,01 | 3,54 (1,26-9,95) | 0,02 | 5,49 (1,51-19,99) | <0,01 | 4,00 (1,25-12,80) | 0,02 | |||
| FEVI <35% y FEVD <35% | 9,47 (3,02-29,70) | <0,01 | 10,18 (3,06-33,92) | <0,01 | 9,02 (2,76-29,46) | <0,01 | 9,10 (2,99-27,64) | <0,01 | 9,32 (2,99-29,07) | <0,01 |
| Índide C de Harrell | 0,90 (0,84-0,95) | 0,90 (0,84-0,96) | 0,90 (0,84-0,96) | 0,91 (0,84-0,96) | 0,90 (0,84-0,96) | 0,08 | ||||
| Test Gronnesby y Borgan | 0,690 | 0,678 | 0,535 | 0,662 | 0,652 | |||||
La variable tiempo de evolución MCD> 1 año no participa en el modelo 4.
FEVD: fracción de eyección de ventrículo derecho; FEVI: fracción de eyección de ventrículo izquierdo; IC95%: intervalo de confianza del 95%; MCD: miocardiopatía dilatada; Ref: referencia; RTG: realce tardío de gadolinio; sHR: sub-hazard ratio.
Para facilitar una lectura más comprensiva se ha simplificado la tabla del análisis multivariante. Se puede consultar la tabla 4 del material adicional.
En cada uno de los modelos, el antecedente de síncope y la presencia de FEVI <35% junto con FEVD <35% en la variable combinada FEVI-FEVD se asociaron significativamente con un mayor riesgo de presentar el evento primario. Además, el tiempo de evolución de la MCD> 1 año se asoció de forma independiente a mayor riesgo de MS en los modelos 1, 2, 3 y 5.
En todos los modelos desarrollados, el RTG en sus distintas versiones mostró su relevancia en el momento de asociarse con un mayor riesgo de experimentar el evento medido. Junto con la presencia de RTG (sHR=3,42; IC95%, 1,24-9,41; p=0,02, modelo 1), un patrón subepicárdico (sHR=5,78; IC95%, 1,56-21,45); p=0,009, modelo 2), un patrón intramiocárdico (sHR=3,54; IC95%, 1,26-9,95; p=0,02, modelo 3), la coexistencia de ≥ 2 patrones de RTG (sHR=5,49; IC95%, 1,51-19,99; p=0,001, modelo 4) y la presencia de RTG en ≥ 2 localizaciones (sHR=4,00; IC95%, 1,25-12,80; p=0,02, modelo 5) se asociaron con un mayor riesgo de presentar el evento primario (fig. 3).
Todos los modelos mostraron una buena precisión (índice C de Harrell 0,90-0,91) y una buena calibración, sin diferencias estadísticamente significativas entre ellos.
En el material adicional se incluye un análisis exploratorio de los eventos en pacientes con MS y eventos arrítmicos documentados (taquicardia ventricular sostenida/fibrilación ventricular) (tabla 3 del material adicional en el anexo).
DiscusiónEn este estudio multicéntrico, se evaluaron los predictores clínicos y por CRM de MS/MS abortada en una población de pacientes con MCD y FEVI <50% con una mediana de seguimiento de casi 5 años. A diferencia de otros estudios6,14, el nuestro incluyó pacientes con FEVI ≥ 35% (44% de la muestra). Este grupo de pacientes presentó una gran parte de los eventos (33%), tal y como se recoge en la literatura3.
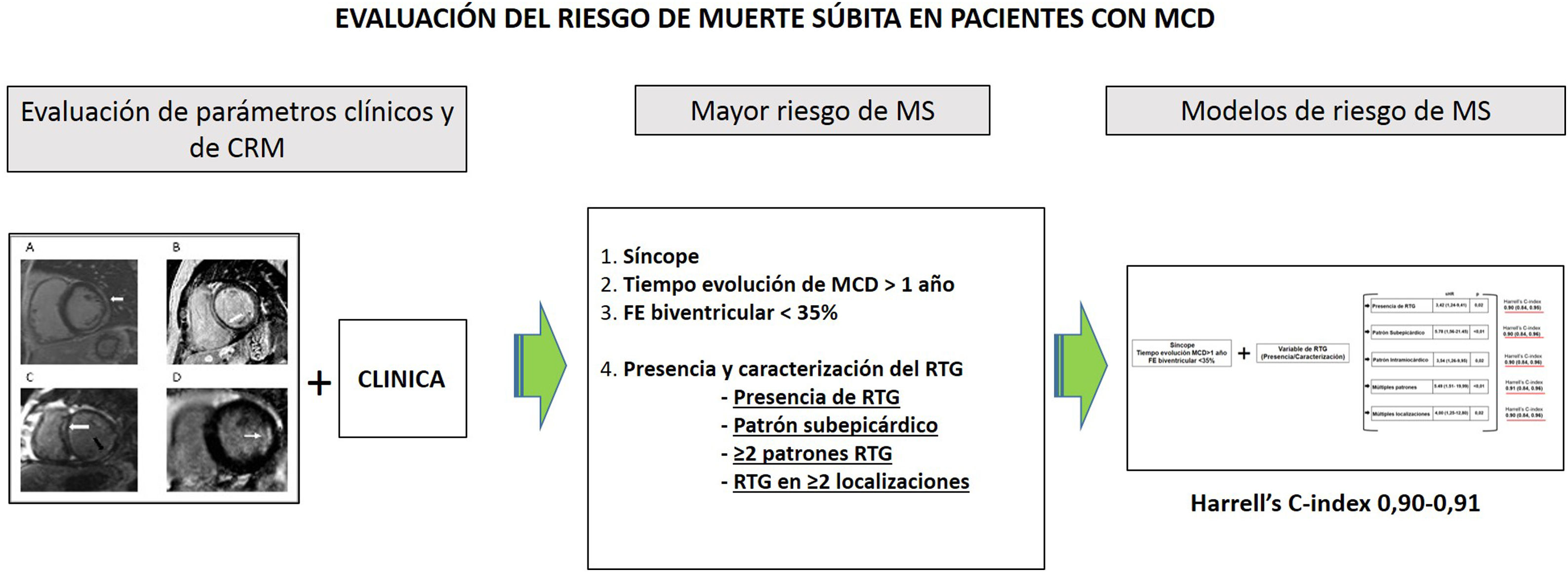
Se desarrollaron modelos multivariantes de riesgos competitivos de MS/ MS abortada que incluyeron un máximo de 4 covariables: síncope, tiempo de evolución de la MCD> 1 año, la variable combinada de FEVI-FEVD categorizada y una variable de RTG. Los modelos difirieron en función del aspecto que se evaluaba del RTG (presencia y caracterización). Los resultados de estos modelos ajustados por edad y sexo podrían tener importantes implicaciones en la práctica diaria, ya que permitieron identificar a los pacientes con mayor riesgo de MS/MS abortada con buena precisión en el presente estudio (fig. 4).
El síncope es un conocido factor de riesgo de MS en pacientes con MCD, al igual que en otras miocardiopatías. El tiempo de evolución desde el diagnóstico de la MCD> 1 año puede estar relacionado con la presencia de una miocardiopatía más avanzada, con mayor remodelado y desarrollo de sustrato arrítmico.
Realce tardío de gadolinio y riesgo de muerte súbitaEstudios anteriores, en su mayoría unicéntricos, señalaron que la presencia de RTG tiene un valor pronóstico independiente para la aparición de MS. Estos resultados se confirmaron en metaanálisis recientes7. Nuestro estudio confirma la evidencia actual, con un amplio periodo de seguimiento en una cohorte nacional.
La influencia de la extensión del RTG en el riesgo de MS sigue siendo controvertida5,6. Por otro lado, se ha estudiado poco la caracterización cualitativa del RTG y su asociación con el riesgo de MS en pacientes con MCD. En el presente estudio, se caracterizó el RTG según el tipo de patrón mural, el número de patrones coexistentes y su localización. Nuestros resultados indicaron que los diferentes patrones de RTG se asocian con diferentes riesgos de MS/MS abortada. En concreto, el patrón subepicárdico se asoció a un mayor riesgo del evento primario en los modelos multivariantes. Hasta donde sabemos, esta asociación ha sido poco comunicada en la literatura, con 2 estudios unicéntricos5,9 y uno realizado en 2 centros8. Una posible explicación es que algunos casos de MCD con RTG subepicárdico podrían corresponder a una miocardiopatía arritmogénica con afectación predominante del ventrículo izquierdo. Estos 2 fenotipos a menudo se solapan y no es fácil diferenciarlos15. Pensamos que el RTG subepicárdico podría ayudar a identificar a los pacientes con un fenotipo más arrítmico de MCD.
Por otro lado, se observó que la coexistencia de 2 o más patrones de RTG diferentes se asociaba a un mayor riesgo de MS/MS abortada. No se analizó cuantitativamente el RTG, sin embargo, se demostró que existía un gradiente en el que el riesgo de MS aumentaba con el número de localizaciones del RTG.
Disfunción biventricular con fracción de eyección <35% y riesgo de muerte súbita/muerte súbita abortadaEn nuestro estudio se observó que la FEVI aislada no fue un predictor independiente del evento primario, al igual que se ha comunicado en otros estudios4. Tampoco lo fue al categorizar la FEVI en mayor o menor al 35%. Estos resultados no hacen sino confirmar que la FEVI aislada no es una buena herramienta para identificar a los pacientes con MCD con mayor riesgo de MS.
De manera interesante, nuestro análisis también reveló que, en los pacientes con una FEVI <35%, la coexistencia de una FEVD <35% se asoció a un mayor riesgo del evento primario. Esta asociación no ha sido bien establecida hasta la fecha. Nuestros resultados van en la línea de los de Elming et al.16: podría reflejar un estadio más avanzado de la MCD o podría deberse a una afectación biventricular de una miocardiopatía arritmogénica. Nuestros resultados indican que la evaluación de la FEVD mediante CRM puede contribuir significativamente a la estratificación del riesgo de MS en pacientes con MD.
Propiedades de los modelos de riesgo competitivo: variables predictoras, capacidad de discriminación y calibración con respecto a los modelos existentesTodos nuestros modelos con variables clínicas y de CRM mostraron una excelente capacidad discriminatoria con el índice C- de 0,90-0,91 y una buena calibración. Li et al.14 publicaron un modelo multivariante basado en variables clínicas y de imagen que incluía una extensión de RTG> 14%, con un índice C de 0,80 (IC95%, 0,71-0,87). Nuestros modelos comparten la variable «síncope», pero se centran en un análisis cualitativo del RTG y asocian la disfunción biventricular con una fracción de eyección biventricular <35%. La cuantificación de la extensión del RTG aún no está estandarizada y muchos laboratorios de CRM no disponen de programas específicos para ello. Nuestros modelos son aplicables en la práctica diaria de todos los centros con CRM, ya que incluyen parámetros convencionales. Sin embargo, a pesar de los buenos resultados en nuestra población, los modelos se deben confirmar mediante validación externa.
Limitaciones del estudioNuestro estudio presenta varias limitaciones, como las inherentes a su diseño retrospectivo. La inclusión de los pacientes por el centro coordinador se realizó de manera consecutiva a partir de los registros de CRM del mismo centro, seleccionando aquellos que cumplían los criterios de inclusión. Los otros centros participantes incluyeron a pacientes que se ajustaron a los criterios de inclusión y exclusión, sin embargo, no se puede excluir un riesgo de sesgo de selección en este punto. El relativo bajo tamaño muestral se explica en parte por la escasa disponibilidad de estudios de CRM completos previos a 2014.
La revisión de los estudios de CRM no fue centralizada, sin embargo, las diferencias entre centros reflejan mejor la práctica clínica de la vida real. Debido al periodo de inclusión (2005-2018), solo a una pequeña proporción de los pacientes se les hizo pruebas genéticas, y, por el mismo motivo, pocos pacientes recibieron tratamiento con sacubitrilo/valsartán y ninguno con inhibidores del cotransportador sodio-glucosa 2 (ISGLT2). Por último, la exactitud de los modelos multivariantes no se comprobó en una cohorte externa. Son necesarios más estudios para confirmar estos resultados.
ConclusionesMás allá de la presencia del RTG, nuestro estudio basado en predictores clínicos y de CRM identificó varios perfiles de pacientes con MCD y mayor riesgo de MS. En concreto, los pacientes con un patrón de RTG subepicárdico, con múltiples patrones de RTG, con RTG en múltiples localizaciones y con disfunción biventricular con FEVI <35% y FEVD <35% presentan un riesgo aumentado de MS/MS abortada.
Nuestros modelos de predicción de MS basados en parámetros clínicos (síncope y tiempo de evolución de MCD> 1 año) y de CRM mostraron una excelente precisión y calibración en nuestra población. La CRM proporciona una valiosa información morfológica y funcional, además de la FEVI y de la presencia de RTG, que permite una mejor estratificación del riesgo de MS en los pacientes con MCD. Son necesarios otros estudios para confirmar estos resultados.
FinanciaciónEste artículo recibió la financiación de la Beca con número de expediente 20190105 concedida por la Comisión de Investigación de la Organización Sanitaria Integrada OSI Barrualde-Galdakao, España.
Contribución de los autoresI. Rodríguez-Sánchez: concepción o diseño del trabajo, recogida de datos, análisis e interpretación de los datos, redacción del artículo, revisión crítica del artículo, aprobación final de la versión para publicar. U. Aguirre Larracoechea: análisis e interpretación de los datos, redacción del artículo, revisión crítica del artículo, aprobación final de la versión para publicar. V. Gómez-Sánchez: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. S. Velasco del Castillo: recogida de datos, análisis e interpretación de los datos, revisión crítica del artículo, aprobación final de la versión para publicar. A. Ullate de la Torre: recogida de datos, redacción del artículo, revisión crítica del artículo, aprobación final de la versión a publicar. A. Urkullu Naveda, recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. J.J. Onaindia Gandarias: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. M. Pérez de Nanclares Ingelmo: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. N. García Ibarrondo: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. R. Natividad Andrés: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. C. Gómez Ramírez: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. C. Goena Vives: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar. A. Capelastegui Alber: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar, E. Astigarraga Aguirre: recogida de datos, revisión crítica del artículo, aprobación final de la versión para publicar, E. Zamarreño Golvano: análisis e interpretación de los datos, revisión crítica del artículo, aprobación final de la versión para publicar. J.M. Ormaetxe Merodio: análisis e interpretación de los datos, revisión crítica del artículo, aprobación final de la versión para publicar. A. Salcedo Arruti: análisis e interpretación de los datos, revisión crítica del artículo, aprobación final de la versión para publicar.
Conflicto de interesesNingún autor refiere ningún conflicto de intereses.
Es necesario mejorar la estratificación del riesgo de MS en pacientes con MCD, como se ha demostrado en el estudio DANISH.
La presencia de RTG se ha asociado a MS en pacientes con MCD.
La asociación de la disfunción de ventrículo derecho y de la caracterización del RTG con el riesgo de MS en pacientes con MCD han sido poco estudiadas.
¿Qué novedades aporta?La caracterización del RTG permite una mejor estratificación del riesgo de MS, aparte de su presencia/ausencia. El patrón subepicárdico, la coexistencia de ≥ 2 patrones y el RTG en ≥ 2 localizaciones se asocian a mayor riesgo de MS en la MCD.
Los pacientes con disfunción biventricular, con FEVI y FEVD <35%, presentan mayor riesgo de MS, independientemente de la presencia de RTG.
Modelos multivariados que incluyen variables clínicas (síncope, tiempo de evolución de MD) una variable de presencia/caracterización de RTG y la variable combinada FEVI-FEVD, presentaron una excelente capacidad discriminativa de MS en nuestra población de pacientes con MCD y FEVI <50%.
Los autores de este manuscrito agradecen a la Comisión de Investigación de la OSI Barrualde-Galdakao, Osakidetza, su ayuda en la financiación de este trabajo.