La enfermedad de Erdheim-Chester (ECD) es una forma rara de histiocitosis de células no Langerhans que se caracteriza por la infiltración de los tejidos por histiocitos espumosos CD68+/CD1a−. Se trata de una enfermedad multisistémica que característicamente afecta a los huesos largos, al sistema nervioso central, al sistema cardiovascular, a la piel y al sistema excretor renal con afectación retroperitoneal1. El curso clínico de la enfermedad varía dependiendo de la extensión y de la distribución de la enfermedad, identificándose formas localizadas asintomáticas y otras multisistémicas potencialmente mortales1.
Dado que es una enfermedad minoritaria, no disponemos de tratamientos bien evaluados en ensayos clínicos1,2. Se recomienda el uso de interferón alfa para los pacientes con ECD que no presentan manifestaciones que ponen en riesgo su vida. Cuando estos pacientes presentan falta de respuesta o mala tolerancia al mismo se administra corticoides, anakinra, cladribina, infliximab, imatinib y sirolimus con resultados poco esperanzadores3. El 57-75% de todos los pacientes con ECD son portadores de mutaciones en el gen de la serina/treonina-proteína quinasa B-Raf, que se expresa con la sustitución de una valina por la molécula ácido glutámico en el residuo 600 (BRAF V600E, de sus siglas en inglés). Desde 2013 se está usando vemurafenib, un fármaco inhibidor del BRAF, que ha demostrado su beneficio en aquellos pacientes portadores de mutación BRAF y ECD con afectación multisistémica refractaria al tratamiento convencional o de entrada en los casos más graves, permitiendo así un tratamiento dirigido de la enfermedad4.
Presentamos el caso de un paciente afectado de ECD tratado con vemurafenib que desarrolló una miocardiopatía dilatada durante el seguimiento de la enfermedad. Se trata de un varón de 77 años diagnosticado de ECD con mutación BRAF V600E positiva con afectación ósea y retroperitoneal asociado a leucemia mielomonocítica crónica (mutación SRSF2: factor de empalme, arginina/serina-rica 2) y a síndrome hemofagocítico secundario. Como otros antecedentes, consta extabaquismo (dosis acumulada de 46 paquetes/año), enolismo de 2 unidades de bebida estimadas/día, hipertensión arterial y dislipidemia con buen control, enfermedad pulmonar obstructiva crónica (EPOC), aneurisma de aorta abdominal infrarrenal e intervenido mediante injerto aorto-aórtico en noviembre de 2014.
Se realizó esplenectomía en noviembre de 2017 por trombocitopenia persistente atribuida inicialmente a trombocitopenia inmune,y recibió prednisona a dosis altas junto con ciclosporina para el tratamiento del síndrome hemofagocítico con escasa mejoría clínica. En enero de 2018 se inició vemurafenib, a pesar de no haber recibido previamente interferón alfa, dada la gravedad de las manifestaciones clínicas del paciente con una rápida respuesta clínico-radiológica. Durante el seguimiento, los electrocardiogramas de control no mostraban alteración del intervalo QT ni otros trastornos del ritmo y un ecocardiograma realizado en agosto de 2018 mostraba una función ventricular izquierda conservada.
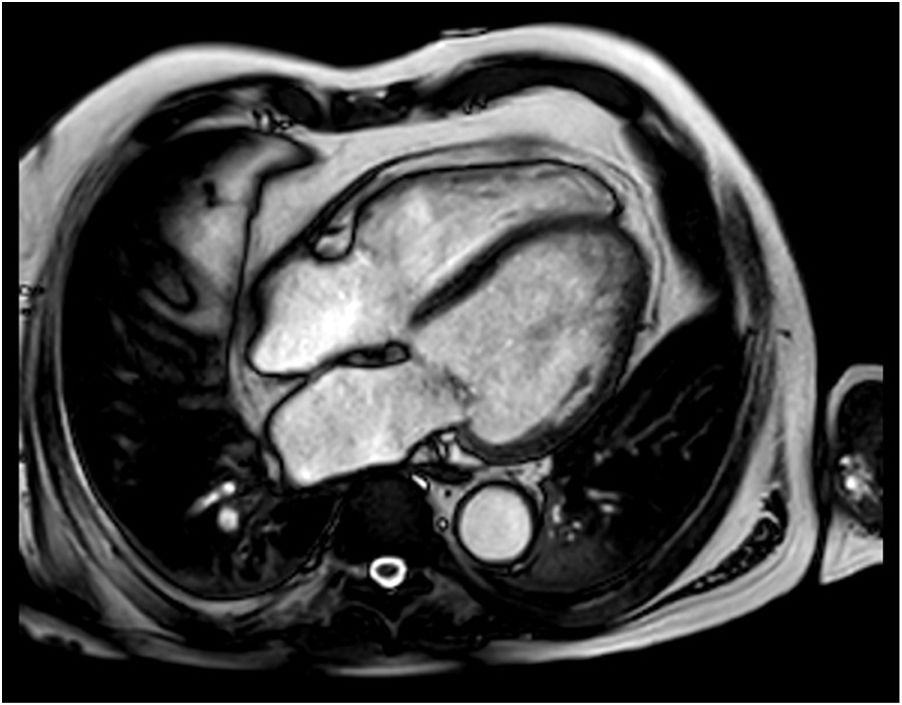
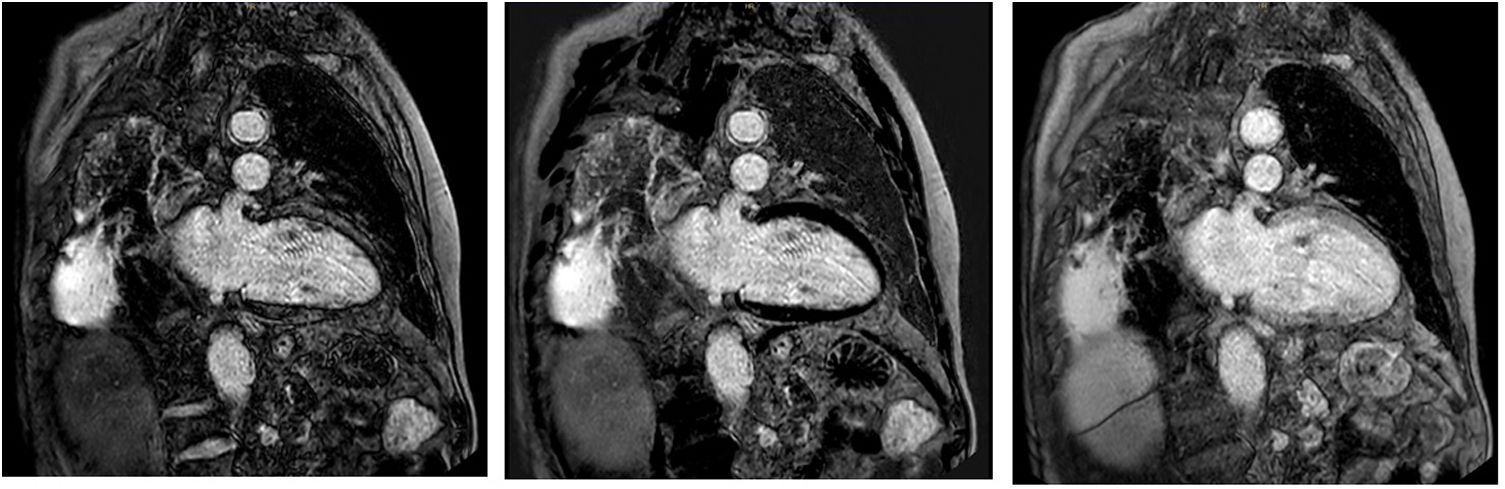
El paciente ingresa en febrero de 2019 por clínica compatible con insuficiencia cardiaca (IC) aguda, sin claro desencadenante. En la analítica destacaba leucocitosis de 10,7×109/l a expensas de monocitosis, trombocitopenia de 134×109/l, anemia de 116g/l y fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) 19.373ng/l. El electrocardiograma reveló un ritmo sinusal sin alteraciones de la repolarización. El ecocardiograma mostró un ventrículo izquierdo (VI) gravemente dilatado, no hipertrófico, con fracción de eyección (FE) del 30%, sin derrame pericárdico. La tomografía por emisión monofotónica miocárdica y la tomografía por emisión de positrones-tomografía computarizada confirmaron la presencia de miocardiopatía dilatada de etiología no isquémica, sin signos sugestivos de progresión de la enfermedad de base o de enfermedad infiltrativa. La resonancia magnética (RM) cardiaca mostró un VI dilatado con hipoquinesia global, FE gravemente deprimida (31%), discreta regurgitación mitral sin hipertrofia significativa y ventrículo derecho en rango alto de la normalidad, así como discreta hipoquinesia global con FE del ventrículo derecho del 47%. En secuencia de contraste tardía no se identifican claros focos de fibrosis miocárdica. La captación del pericardio anterior sugiere cierto grado de inflamación. En la figura 1 se muestra imagen de cine con proyección en eje corto de la mencionada RM cardiaca y en la figura 2 imágenes de secuencia funcional con proyección en eje largo.
Se realizó tratamiento con oxigenoterapia, broncodilatadores y fármacos con efecto deplectivo y vasodilatador. Ante la sospecha de cardiotoxicidad atribuida al inhibidor del BRAF, en febrero de 2019 se retiró el vemurafenib. No se sustituyó por un inhibidor de la proteína cinasa activada por mitógeno que, a su vez, fosforila la proteína cinasa reguladora de la señal extracelular (MEK-ERK, por sus siglas en inglés) como cobimetinib dado que la ECD, tras varios meses de vemurafenib, tenía una actividad leve y los efectos adversos de cobimetinib podrían ser similares al vemurafenib. Se introdujo anakinra como tratamiento de segunda línea para la ECD. El paciente presentó mejoría clínica progresiva de la IC y estabilidad de la ECD. Al alta se prescribió tratamiento con furosemida 60mg/día, enalapril 1,25mg/día, nebivolol 1,25mg/día, anakinra 100mg/día, prednisona 2,5mg/día, alendronato 70mg/mes, calcio carbonato/colecalciferol D diario, además de tratamiento con omeprazol, mirtazapina y tratamiento broncodilatador de su EPOC. Del mismo modo, se indicó seguimiento mediante visitas ambulatorias y ecocardiograma de control a los 3 meses de la retirada del fármaco para evaluar la función ventricular izquierda. El paciente reingresó a los 2 meses por shock séptico de origen urinario y falleció por dicho motivo, no pudiéndose realizar el control ecocardiográfico solicitado. Se efectuó notificación al Sistema Español de Farmacovigilancia.
El vemurafenib es un inhibidor de la serina/treonina cinasa codificada por el gen BRAF, autorizado en el tratamiento del melanoma no resecable o metastásico con mutación BRAF V6004. Se administra por vía oral. Los efectos adversos más frecuentes son las manifestaciones cutáneas. Se han descrito tumores cutáneos hasta el 30% de los casos y con menos frecuencia el desarrollo de un nuevo melanoma. Otros efectos adversos incluyen hepatotoxicidad, artralgia, diarrea y excepcionalmente pancreatitis. La información disponible sobre cardiotoxicidad por vemurafenib se ha relacionado básicamente con alteraciones del ritmo en forma de prolongación del intervalo QT. Raftopoulos et al.2 publicaron un caso de IC asociado al uso de vemurafenib en un paciente de 64 años con diagnóstico de melanoma metastásico. En relación con los inhibidores de la proteína cinasa (dabrafenib, sorafenib, vemurafenib y regorafenib), en los ensayos clínicos para el desarrollo de estos fármacos se han visto algunos casos de hipertensión arterial, isquemia miocárdica, acontecimientos tromboembólicos e IC5.
Sobre el mecanismo de acción, es conocido que BRAF juega un papel importante en la regulación de la hipertrofia de cardiomiocitos6. Este efecto se ha podido comprobar en estudios en animales, en los que los inhibidores de la proteína cinasa han provocado dilatación miocárdica a través de la vía de señalización MEK-ERK1/2. Además, a través de esta vía podrían jugar un papel importante en la regulación del sistema renina-angiotensina2.
En resumen, después de descartar otras causas alternativas, consideramos que la IC que presentaba el paciente podía estar relacionada con la administración de vemurafenib. El Hospital Universitari de Bellvitge dispone de un Programa de Farmacovigilancia (PFV) que tiene como objetivo identificar las sospechas de reacciones adversas y notificarlas al Sistema Español de Farmacovigilancia. El tratamiento de la información sigue los mismos estándares de calidad en cuanto a protección de la confidencialidad que los registros clínicos del hospital. Ni el nombre del paciente ni el de los notificadores aparece en ningún informe, publicación o comunicación de los resultados del programa. El PFV cuenta con la aprobación del Comité de Ética de la Investigación con medicamentos (CEIm)”.
FinanciaciónEste trabajo no presentó ningún tipo de financiamiento institucional. La participación de los investigadores ha sido voluntaria y desinteresada.
Conflicto de interesesLos investigadores de este trabajo declaramos no tener conflictos de intereses financieros ni personales.