La amiloidosis cardiaca (AC) es una enfermedad infiltrativa que ha cobrado especial relevancia en los últimos años. El objetivo del estudio fue definir el perfil del paciente diagnosticado de AC.
MétodosEstudio retrospectivo realizado entre enero de 2013 y febrero de 2020 que recoge las características clínicas, electrocardiográficas y de pruebas de imagen de los pacientes con diagnóstico de AC.
ResultadosSe incluyeron 44 pacientes con diagnóstico confirmado de AC (17 con AC primaria y 27 con AC por transtirretina), con una edad media de 73±12 años, el 71% fueron varones. El síntoma principal de inicio fue la insuficiencia cardiaca (IC): 59%. El septo interventricular medio fue de 16±3mm y la fracción de eyección del ventrículo izquierdo se encontraba preservada en el 50% de los pacientes (22 pacientes). La rentabilidad de la biopsia endomiocárdica fue del 100% (n=14). La gammagrafía con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico resultó positiva en el 41% de los pacientes con AC primaria y en el 96% con AC por transtirretina. A los 83,8±14,1 meses de seguimiento, 19 pacientes fallecieron (15,6 por 100 pacientes/año) y 21 tuvieron al menos un reingreso por IC (24,6 por 100 pacientes/año). El subtipo de AC primaria y el inicio por insuficiencia cardiaca se asociaron a una mayor mortalidad y mayor tasa de reingresos hospitalarios. El grosor del septo interventricular también tuvo asociación con la mortalidad.
ConclusionesEn nuestro estudio, la AC es más prevalente en los varones en la séptima década de la vida, siendo la forma de presentación más habitual como IC, con alta prevalencia de fracción de eyección del ventrículo izquierdo reducida en el momento del diagnóstico. El pronóstico de esta enfermedad es infausto, con una mayor mortalidad en aquellos pacientes con AC primaria.
Cardiac amyloidosis (CA) is an infiltrative disease that has become especially relevant in recent years. The objective of the present study was to define the profile of the patient diagnosed with CA in a tertiary hospital.
MethodsRetrospective study carried out between January-2013 and February-2020 including the clinical and electrocardiographical characteristics and imaging test of patients with diagnosis of CA.
ResultsA total of 44 patients with a confirmed diagnosis of CA (17 primary CA and 27 transthyretin CA) were included, with an overall mean age of 73±12 years, 71% male. The main debut symptom was decompensated heart failure (HF) (59%). The average of interventricular septum were 16±3mm, and left ventricular ejection fraction data preserved in 50% of the series (22 patients). The endomyocardial biopsy was positive in 100% of the cases (n=14). The 99mTc-3,3-diphosphono-1,2 propanodicarboxylic acid scan was positive in 41% of all primary CA and 96% of transthyretin CA. Regarding follow-up, 19 patients died (15.6 per 100 patients-year), and 21 patients had at least one admission for heart failure (24.6 per 100 patients-year) at 83.8±14.1 months of follow-up. The primary CA subtype and the debut due to HF were associated with mortality and a higher rate of hospital readmissions. Interventricular septum thickness was also associated with mortality.
ConclusionsIn our environment, CA predominantly affects men in the seventh age of life, with symptoms of HF, with up to half of patients with reduced ejection fraction at the time of diagnosis. The prognosis of this pathology is poor, with higher mortality in those patients with primary CA.
La amiloidosis es una enfermedad en la que un material proteico llamado amiloide se deposita en diferentes tejidos del organismo. La presentación clínica de la amiloidosis puede llegar a ser muy inespecífica, pudiendo suponer esta eventualidad un retraso importante en el diagnóstico, con múltiples manifestaciones extracardiacas1–3. La afección cardiaca es el factor predictor de peor pronóstico, y la forma de presentación más frecuente es la insuficiencia cardiaca, aunque otras como las arritmias y los trastornos de conducción pueden preceder en años al diagnóstico de la enfermedad.
Existen 5 formas de amiloidosis sistémica con capacidad de depósito cardiaco4,5. Las 2 formas más frecuentes de amiloidosis cardiaca (AC) en nuestro medio son la amiloidosis cardiaca por depósito de cadenas ligeras (AC-AL) y la amiloidosis cardiaca por depósito de transtirretina (AC-TTR); esta última tiene 2 variantes, la hereditaria y la variante mutante o senil.
El actual desarrollo de nuevas técnicas de imagen y de algoritmos diagnósticos que permiten, en casos seleccionados, el diagnóstico no invasivo sin necesidad de tener que hacer biopsia6, así como la aparición de tratamientos potencialmente curativos, ha puesto el foco de atención sobre esta enfermedad.
En este estudio se presenta una serie de casos de pacientes diagnosticados de AC (AL y TTR) en nuestro centro, con el objetivo de describir las características diagnósticas diferenciales entre ambos tipos de enfermedades, así como establecer el desigual pronóstico que tienen ambas, en términos de mortalidad y de reingresos por insuficiencia cardiaca.
MétodosTipo de estudio. Población de estudioSe llevó a cabo un estudio retrospectivo, observacional analítico, de pacientes con diagnóstico de AC entre enero de 2013 y febrero de 2020, que fueron seleccionados tras un ingreso hospitalario o bien tras su atención en consulta ambulatoria de cardiología. El estudio fue aprobado por el comité de ética de la investigación provincial de Córdoba con referencia de comité: 4941 con dictamen favorable el 27/1/2021.
Procedimiento diagnósticoLos pacientes diagnosticados de AC fueron clasificados en AC-AL o AC-TTR. El diagnóstico de AC-AL se realizó con biopsia de órgano afecto, mediante la demostración de depósitos amiloides caracterizados como tipo AL por inmunohistoquímica, microscopía óptica/inmunoelectrónica o proteómica. La afección cardiaca en AL se estableció de acuerdo con las pautas actuales7. El diagnóstico de AC-TTR se hizo en pacientes con hipertrofia ventricular (grosor del septo interventricular superior a 12mm en ecocardiografía), sin causa alternativa para explicar la hipertrofia, bien mediante la realización de una biopsia endomiocárdica, o bien en aquellos pacientes que presentaron captación cardiaca en la gammagrafía ósea con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) grado 2 o 3 de Perugini, y que no tenían evidencia de pico monoclonal en la inmunofijación en suero u orina, ni en el proteinograma. A todos estos pacientes se les realizó un estudio genético para descartar la variante mutante de la AC-TTR.
Independientemente del tipo de AC, el despistaje de discrasia sanguínea se llevó a cabo mediante análisis de inmunofluorescencia de cadenas ligeras en orina y suero, así como análisis del proteinograma. En función de los resultados de estos datos analíticos, se realizó biopsia de médula ósea para determinar la presencia de mieloma múltiple o gammapatía monoclonal de significado.
Se consideró como síntoma de inicio aquel que propició el primer contacto clínico con el servicio de cardiología; en el caso de pacientes derivados de manera asintomática para estudio de cardiopatía, cuando se demostrara la presencia de signos de afectación cardiaca en estudios de imagen. En todos los pacientes se recogieron las características clínicas basales en el momento del inicio de la enfermedad, así como datos de supervivencia y mortalidad en el seguimiento; también fueron analizados los datos de los procedimientos diagnósticos realizados, como el electrocardiograma de superficie, el ecocardiograma transtorácico, la cardiorresonancia y la gammagrafía ósea con 99mTc-DPD.
Electrocardiograma de superficieSe analizó el ritmo del paciente en el momento del diagnóstico. Se definió que existía bajo voltaje cuando los complejos QRS tenían una amplitud ≤0,5mV en todas las derivaciones frontales o ≤1mV en todas las derivaciones precordiales; se consideró que existían signos eléctricos de hipertrofia ventricular izquierda cuando se cumpliese el criterio de Cornell8 (RaVL+SV3 >28mm en varones, >20mm en mujeres). En cuanto a la morfología del complejo QRS se determinó que existían trastornos de la conducción intraventricular como bloqueos de rama o hemibloqueos de rama izquierda según los criterios diagnósticos para la estandarización e interpretación del electrocardiograma de superficie de la American Heart Association9. Se consideró la presencia de patrón de seudoinfarto cuando existía presencia de ondas Q patológicas (1/4 de la amplitud de la R) u ondas QS en 2 derivaciones consecutivas, en ausencia de cardiopatía isquémica previa o bloqueo de rama izquierda10.
Ecocardiograma transtorácicoSe analizaron los datos pertenecientes al primer ecocardiograma realizado tras el síntoma de inicio. Se recogieron como variables de interés los «diámetros» telediastólicos y telesistólicos del ventrículo izquierdo, la fracción de eyección del ventrículo izquierdo (FEVI) por el método de Teicholz, el volumen de la aurícula izquierda, los datos del grosor del septo interventricular, la función sistólica del ventrículo derecho medido mediante el desplazamiento sistólico del plano del anillo tricuspídeo, la presión sistólica de la arteria pulmonar y la presencia o no de derrame pericárdico.
Resonancia magnética cardiacaSe realizó un estudio morfológico y funcional con secuencias cine (precesión libre en estado estacionario SSFP) en los planos cardiacos habituales (2 cámaras; 4 cámaras, eje corto, etc.) donde se analizaron los volúmenes telediastólicos y telesistólicos del ventrículo izquierdo, la FEVI, los volúmenes telediastólicos y telesistólicos del ventrículo derecho la función sistólica del ventrículo derecho, el grosor del septo interventricular y la presencia de realce miocárdico tardío mediante secuencia de inversión-recuperación con supresión de la señal miocárdica, tras la administración intravenosa de gadolinio.
Gammagrafía ósea realizada con el radiotrazador 99mTc-DPDSe obtuvo el estudio gammagráfico a los 180min de la inyección intravenosa de 99mTc-DPD (370-740Mbq), realizándose estudio de rastreo corporal total e imágenes planares estáticas sobre región torácica en proyecciones anterior y oblicua anterior izquierda. En aquellos pacientes en los que se apreció depósito miocárdico del trazador en estudio planar, se adquirió estudio tomográfico híbrido de tórax SPECT-CT (CT de baja dosis, sin contraste), con el fin de caracterizar la distribución del depósito y evitar falsos positivos en casos dudosos. Se valoró de manera semicuantitativa la captación miocárdica de radiotrazador mediante la escala visual de Perugini10 (grados 0-3, según la intensidad del depósito en el miocardio con respecto a la médula ósea de costilla adyacente).
Estudio estadísticoTodos los datos cuantitativos se presentan como media±desviación estándar. Las variables cualitativas se expresan en frecuencias absolutas y porcentaje.
Se estudió la normalidad de todas las variables mediante el test de Shapiro-Wilk. La comparación entre grupos de variables cuantitativas independientes se realizó mediante la prueba de t de Student como test paramétrico o la prueba U de Mann-Whitney como test no paramétrico. Para la comparación de variables cualitativas, se utilizó la prueba de χ2 o el test exacto de Fisher cuando fue necesario. El estudio de supervivencia y de la probabilidad libre de eventos se realizó mediante el método de Kaplan-Meier y la prueba logrank test. Para la realización del análisis univariante se empleó la regresión de Cox. Se aceptaron como valores estadísticamente significativos cuando el valor de p<0,05. Los datos fueron recogidos, procesados y analizados mediante el programa IBM SPSS v.25.
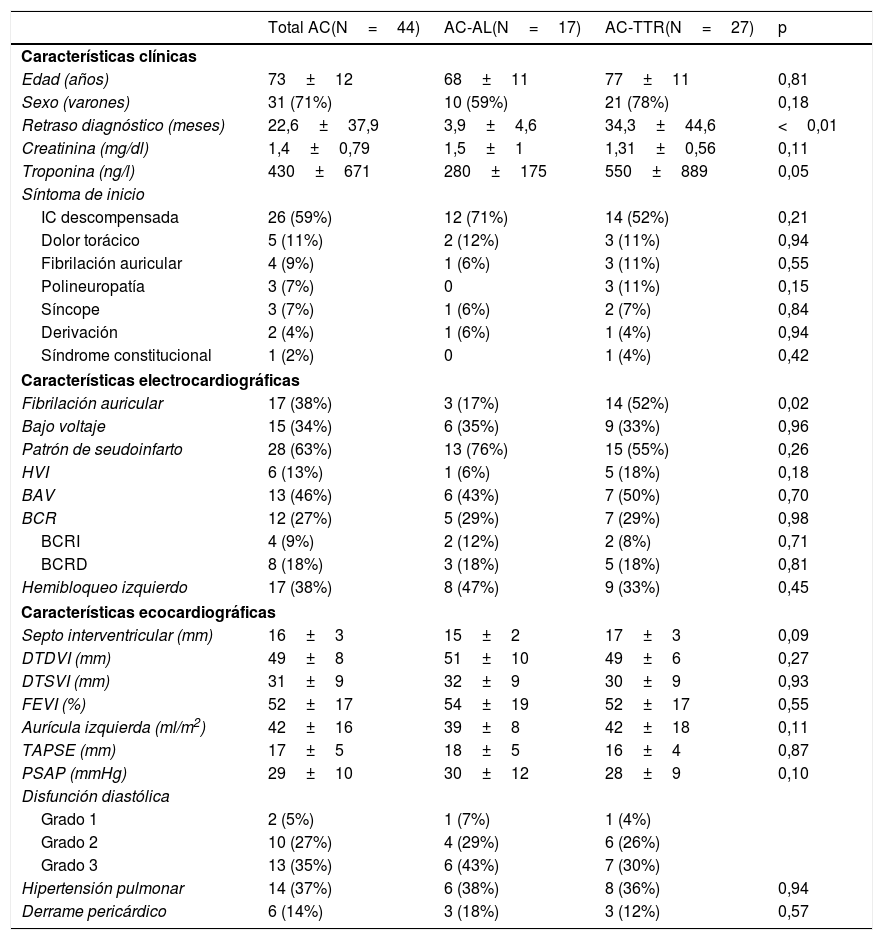
ResultadosSe incluyó a 44 pacientes, de los cuales 17 presentaban AC-AL (38,6%) y 27 fueron clasificados como AC-TTR (61,4%). Esta clasificación se realizó en función de los resultados de la anatomía patológica en 27 de los pacientes, mientras que en los 17 restantes el diagnóstico de AC-TTR se estableció sin necesidad de estudio invasivo6. El 71% (n=31) eran varones, con una edad media en el momento del diagnóstico de 73±12 años, sin que existieran diferencias estadísticamente significativas entre ambos grupos. Las características clínicas basales y el síntoma de inicio que llevó al paciente a estudio por parte de cardiología, destacando en primer lugar la presentación como insuficiencia cardiaca descompensada de novo hasta en 26 pacientes (59%).
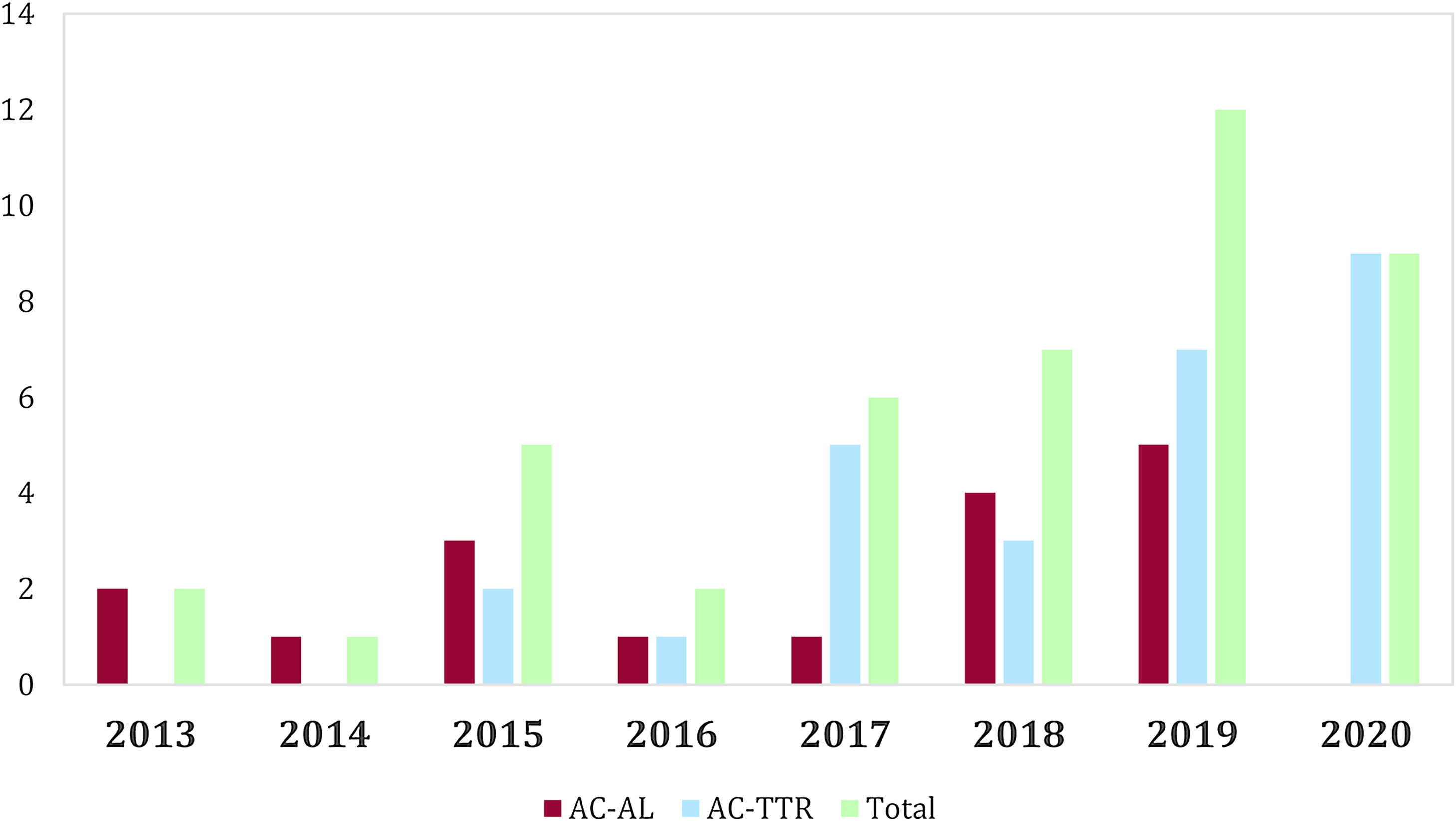
El número de pacientes diagnosticados por año natural se encuentra reflejado en la figura 1, donde se puede observar un incremento del número de casos diagnosticados especialmente a partir del año 2015. Analizado el tiempo desde el inicio de los síntomas, destaca un retraso temporal hasta el establecimiento del diagnóstico según el tipo de AC (3,9±4,6 meses AC-AL y 34,3±44,6 meses AC-TTR; p<0,001). En cuanto a la cronología, existen importantes diferencias en el retraso diagnóstico entre aquellos pacientes que iniciaron sus síntomas antes y después de 2015 (47,8±51,0 meses en pacientes con inicio de los síntomas antes del 2015 y 10,8±22,7 meses para los pacientes que iniciaron después del 2015; p<0,01).
En el momento del diagnóstico de AC, se encontraban en ritmo sinusal 27 pacientes (61,3%), mientras que los 17 restantes (38,7%) tenían fibrilación auricular. El patrón electrocardiográfico más frecuente fue el de seudoinfarto (28 pacientes; 63,6%), seguido del de bajo voltaje (15 pacientes; 34%). Por el contrario, hasta 6 pacientes (13%) presentaban criterios de hipertrofia del ventrículo izquierdo por criterio de Cornell. El 68% de los pacientes (n=30) tenían algún grado de alteración en el sistema de conducción en el electrocardiograma basal, siendo los más relevantes los hemibloqueos de rama izquierda (17 pacientes, 38%), el bloqueo auriculoventricular de primer grado (13 pacientes, 46%), seguidos del bloqueo completo de rama (12 pacientes, 27%). Ninguna de estas características electrocardiográficas fue diferencial entre ambos tipos de AC. La necesidad de marcapasos fue más frecuente en los pacientes con AC-TTR (26 frente al 6%; p=0,09). En el momento del diagnóstico, 3 pacientes ya eran portadores de marcapasos, y 5 precisaron de estimulación cardiaca permanente a lo largo del seguimiento.
Ecocardiograma transtorácicoEn 43 pacientes (96%) se describe hipertrofia ventricular izquierda concéntrica (fig. 2), con un grosor septal medio de 16±3mm. El patrón moteado sugestivo de miocardiopatía infiltrativa solo se encontraba descrito en el 36% de los casos (n=15). La FEVI se encontraba preservada en 22 pacientes (50%) con un valor medio de 52±17%. El ventrículo derecho se describía como hipertrófico en 10 de los pacientes (23%), con una función conservada en 27 (64%). La presencia de derrame pericárdico fue descrita en 6 pacientes (14%), siendo en todos los casos de características leves. Las características ecocardiográficas de la serie se encuentran reflejadas en la tabla 1.
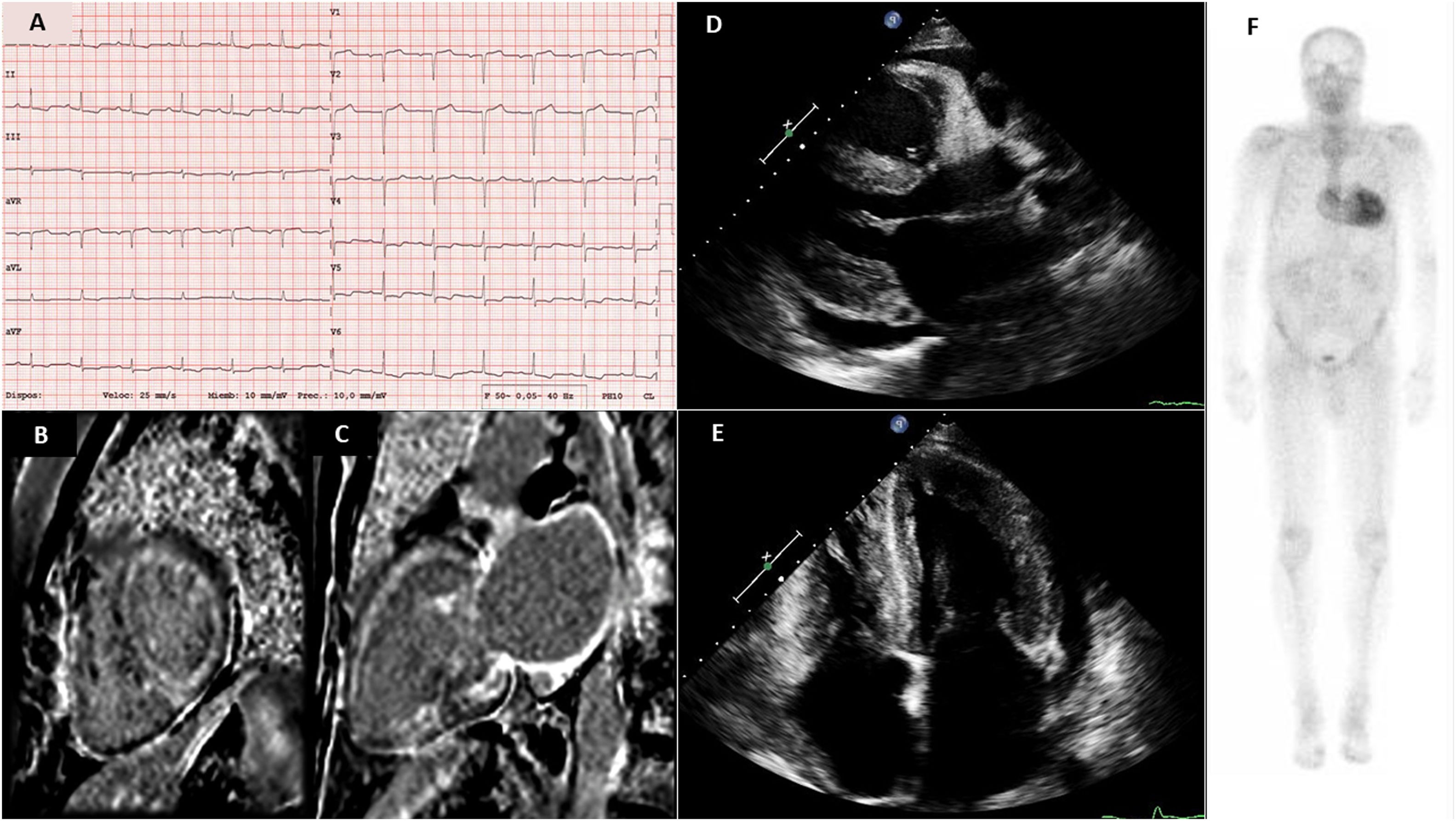
A) Electrocardiograma con bajo voltaje y patrón de seudoinfarto. B y C) Resonancia magnética: Secuencia inversión-recuperación con supresión de señal miocárdica, tras la administración de gadolinio en planos eje corto y 2 cámaras. Se aprecia un patrón de realce tardío global subendocárdico en ventrículo izquierdo. También se aprecia un marcado realce tardío en pared de la aurícula izquierda. D y E) ecocardiograma que muestra hipertrofia biventricular grave y derrame pericárdico en paraesternal eje largo y en apical 4 cámaras. F) Gammagrafía con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico en paciente con amiloidosis cardiaca por depósito de transtirretina con captación grado 3 de Perugini.
Características clínicas y electrocardiográficas basales y características ecocardiográficas basales
| Total AC(N=44) | AC-AL(N=17) | AC-TTR(N=27) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (años) | 73±12 | 68±11 | 77±11 | 0,81 |
| Sexo (varones) | 31 (71%) | 10 (59%) | 21 (78%) | 0,18 |
| Retraso diagnóstico (meses) | 22,6±37,9 | 3,9±4,6 | 34,3±44,6 | <0,01 |
| Creatinina (mg/dl) | 1,4±0,79 | 1,5±1 | 1,31±0,56 | 0,11 |
| Troponina (ng/l) | 430±671 | 280±175 | 550±889 | 0,05 |
| Síntoma de inicio | ||||
| IC descompensada | 26 (59%) | 12 (71%) | 14 (52%) | 0,21 |
| Dolor torácico | 5 (11%) | 2 (12%) | 3 (11%) | 0,94 |
| Fibrilación auricular | 4 (9%) | 1 (6%) | 3 (11%) | 0,55 |
| Polineuropatía | 3 (7%) | 0 | 3 (11%) | 0,15 |
| Síncope | 3 (7%) | 1 (6%) | 2 (7%) | 0,84 |
| Derivación | 2 (4%) | 1 (6%) | 1 (4%) | 0,94 |
| Síndrome constitucional | 1 (2%) | 0 | 1 (4%) | 0,42 |
| Características electrocardiográficas | ||||
| Fibrilación auricular | 17 (38%) | 3 (17%) | 14 (52%) | 0,02 |
| Bajo voltaje | 15 (34%) | 6 (35%) | 9 (33%) | 0,96 |
| Patrón de seudoinfarto | 28 (63%) | 13 (76%) | 15 (55%) | 0,26 |
| HVI | 6 (13%) | 1 (6%) | 5 (18%) | 0,18 |
| BAV | 13 (46%) | 6 (43%) | 7 (50%) | 0,70 |
| BCR | 12 (27%) | 5 (29%) | 7 (29%) | 0,98 |
| BCRI | 4 (9%) | 2 (12%) | 2 (8%) | 0,71 |
| BCRD | 8 (18%) | 3 (18%) | 5 (18%) | 0,81 |
| Hemibloqueo izquierdo | 17 (38%) | 8 (47%) | 9 (33%) | 0,45 |
| Características ecocardiográficas | ||||
| Septo interventricular (mm) | 16±3 | 15±2 | 17±3 | 0,09 |
| DTDVI (mm) | 49±8 | 51±10 | 49±6 | 0,27 |
| DTSVI (mm) | 31±9 | 32±9 | 30±9 | 0,93 |
| FEVI (%) | 52±17 | 54±19 | 52±17 | 0,55 |
| Aurícula izquierda (ml/m2) | 42±16 | 39±8 | 42±18 | 0,11 |
| TAPSE (mm) | 17±5 | 18±5 | 16±4 | 0,87 |
| PSAP (mmHg) | 29±10 | 30±12 | 28±9 | 0,10 |
| Disfunción diastólica | ||||
| Grado 1 | 2 (5%) | 1 (7%) | 1 (4%) | |
| Grado 2 | 10 (27%) | 4 (29%) | 6 (26%) | |
| Grado 3 | 13 (35%) | 6 (43%) | 7 (30%) | |
| Hipertensión pulmonar | 14 (37%) | 6 (38%) | 8 (36%) | 0,94 |
| Derrame pericárdico | 6 (14%) | 3 (18%) | 3 (12%) | 0,57 |
AC-AL: amiloidosis cardiaca por cadenas ligeras; AC-TTR: amiloidosis cardiaca por transtirretina; BAV: bloqueo auriculoventricular de primer grado; BCR: bloqueo completo de rama; BCRD: bloqueo completo de rama derecha; BCRI: bloqueo completo de rama izquierda; IC: insuficiencia cardiaca; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción eyección del ventrículo izquierdo; HVI: hipertrofia del ventrículo izquierdo; PSAP: presión sistólica de la arteria pulmonar; TAPSE: excursión sistólica del anillo tricuspídeo.
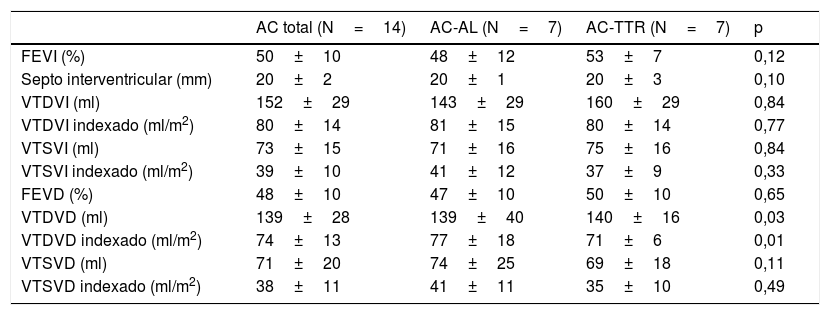
Se dispone de datos de resonancia magnética cardiaca de 14 pacientes (32%). En todos ellos se describe hipertrofia ventricular izquierda concéntrica, con un grosor medio septal de 20±2mm. La FEVI se encontraba preservada en 8 pacientes (57%) con un valor medio de 50±10%. El ventrículo derecho de describía como hipertrófico en 9 casos (64%) de los pacientes, con una fracción de eyección media de 49±10%. Pese a reflejar diferencias estadísticamente significativas en cuanto al volumen telediastólico del ventrículo derecho y el volumen telediastólico del ventrículo derecho indexado entre ambos subtipos de amiloidosis, estas diferencias no se consideraron clínicamente relevantes. En 13 de los casos se administró gadolinio, y en 12 de ellos (86%) se obtuvo un realce tardío del mismo. Solo uno de los casos presentaba el típico patrón de captación subendocárdica en anillo (fig. 2). Por último, cabe destacar que en seis pacientes (43%) hubo dificultad para ajustar el tiempo de inversión y obtener imágenes con anulación de la señal miocárdica. Las características de la cardiorresonancia se encuentran descritas en la tabla 2.
Características de cardiorresonancia basales
| AC total (N=14) | AC-AL (N=7) | AC-TTR (N=7) | p | |
|---|---|---|---|---|
| FEVI (%) | 50±10 | 48±12 | 53±7 | 0,12 |
| Septo interventricular (mm) | 20±2 | 20±1 | 20±3 | 0,10 |
| VTDVI (ml) | 152±29 | 143±29 | 160±29 | 0,84 |
| VTDVI indexado (ml/m2) | 80±14 | 81±15 | 80±14 | 0,77 |
| VTSVI (ml) | 73±15 | 71±16 | 75±16 | 0,84 |
| VTSVI indexado (ml/m2) | 39±10 | 41±12 | 37±9 | 0,33 |
| FEVD (%) | 48±10 | 47±10 | 50±10 | 0,65 |
| VTDVD (ml) | 139±28 | 139±40 | 140±16 | 0,03 |
| VTDVD indexado (ml/m2) | 74±13 | 77±18 | 71±6 | 0,01 |
| VTSVD (ml) | 71±20 | 74±25 | 69±18 | 0,11 |
| VTSVD indexado (ml/m2) | 38±11 | 41±11 | 35±10 | 0,49 |
AC-AL: amiloidosis cardiaca por cadenas ligeras; AC-TTR: amiloidosis cardiaca por transtirretina; FEVD: fracción eyección del ventrículo derecho; FEVI: fracción eyección del ventrículo izquierdo; VTDVD: volumen telediastólico del ventrículo derecho; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVD: volumen telesistólico del ventrículo derecho; VTSVI: volumen telesistólico del ventrículo izquierdo.
La gammagrafía con 99mTc-DPD se realizó en 36 pacientes (12 en AC-AL y 24 en AC-TTR). Los datos de la gammagrafía se muestran en la tabla 3.
Resultados de la gammagrafía con 99mTc-DPD
| AC total(N=44) | AC-AL(N=17) | AC-TT(N=27) | p | |
|---|---|---|---|---|
| Resultados gammagrafía99mTc-DPD | 36 (82%) | 12 (71%) | 24 (89%) | 0,13 |
| Negativa (Grado 0) | 8 (22%) | 7 (58%) | 1 (4%) | <0,01 |
| Grado 1 | 2 (7%) | 2 (12%) | 0 | 0,03 |
| Grado 2-3 | 26 (93%) | 3 (18%) | 23 (100%) | 0,03 |
AC-AL: amiloidosis cardiaca por cadenas ligeras; AC-TTR: amiloidosis cardiaca por transtirretina; 99mTc-DPD: 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico.
Existen datos histológicos de 33 biopsias, correspondientes a 27 pacientes (61%). A 14 pacientes se les realizó una biopsia endomiocárdica, con una rentabilidad del 100% (8 pacientes con AC-AL y 6 pacientes con AC-TTR). Se realizaron como biopsias extracardiacas: 10 biopsias de grasa abdominal (6 positivas para AC), 6 biopsias renales (todas positivas para AC), 2 biopsias de recto (una positiva para AC), y una de nervio sural (positiva para AC-TTR). Cabe destacar que los 4 pacientes con diagnóstico negativo en la biopsia de grasa abdominal fueron finalmente diagnosticados de AC por el análisis histológico de biopsia de otros órganos (3 por biopsia endomiocárdica y uno por biopsia renal).
Estudio genéticoSe encontraron variantes genéticas relacionadas con la amiloidosis por transtirretina hereditaria en 4 de los pacientes con diagnóstico de AC-TTR. Las variantes genéticas halladas fueron en 2 casos la p.Val50Met (en ambos casos los pacientes comenzaron con polineuropatía), un caso de p.Val142del (con inicio por síndrome constitucional sin síntomas neurológicos asociados) y un caso de p.Glu109Lys (con síncope como síntoma de inicio y desarrollo posterior de polineuropatía).
Despistaje de discrasia sanguíneaSe realizó despistaje de discrasia sanguínea en todos los pacientes de la serie, sin embargo, en 3 pacientes, todos ellos con diagnóstico de AC-AL, no fue posible debido a fallecimiento del paciente previo al estudio hematológico, presentando uno de ellos normalidad tanto en el proteinograma como en la inmunofluorescencia de cadenas ligeras en orina, mientras que los 2 pacientes restantes presentaban inmunofluorescencia de cadenas ligeras positivo tanto en orina y suero con un pico monoclonal para IgG-lambda en el proteinograma.
De los 41 pacientes con estudio completo se descartó la existencia de discrasia sanguínea en 27 de ellos, de los cuales 26 tenían diagnóstico de AC-TTR. De los 14 pacientes en los que se estableció un diagnóstico de discrasia sanguínea, 7 tenían un mieloma múltiple (todos ellos con AC-AL) mientras que los 7 restantes presentaban una gammapatía monoclonal de significado incierto (6 con AC-AL y un paciente con AC-TTR).
Pronóstico: mortalidad y reingreso por insuficiencia cardiacaLa serie global tuvo una media de supervivencia desde el inicio de los síntomas de 83,8±14,1 meses. La mortalidad en el seguimiento fue de 19 pacientes (15,6 por 100 pacientes/año) (43,2%; 11 AC-AL y 8 AC-TTR). En los pacientes con AC-AL la causa de mortalidad fue: parada cardiorrespiratoria en 5 casos, shock séptico en 4 casos, y en un paciente se produjo por insuficiencia cardiaca terminal. En uno de los pacientes no fue posible determinar la causa de la muerte. En el caso de los pacientes con AC-TTR las causas de mortalidad fueron: 4 paradas cardiorrespiratorias, un paciente falleció por insuficiencia cardiaca terminal en fallo multiorgánico, 2 pacientes fallecieron en el posoperatorio de una cirugía, y uno de ellos por un shock séptico.
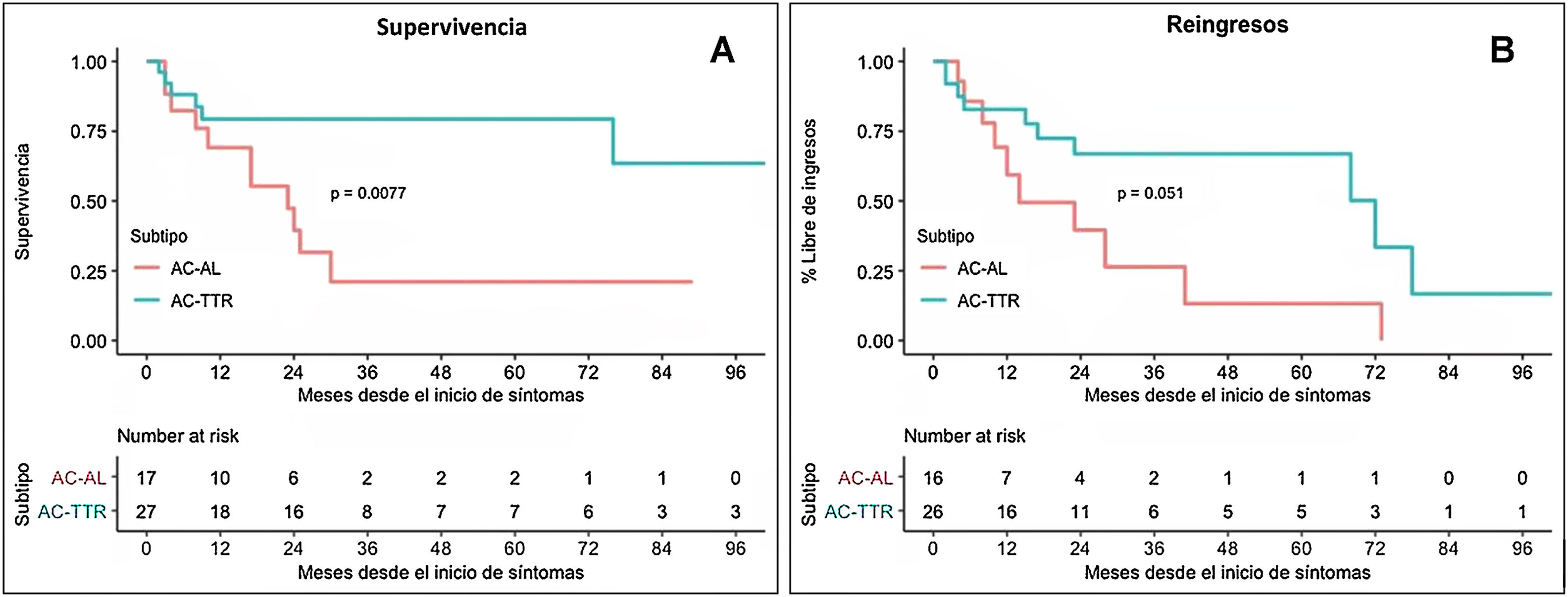
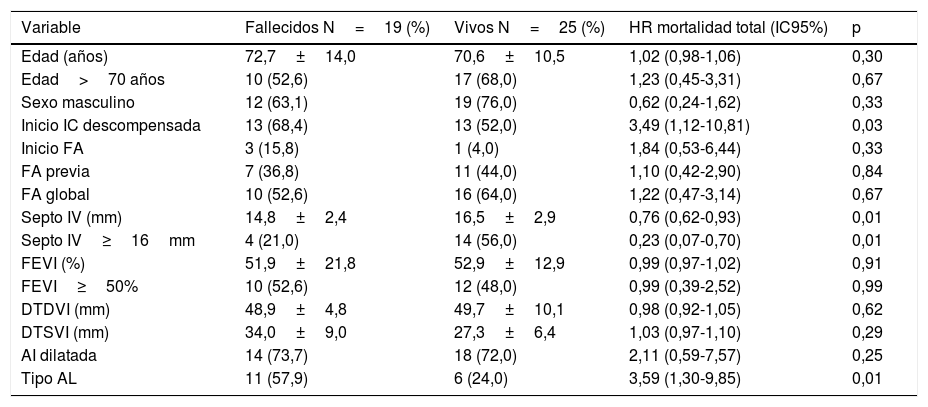
En cuanto al análisis de predictores, los factores asociados de manera significativa a mayor mortalidad por cualquier causa en el análisis no ajustado fueron: el subtipo de AC-AL frente a AC-TTR (57,9 frente al 24,0%; hazard ratio [HR]:=3,59; intervalo de confianza del 95% [IC 95%]: 1,30-9,85; p=0,01; fig. 3), un menor grosor del septo interventricular (14,8±2,4 frente a 16,5±2,9; HR: 0,76; IC 95%: 0,69-0,93; p<0,01) y el inicio por insuficiencia cardiaca (68,4 frente al 52,0%; HR: 3,49; IC 95%: 1,12-10,81; p=0,03) (tabla 4).
A) Estimación de supervivencia mediante análisis de Kaplan-Meier de pacientes con ambos tipos de amiloidosis cardiaca. B) Estimación de reingreso por insuficiencia cardiaca mediante análisis de Kaplan-Meier de pacientes con ambos tipos de amiloidosis cardiaca. AC-AL: amiloidosis cardiaca por depósito de cadenas ligeras; AC-TTR: amiloidosis cardiaca por depósito de transtiretina.
Análisis univariado de Cox para mortalidad en pacientes con amiloidosis cardiaca
| Variable | Fallecidos N=19 (%) | Vivos N=25 (%) | HR mortalidad total (IC95%) | p |
|---|---|---|---|---|
| Edad (años) | 72,7±14,0 | 70,6±10,5 | 1,02 (0,98-1,06) | 0,30 |
| Edad>70 años | 10 (52,6) | 17 (68,0) | 1,23 (0,45-3,31) | 0,67 |
| Sexo masculino | 12 (63,1) | 19 (76,0) | 0,62 (0,24-1,62) | 0,33 |
| Inicio IC descompensada | 13 (68,4) | 13 (52,0) | 3,49 (1,12-10,81) | 0,03 |
| Inicio FA | 3 (15,8) | 1 (4,0) | 1,84 (0,53-6,44) | 0,33 |
| FA previa | 7 (36,8) | 11 (44,0) | 1,10 (0,42-2,90) | 0,84 |
| FA global | 10 (52,6) | 16 (64,0) | 1,22 (0,47-3,14) | 0,67 |
| Septo IV (mm) | 14,8±2,4 | 16,5±2,9 | 0,76 (0,62-0,93) | 0,01 |
| Septo IV≥16mm | 4 (21,0) | 14 (56,0) | 0,23 (0,07-0,70) | 0,01 |
| FEVI (%) | 51,9±21,8 | 52,9±12,9 | 0,99 (0,97-1,02) | 0,91 |
| FEVI≥50% | 10 (52,6) | 12 (48,0) | 0,99 (0,39-2,52) | 0,99 |
| DTDVI (mm) | 48,9±4,8 | 49,7±10,1 | 0,98 (0,92-1,05) | 0,62 |
| DTSVI (mm) | 34,0±9,0 | 27,3±6,4 | 1,03 (0,97-1,10) | 0,29 |
| AI dilatada | 14 (73,7) | 18 (72,0) | 2,11 (0,59-7,57) | 0,25 |
| Tipo AL | 11 (57,9) | 6 (24,0) | 3,59 (1,30-9,85) | 0,01 |
AC-AL: amiloidosis cardiaca por cadenas ligeras; AC-TTR: amiloidosis cardiaca por transtirretina; AI: aurícula izquierda; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; SIV: septo interventricular.
Por otro lado, 21 pacientes (48%) tuvieron al menos un reingreso por insuficiencia cardiaca (24,6 por 100 pacientes/año). El tiempo medio libre de reingresos por insuficiencia cardiaca desde el inicio de los síntomas fue de 59,8±12,6 meses (fig. 3).
DiscusiónEl presente estudio describe las características clínicas de una cohorte de 44 pacientes con diagnóstico establecido de AC. Las variables demográficas de la población estudiada coinciden con las halladas en otras series, con una mayor proporción de varones en la séptima/octava década de la vida siendo esta proporción aún mayor en la cohorte de pacientes con AC-TTR1,11,12.
La AC es enfermedad infradiagnosticada, sobre todo la variante TTR lo que supone un importante retraso en el diagnóstico que hemos podido comprobar en nuestra cohorte (fig. 1), al igual que ocurre en otras series de nuestro entorno13. Cabe destacar la necesidad de mantener una sospecha diagnóstica alta en esta enfermedad. En los últimos años se ha producido un aumento importante de las publicaciones científicas que han implicado cambios en los algoritmos diagnósticos, así como una mayor visibilidad de la misma, demostrando una prevalencia mayor de la esperada clásicamente, lo que abrió la posibilidad diagnóstica a pacientes con menos sintomatología, pero con sospecha ecocardiográfica por hipertrofia ventricular. El fenotipo predominante es el de hipertrofia ventricular izquierda concéntrica sin dilatación ventricular, con aurícula izquierda dilatada y FEVI preservada de forma inicial, pero con una posible progresión posterior a la disfunción ventricular. Pese a que en nuestra serie las diferencias entre subgrupos de AC no fueron significativas, sí que se observa una tendencia hacia un mayor grosor septal y mayor dilatación auricular en aquellos pacientes con AC-TTR, hallazgos ya descritos en otros trabajos publicados previamente13–16, que podría ser debido a un curso más lento y progresivo de este subtipo de AC, que permite un mayor depósito intramiocárdico del material amiloide. Pese a que el número de resonancias realizado en nuestra serie es bajo, los hallazgos encontrados son consistentes con los descritos en otros trabajos17,18.
Los hallazgos electrocardiográficos de nuestra cohorte ponen de manifiesto una mayor prevalencia del patrón de seudoinfarto frente al patrón de bajo voltaje, junto con un porcentaje no despreciable de pacientes que presentaban algún tipo de trastorno de la conducción asociado. Estas alteraciones varían según los trabajos consultados (44-69% el patrón de seudoinfarto y 20-60% el patrón de bajo voltaje)3,13–15. La presencia de fibrilación auricular supone un hallazgo más prevalente entre los pacientes con AC-TTR, ya descrito en la literatura (9-20% en AC-AL frente al 30-45% en AC-TTR)5,13,14, probablemente relacionado con la mayor dilatación auricular izquierda que tienen este subgrupo de pacientes, así como a su mayor edad con respecto a los pacientes con AC-AL. Por otro lado, en nuestro estudio un total de 7 pacientes con AC-TTR (26%) precisaron de marcapasos, frente a solo uno (6%) con AC-AL. Esta mayor necesidad de marcapasos en AC-TTR de nuestra serie es consistente con otros trabajos publicados previamente19–21.
La gammagrafía ósea se ha convertido en una herramienta indispensable en el diagnóstico de la AC ya que orienta al diagnóstico y que permite evitar el estudio invasivo en casos seleccionados6. Los radiotrazadores óseos empleados en la actualidad en la detección de AC son fundamentalmente el 99mTc-DPD, 99mTc-hidroximetileno-difosfonato y 99mTc pirofosfato, que se han mostrado eficaces a la hora de detectar la AC, siendo el 99mTc-DPD el utilizado en nuestro centro. En nuestra cohorte cabe destacar un importante porcentaje de pacientes con AC-AL, superior al 40%, que presentaron algún tipo de captación en la gammagrafía con 99mTc-DPD, hallazgo concordante con lo descrito en otros estudios publicados en la literatura, en el que la gammagrafía mostró entre un 20-50% de captación en pacientes con AC-AL6,21–23, lo que refuerza la importancia del despistaje de discrasia sanguínea asociado a esta técnica para poder eliminar la necesidad de estudio invasivo. La biopsia de grasa abdominal muestra una rentabilidad muy variable (60-80% en AC-AL, 65-85% en AC-TTR hereditaria y solo un 14% en la variante salvaje1,2,24; siendo necesaria la biopsia endomiocárdica en un alto porcentaje de pacientes, con una sensibilidad cercana al 100% con una tasa de complicaciones en torno al 1%. Todo ello pone de manifiesto la necesidad de realizar un abordaje multidisciplinar en el diagnóstico de esta patología sistémica.
En cuanto al pronóstico, la AC es una enfermedad con una evolución muy desfavorable a corto plazo, presentando el subtipo de AC-AL una supervivencia muy inferior a la AC-TTR12,14, con mayor tasa de reingresos por insuficiencia cardiaca; este hallazgo ha sido consistente nuestra población estudiada (fig. 3); sin embargo, los factores pronósticos de esta cardiopatía en la literatura muestran hallazgos dispares y poco establecidos. En nuestra cohorte destaca un peor pronóstico en términos de mortalidad aquellos pacientes que presentan un septo interventricular basal más adelgazado, hecho que podría estar correlacionado con el subtipo de AC-AL; este fenómeno podría estar debido a que el depósito de amiloide por cadenas ligeras podría suponer una mayor toxicidad directa sobre el tejido miocárdico, que ocurre antes del depósito crónico y del incremento del grosor septal16. Por otro lado, ya había sido descrito como factor de mal pronóstico el incremento de NT-ProBNP durante el seguimiento en los pacientes con AC-TTR14. En nuestra serie no disponemos de este valor sistemáticamente al inicio del seguimiento, pero sí hemos podido objetivar como aquellos pacientes que comenzaron con un episodio de insuficiencia cardiaca presentaron un peor pronóstico en términos de mortalidad. Sin embargo, no hemos podido demostrar relación alguna entre el valor de FEVI en el momento del diagnóstico con la mortalidad.
LimitacionesEstudio unicéntrico, con un análisis descriptivo y retrospectivo, con los sesgos inherentes a estos estudios. El tamaño muestral podría ser pequeño para poder descartar diferencias entre los grupos además de las dificultades por la heterogeneidad de presentación, evolución y dificultad diagnóstica de esta enfermedad, por lo que los datos deben ser confirmados en posteriores estudios.
ConclusionesLa AC es una enfermedad infradiagnosticada, aunque en los últimos años se ha incrementado el diagnóstico de casos, especialmente a expensas de AC-TTR. En nuestro medio afecta predominantemente a varones en la séptima década de la vida, con inicio como insuficiencia cardiaca, con alta prevalencia de FEVI reducida en el momento del diagnóstico. El pronóstico de esta patología es infausto, con una mayor mortalidad y reingresos hospitalarios por IC en aquellos pacientes con AC-AL.
FinanciaciónNo se ha recibido financiación.
Contribución de los autoresC. Pericet-Rodríguez y J. López Aguilera han contribuido de igual manera en la elaboración de este trabajo.
C. Pericet-Rodríguez y J. López-Aguilera han participado en la concepción y diseño del estudio y en la redacción principal del manuscrito.
C. Durán-Torralba y J. C. Castillo-Domínguez han participado en el diseño del estudio y en la revisión crítica del contenido.
R. Maza-Muret, S. Espejo-Pérez y R. Ortega-Salas han participado en la redacción del manuscrito.
M. Ruiz-Ortiz y R. González-Manzanares han colaborado en el análisis e interpretación de datos.
J. Perea-Armijo, M. Delgado-Ortega, D. Mesa-Rubio, J. Ruiz de Castroviejo, F. Esteban-Martínez, A. López-Granados, M. Pan Álvarez-Ossorio y M. Anguita-Sánchez han participado en la revisión crítica del contenido.
Conflicto de interesesSin conflictos de intereses que declarar.
- •
La amiloidosis cardiaca es una enfermedad infiltrativa que se presenta predominantemente como insuficiencia cardiaca.
- •
Se considera una enfermedad rara, aunque con el desarrollo de protocolos diagnósticos que no precisan de biopsia, se está demostrando que la prevalencia es mayor de lo que se piensa.
- •
Existen 2 tipos principalmente de amiloidosis cardiaca, por cadenas ligeras (AL) y por transtiretina (ATTR).
- •
En nuestra serie, la amiloidosis cardiaca afecta predominantemente a varones en la séptima edad de la vida, con inicio como insuficiencia cardiaca.
- •
Entre los factores de peor pronóstico en el seguimiento destaca: el inicio como insuficiencia cardiaca, el subtipo de amiloidosis AL y el retraso diagnóstico.
- •
En las pruebas de imagen, el grosor septal aporta mayor información pronóstica que la FEVI.
- •
La biopsia dirigida es altamente rentable, especialmente en el caso de la biopsia endomiocárdica.