Los datos respecto a la utilización del oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) en adultos con shock cardiogénico (SC) son escasos. El objetivo del presente estudio fue describir los datos de un registro multicéntrico español, y analizar qué factores tuvieron un impacto en la mortalidad intrahospitalaria.
MétodosRegistro retrospectivo multicéntrico español de pacientes en situación de SC profundo que recibieron soporte circulatorio con ECMO-VA.
ResultadosDesde enero de 2012 hasta octubre de 2018, se asistieron 233 pacientes con ECMO-VA. La edad media fue 56,3±12,18 años y 50 eran mujeres (21,5%). Recibieron el alta hospitalaria 109 pacientes (46,8%). Las complicaciones más frecuentes observadas fueron: insuficiencia renal aguda en 131 (59,0%), hemorragia en 70 (31,7%), hipoxemia en 86 (36,9%) e infección en 99 (43,4%). Los predictores independientes de mortalidad intrahospitalaria fueron lactato al implante (OR = 1,05; IC95%, 1,05-1,19), edad (OR = 1,04; IC95%, 1,01-1,06) y canulación intraparada cardiaca (OR = 2,19; IC95%, 1,05-4,58). Un total de 45 pacientes tenían edad > 60 años y lactato al implante > 8 mmol/l, su mortalidad intrahospitalaria fue de 77,8% y llegó al 91,7% en 12 de ellos en los que la canulación fue intraparada cardiaca.
ConclusionesLa terapia con ECMO-VA es factible en pacientes con SC profundo. La selección adecuada parece fundamental para evitar la futilidad del implante en pacientes con escasas posibilidades de éxito.
The data regarding the use of venoarterial extracorporeal membrane oxygenation (VA-ECMO) in adults in with cardiogenic shock (CS) are scarce. The aim of this study was to describe the data of a Spanish multicenter registry, and to analyze which factors had an impact on in-hospital mortality.
MethodsRetrospective Spanish multicenter registry of patients with deep CS treated with VA-ECMO circulatory support.
ResultsFrom January 2012 to October 2018, 233 patients were treated with VA-ECMO. Mean age was 56.3±12.18 years and 50 were female (21.5%). A total of 109 patients were successfully discharged (46.8%). The most frequent complications were acute kidney injury in 131 (59.0%), hypoxemia in 86 (36.9%) major bleeding in 70 (31.7%), and infection in 99 (43.4%). The independent in-hospital mortality risk factors were lactate before implant (OR, 1.05; 95%CI, 1.05-1.19), age (OR, 1.04; IC95%, 1.01-1.06), and cannulation during cardiac arrest (OR, 2.19; IC95%, 1.05-4.58). A total of 45 patients > 60 years with lactate before implant > 8 mmol/l had an in-hospital mortality rate of 77.8%, in-hospital mortality and reached 91.7% in 12 of them with cannulation during cardiac arrest.
ConclusionsVA-ECMO therapy for patients with deep cardiogenic shock is feasibly. Appropriate selection seems critical in order to avoid the futility of using ECMO in those patients with low survival chances.
El shock cardiogénico (SC) es aquel estado circulatorio en el que la función cardiaca no es capaz de conseguir un gasto adecuado que supla satisfactoriamente los diferentes requerimientos tisulares. La causa más frecuente del mismo es el síndrome coronario agudo1. El avance en su tratamiento ha permitido una reducción considerable de la mortalidad2. Esto se debió fundamentalmente a las estrategias de reperfusión precoz, especialmente a la revascularización percutánea3. El SC profundo supone una situación hemodinámica refractaria al tratamiento médico con optimización volumétrica y soporte con agentes vasoactivos, que requiere un abordaje agresivo y precoz. Pese a esto, este tipo de SC continúa teniendo una elevada mortalidad, en torno al 70%4.
El soporte circulatorio mecánico puede mejorar el pronóstico del SC al permitir la estabilización hemodinámica, revertir la hipoperfusión tisular y ofrecer una ventana temporal para la recuperación de la función miocárdica. Dentro de los diferentes tipos de soporte mecánico, el oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) es una opción terapéutica interesante en pacientes con SC profundo, pues tiene la ventaja de permitir una restauración rápida de la presión de perfusión, soporte biventricular y respiratorio5. Si el miocardio no consigue recuperarse, el ECMO-VA sirve de «puente» al trasplante cardiaco o al implante de una asistencia de mayor duración. Aunque los primeros implantes de ECMO-VA se llevaron a cabo en la década de los 70, no fue hasta el 2007 cuando se observó una expansión en el uso de este soporte circulatorio mecánico. En concreto, el incremento en la utilización del ECMO-VA en la población adulta ha sido exponencial con más de 19.000 implantes según el último reporte de la Extracorporeal Life Support Organization (ELSO)6. En España, también hemos asistido al auge de esta terapia, especialmente en el contexto del SC refractario7, aunque los datos en el adulto se limitan a pequeñas series unicéntricas sin haberse publicado registros de mayor tamaño.
En la actualidad, los criterios que establecen las guías de práctica clínica para su uso son muy generales8, por lo que frecuentemente la experiencia personal y del centro juega un papel crucial en la indicación. La identificación de factores pronósticos adaptada a nuestro entorno es crucial para una selección adecuada de los pacientes que redunde en un mayor beneficio clínico. El objetivo del presente estudio fue describir los datos de un registro multicéntrico español, y analizar qué factores tuvieron un impacto en la mortalidad intrahospitalaria.
MétodosDescripción del registroRegistro multicéntrico retrospectivo de tres servicios de cardiología en centros académicos españoles, desde enero de 2012 hasta octubre de 2018. Se incluyeron pacientes en SC refractario que recibieron implante de ECMO-VA. Se siguieron las directrices de los principios éticos de la declaración de Helsinki, dada la gravedad de la condición clínica de los pacientes que motivó el implante del dispositivo, así como la naturaleza retrospectiva del estudio, el Comité de Ética del hospital nos eximió del consentimiento informado.
Selección de pacientesLa información recogida en este registro se obtuvo mediante una revisión individualizada caso por caso de cada una de las historias clínicas de los pacientes incluidos. El criterio de inclusión fue la presencia de SC refractario definido como aquella situación hemodinámica consecuencia de un insulto a la función cardiaca que no responde al tratamiento etiológico, optimización volumétrica y soporte con medicación vasoactiva, produciendo un estado persistente de bajo gasto cardiaco e hipoperfusión tisular. Se utilizaron como criterios objetivos la presencia de una presión arterial sistólica inferior a 90 mmHg y un lactato arterial > 2 mmol/l, a pesar del tratamiento médico descrito y, cuando correspondiese, del balón de contrapulsación intraaórtico. Asimismo, también se incluyeron aquellos pacientes rescatados con ECMO-VA por parada cardiorrespiratoria intrahospitalaria, presenciada y refractaria a las maniobras de reanimación cardiopulmonar convencional.
Implante del ECMO-VASe realizó un abordaje periférico para el implante del dispositivo Cardiohelp (Maquet, Alemania). Se utilizó el acceso femoral, percutáneo o quirúrgico, para el posicionamiento de una cánula larga de drenaje en la aurícula derecha (21-27 Fr) y una cánula corta arterial en la aorta (15-19 Fr). Asimismo, y siempre que fue posible, se utilizó una pequeña cánula (5-7 Fr) para garantizar la perfusión anterógrada del miembro mediante su inserción en la arteria femoral superficial.
De cada paciente, se recogieron variables relativas a las características clínicas y tratamiento recibido previo al implante, complicaciones relacionadas con el ECMO y supervivencia a corto plazo.
Análisis estadísticoSe realizó un análisis descriptivo de las características clínicas basales de los pacientes al implante del dispositivo, características del implante, complicaciones durante el soporte mecánico, supervivencia y causas de muerte. La descripción de las variables cuantitativas continuas se realizó en forma de media±desviación estándar o mediana±rango intercuartílico (en caso de distribuciones asimétricas), mientras que las variables discretas se expresaron en porcentaje. Se utilizó la prueba de la χ2 o la prueba exacta de Fisher para comparar las frecuencias, las diferencias en las variables continuas se evaluaron con la prueba de la t de Student o la prueba de la U de Mann-Whitney, según correspondiera. Para la identificación de predictores de supervivencia al alta se empleó un análisis de regresión logística multivariable por pasos hacia adelante con un criterio de entrada p < 0,05 (stepwise). Se usó el paquete estadístico SPSS 20.
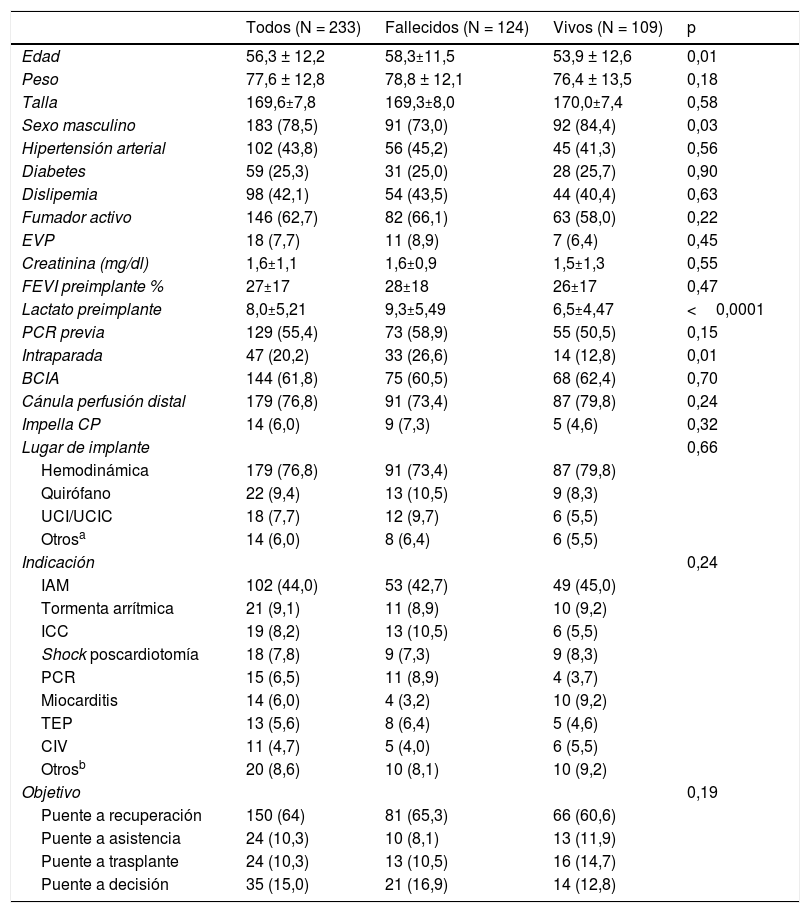
ResultadosSe incluyeron un total de 233 pacientes, con edad media de 56,3 ± 12,18 años, el 78,5% eran varones. Las características basales de los pacientes están recogidas en la tabla 1.
Características de los pacientes en función de la supervivencia al alta
| Todos (N = 233) | Fallecidos (N = 124) | Vivos (N = 109) | p | |
|---|---|---|---|---|
| Edad | 56,3 ± 12,2 | 58,3±11,5 | 53,9 ± 12,6 | 0,01 |
| Peso | 77,6 ± 12,8 | 78,8 ± 12,1 | 76,4 ± 13,5 | 0,18 |
| Talla | 169,6±7,8 | 169,3±8,0 | 170,0±7,4 | 0,58 |
| Sexo masculino | 183 (78,5) | 91 (73,0) | 92 (84,4) | 0,03 |
| Hipertensión arterial | 102 (43,8) | 56 (45,2) | 45 (41,3) | 0,56 |
| Diabetes | 59 (25,3) | 31 (25,0) | 28 (25,7) | 0,90 |
| Dislipemia | 98 (42,1) | 54 (43,5) | 44 (40,4) | 0,63 |
| Fumador activo | 146 (62,7) | 82 (66,1) | 63 (58,0) | 0,22 |
| EVP | 18 (7,7) | 11 (8,9) | 7 (6,4) | 0,45 |
| Creatinina (mg/dl) | 1,6±1,1 | 1,6±0,9 | 1,5±1,3 | 0,55 |
| FEVI preimplante % | 27±17 | 28±18 | 26±17 | 0,47 |
| Lactato preimplante | 8,0±5,21 | 9,3±5,49 | 6,5±4,47 | <0,0001 |
| PCR previa | 129 (55,4) | 73 (58,9) | 55 (50,5) | 0,15 |
| Intraparada | 47 (20,2) | 33 (26,6) | 14 (12,8) | 0,01 |
| BCIA | 144 (61,8) | 75 (60,5) | 68 (62,4) | 0,70 |
| Cánula perfusión distal | 179 (76,8) | 91 (73,4) | 87 (79,8) | 0,24 |
| Impella CP | 14 (6,0) | 9 (7,3) | 5 (4,6) | 0,32 |
| Lugar de implante | 0,66 | |||
| Hemodinámica | 179 (76,8) | 91 (73,4) | 87 (79,8) | |
| Quirófano | 22 (9,4) | 13 (10,5) | 9 (8,3) | |
| UCI/UCIC | 18 (7,7) | 12 (9,7) | 6 (5,5) | |
| Otrosa | 14 (6,0) | 8 (6,4) | 6 (5,5) | |
| Indicación | 0,24 | |||
| IAM | 102 (44,0) | 53 (42,7) | 49 (45,0) | |
| Tormenta arrítmica | 21 (9,1) | 11 (8,9) | 10 (9,2) | |
| ICC | 19 (8,2) | 13 (10,5) | 6 (5,5) | |
| Shock poscardiotomía | 18 (7,8) | 9 (7,3) | 9 (8,3) | |
| PCR | 15 (6,5) | 11 (8,9) | 4 (3,7) | |
| Miocarditis | 14 (6,0) | 4 (3,2) | 10 (9,2) | |
| TEP | 13 (5,6) | 8 (6,4) | 5 (4,6) | |
| CIV | 11 (4,7) | 5 (4,0) | 6 (5,5) | |
| Otrosb | 20 (8,6) | 10 (8,1) | 10 (9,2) | |
| Objetivo | 0,19 | |||
| Puente a recuperación | 150 (64) | 81 (65,3) | 66 (60,6) | |
| Puente a asistencia | 24 (10,3) | 10 (8,1) | 13 (11,9) | |
| Puente a trasplante | 24 (10,3) | 13 (10,5) | 16 (14,7) | |
| Puente a decisión | 35 (15,0) | 21 (16,9) | 14 (12,8) |
BCIA: balón de contrapulsación intraaórtico; CIV: comunicación interventricular; EVP: enfermedad vascular periférica; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICC: insuficiencia cardiaca crónica; IMC: índice de masa corporal; PCR: parada cardiorrespiratoria; UCI: unidad de cuidados intensivos; UCIC: unidad de cuidados intensivos cardiológicos.
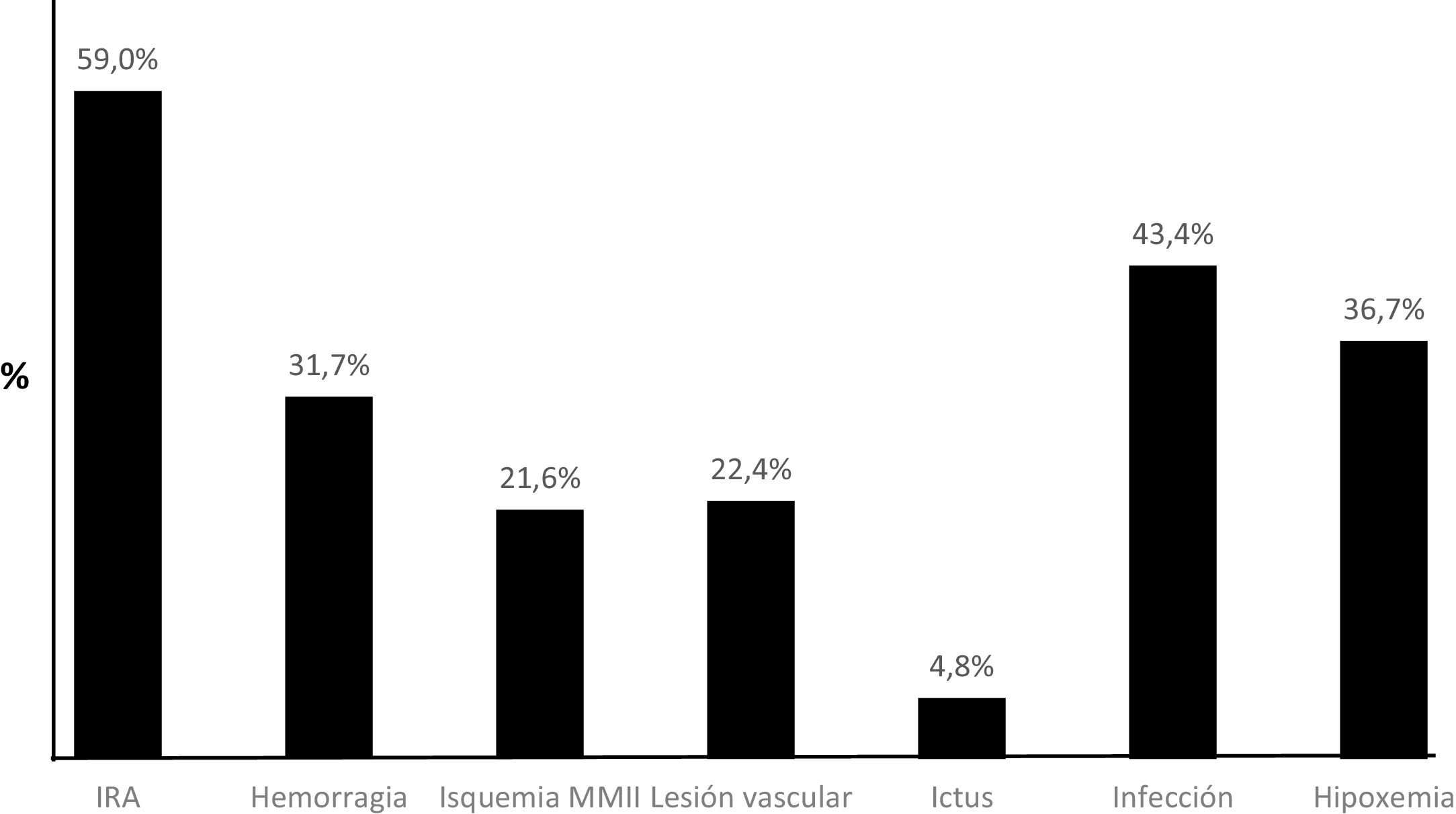
La fracción de eyección del ventrículo izquierdo media previa al implante fue de 27 ± 17% y el lactato medio de 8,0 ± 5,2 mmol/l. Un total de 132 pacientes (56,6%) sufrieron una parada cardiorrespiratoria previa, siendo canulados intraparada 47 (20,2%). La causa más frecuente del SC fue el infarto agudo de miocárdico, seguida por la tormenta arrítmica y la insuficiencia cardiaca crónica descompensada. El lugar más habitual de implante fue el laboratorio de hemodinámica, seguido por el quirófano y la unidad de cuidados intensivos cardiacos. La canulación del dispositivo se realizó vía percutánea en 160 casos (69,0%) frente a 63 accesos por vía quirúrgica (31,0%). Para evitar la isquemia arterial del miembro, se colocó una pequeña cánula de perfusión distal en 179 (76,8%) de los implantes. Asimismo, en 144 (61,8%) se insertó, por el miembro contralateral, un balón de contrapulsación intraaórtico. La mediana de tiempo en ECMO fue de 5 días [rango 1-24]. Las complicaciones más frecuentes se muestran en la figura 1.
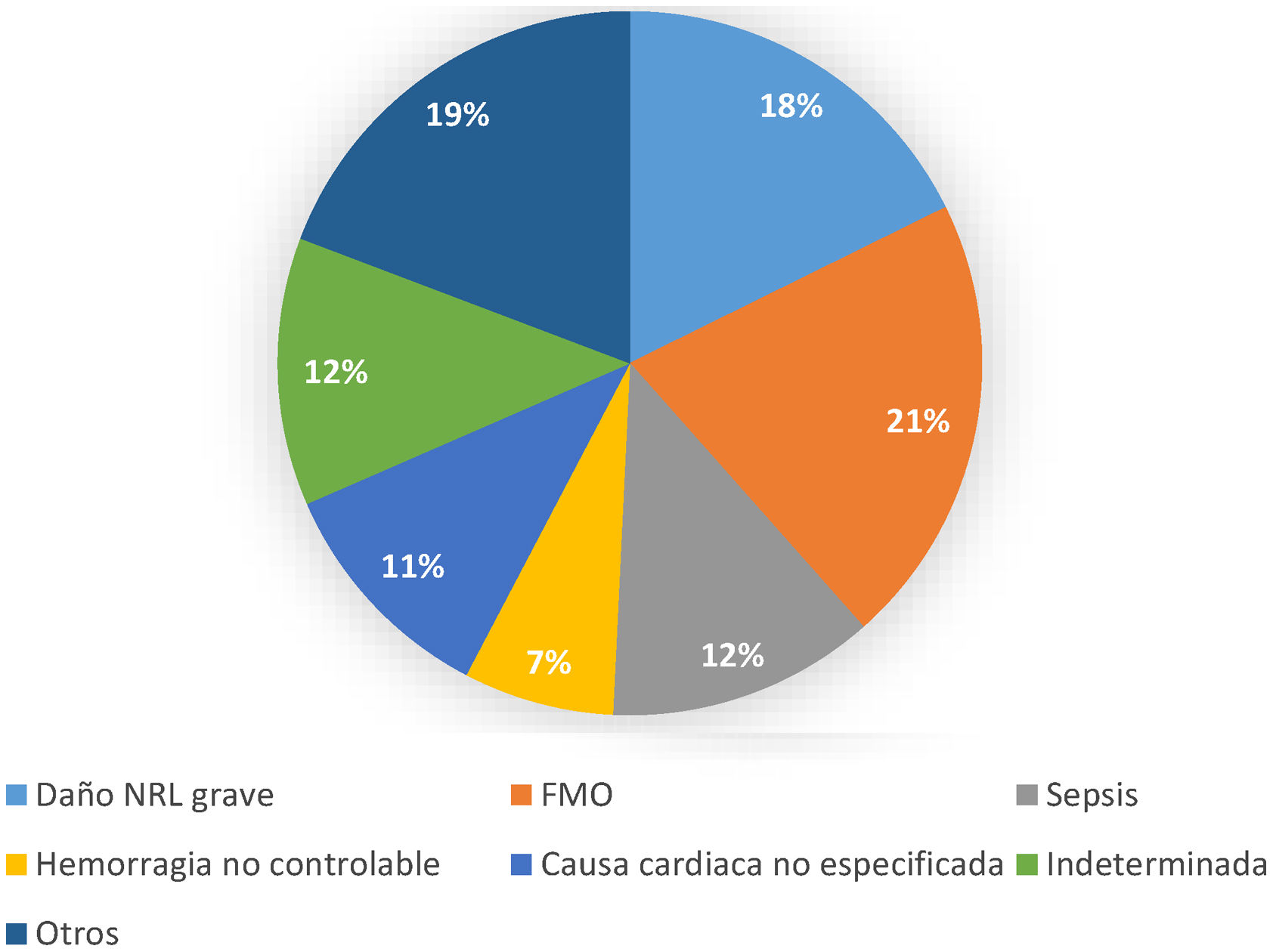
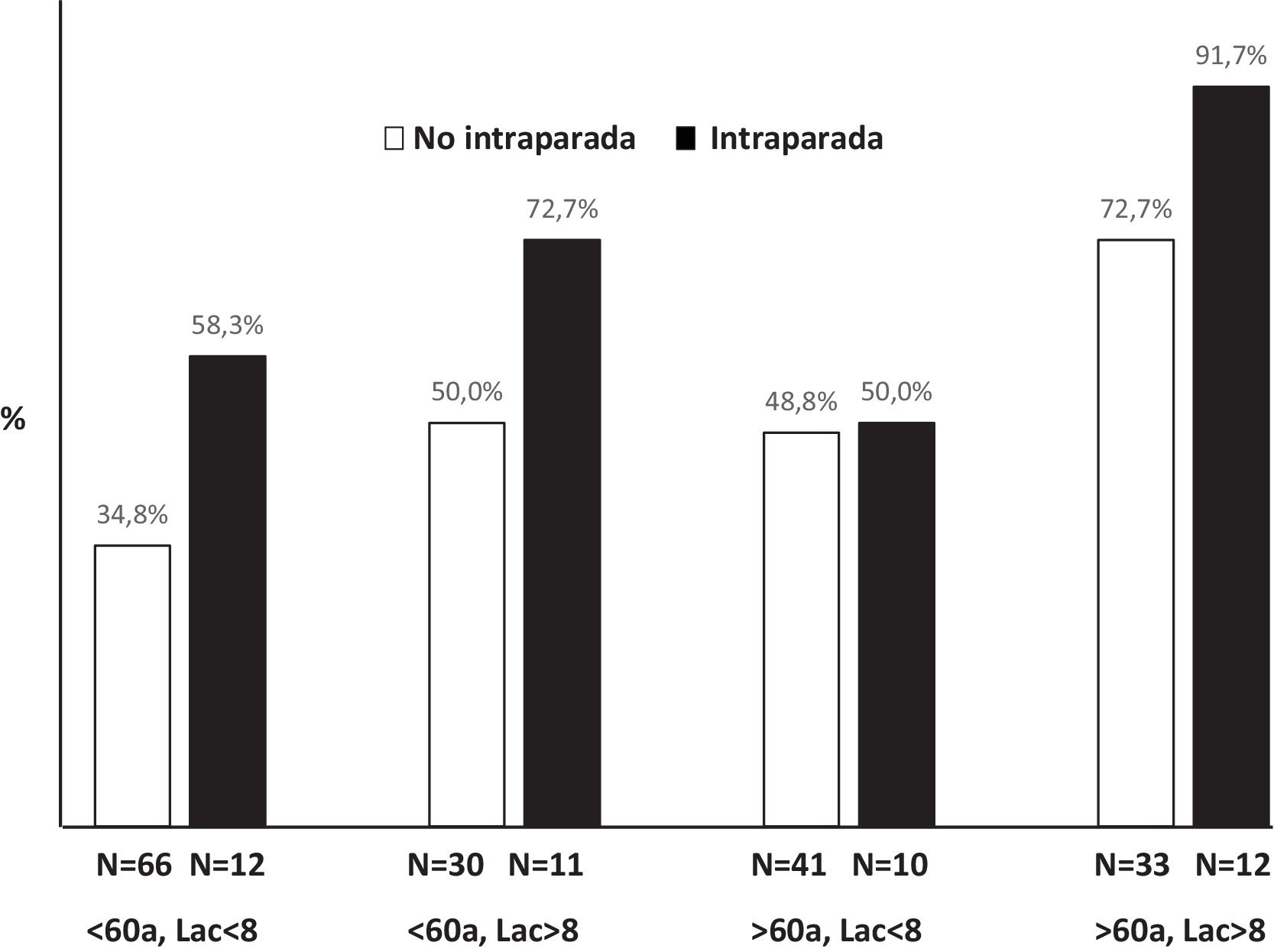
La mortalidad intrahospitalaria observada fue del 53,2%. El subgrupo de miocarditis presentó el mejor pronóstico de toda la cohorte de pacientes, alcanzando una supervivencia al alta del 71,4%. La distribución de las causas de muerte se muestra en la figura 2. En 215 pacientes (92,3%) se disponía del nivel de lactato en sangre en el momento del implante. Los predictores independientes de mortalidad intrahospitalaria fueron el lactato al implante (odds ratio [OR] = 1,05; intervalo de confianza [IC95%], 1,05-1,19), la edad (OR = 1,04; IC95%, 1,01-1,06) y la canulación intraparada (OR = 2,19; IC95%, 1,05-4,58). Un total de 45 pacientes (19,3%) tenían edad > 60 años y lactato al implante > 8 mmol/l, su mortalidad intrahospitalaria fue del 77,8%. Esta mortalidad llegó al 91,7% si, además de que los pacientes tuvieran lactato al implante y edad elevadas, la canulación era intraparada (fig. 3). Por el contrario, el grupo de menores de 60 años con lactato al implante < 8 mmol/l en los que no se realizó canulación intraparada tuvo la mortalidad más baja (34,8%). Los puntos de corte para la edad (60 años) y lactato al implante (8 mmol/l) se obtuvieron mediante análisis de curva ROC. Con las 3 variables lactato elevado (sí/no), edad elevada (sí/no) y canulación intraparada (sí/no) se desarrolló un índice que mostró una capacidad de discriminación interna aceptable (c = 0,65; IC95%, 0,62-0,68) y una buena calibración, con un estadístico C de Hosmer-Lemeshow de 9,2 (p = 0,22).
Principal causa de mortalidad. Otros: isquemia intestinal (0,8%), isquemia arterial (1,5%), tormenta arrítmica (3,8%), distrés respiratorio (1,5%), insuficiencia cardiaca terminal (1,5%), decanulación accidental (2,3%), imposibilidad para canular (0,8%), hemorragia intracraneal (3,8%), no recuperación (1,5%). FMO: fracaso multiorgánico; NRL: neurológico.
La terapia con ECMO-VA es factible en pacientes con SC profundo, con una supervivencia al alta cercana al 50%. Sin embargo, la selección adecuada de los pacientes parece fundamental para evitar la futilidad del implante. Nuestros datos sugieren que se debe evaluar de forma cuidadosa el implante del ECMO-VA en pacientes con más de 60 años y niveles de lactato elevados, ya que en este perfil concreto las probabilidades de éxito son muy escasas.
La mortalidad intrahospitalaria observada en nuestra cohorte de pacientes fue del 53,2%, acorde con los resultados previamente publicados en otras grandes series, en los que se comunica una mortalidad entre el 45-75%9-11. Se debe resaltar la gravedad de los pacientes incluidos en este registro, la cual queda reflejada en el hecho de que la mayoría presentara una parada cardiorrespiratoria previa al implante. Es más, el 20% de los enfermos se canularon durante las maniobras de reanimación cardio-pulmonar. Las principales causas de muerte en nuestra serie de casos coinciden con las previamente publicadas en la literatura: fracaso multiorgánico, daño neurológico grave y sepsis12. Tres factores mostraron ser predictores independientes de mortalidad intrahospitalaria en el análisis multivariado: edad, lactato y canulación intraparada. El análisis por subgrupos realizado, en función de la edad y el lactato previo al implante, resalta la importancia de realizar una adecuada selección de los candidatos a esta terapia, así como la necesidad de implementar el soporte en la «ventana de tiempo» adecuada para evitar la futilidad del implante. Estos hallazgos son concordantes con los concluidos en registros previos13,14. En nuestra serie el sexo, la etiología del SC, así como la función renal previa al implante no tuvieron impacto significativo en el análisis realizado9. En algunas de estas variables es posible que no se detecten diferencias significativas debido al tamaño muestral, así, por ejemplo, se ha encontrado una tendencia a una mayor supervivencia al alta en la miocarditis aguda, algo ya descrito previamente15. A pesar de que los pacientes canulados intraparada presentaron una mayor mortalidad intrahospitalaria, la resucitación con ECMO-VA en parada cardiopulmonar refractaria ha demostrado conseguir en otras series una supervivencia al alta en torno al 34%, en un contexto cuya mortalidad probablemente sea cercana al 100%16. Los resultados de ECMO-VA en parada intrahospitalaria parecen ser mejores en pacientes con cardiopatía isquémica y fibrilación ventricular refractaria17. La organización y la gestión de recursos en este contexto clínico puede suponer un verdadero reto a la hora de reducir el tiempo de implante.
El ECMO-VA permite la estabilización hemodinámica y ofrece la posibilidad de instaurar tratamientos etiológicos específicos (revascularización coronaria, trombectomía mecánica percutánea, ablación de sustrato arrítmico, etc.). Esto es especialmente relevante en el caso del SC producido por el infarto agudo de miocardio. La estabilización hemodinámica previa a la revascularización, o inmediatamente posterior a esta, parece conseguir unos resultados superiores en este contexto18,19. La obtención de un flujo Thrombolysis in Myocardial Infarction (TIMI) III tras la angioplastia primaria, ha demostrado ser un predictor independiente de recuperación de la función ventricular izquierda en pacientes con infarto en SC, soportados con ECMO-VA20.
No obstante, a pesar de que esta terapia permite conseguir rescatar a un grupo de pacientes con pronóstico ominoso, su empleo conlleva una importante carga de complicaciones asociada. En la literatura se han descrito diferentes tasas de complicaciones debido a la variabilidad en el tamaño muestral y en la definición de las mismas. En un metanálisis de 1.866 pacientes correspondientes a 17 estudios, se comunicaron los siguientes eventos adversos como más frecuentes: insuficiencia renal aguda, hemorragia e infección. Estos hallazgos coinciden con los de nuestra serie21. En este sentido, es muy importante que el implante sea llevado a cabo por cardiólogos intervencionistas o cirujanos con experiencia. En concreto, la utilización de la guía radioscópica y ecocardiográfica en el caso del acceso percutáneo parece reducir el número de complicaciones locales, especialmente cuando la canulación se realiza intraparada22. La utilización de una cánula de perfusión distal en la arteria femoral superficial ha demostrado reducir la tasa de isquemia periférica y, por lo tanto, se debe implantar de rutina siempre que las condiciones del paciente lo permitan23. Otra potencial complicación a tener en cuenta es el aumento de la poscarga. Existen diferentes estrategias para evitar la dilatación del ventrículo izquierdo y el aumento de la presión telediastólica del mismo, lo cual produciría un incremento en la congestión pulmonar e hipoxemia en territorio coronario y cerebral (síndrome de Arlequín)24. Por un lado, se debe intentar incrementar la contractilidad del ventrículo izquierdo con fármacos inotrópicos positivos y, por otro, intentar descargar el ventrículo mediante: septostomía auricular, cánula ventrícular25 o, quizás la alternativa más interesante, mediante Impella (Abiomed, Estados Unidos) (bomba microaxial de flujo continuo)26. Existe cierta controversia en la utilidad del balón de contrapulsación intraaórtico en este contexto. Sin embargo, una revisión reciente de los grandes estudios observacionales sugiere un probable beneficio de esta terapia27. En nuestra serie el implante del balón no se relacionó con una mayor supervivencia al alta, lo que también es concordante con datos previos28.
LimitacionesNuestro estudio presentado tiene las limitaciones inherentes a su carácter retrospectivo. También, al tratarse de un registro de 3 centros, pese a haber usado una base de datos común, podría existir heterogeneidad de recogida de la información. Por otro lado, únicamente se dispone de los datos de SC refractario que recibieron terapia con ECMO-VA, sin datos de los casos en los que no se implantó este dispositivo. No obstante, nuestro registro aporta la mayor experiencia recogida hasta la fecha en el tratamiento del SC refractario con ECMO-VA en España. Nuestros datos muestran los resultados obtenidos de tres grandes centros académicos por lo que no son extrapolables a otros contextos. Esto es particularmente cierto en el SC refractario, dada su extrema complejidad y la elevada tasa de complicaciones del ECMO-VA. El tratamiento de esta terapia probablemente se deba circunscribir a centros con alto volumen y experiencia, tanto en el implante como en el seguimiento posterior en unidad de cuidados críticos cardiológicos.
ConclusionesLa terapia con ECMO-VA es factible en pacientes con SC profundo. La identificación de factores pronósticos parece fundamental para conseguir una adecuada selección, evitando la posible futilidad del implante en pacientes con escasas posibilidades de éxito.
FinanciaciónEste estudio ha sido financiado en parte con la beca Proyecto de Investigación con financiación interna 2020/UEM10, Universidad Europea, Madrid, España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.