La bacteriemia es un evento mayoritariamente hospitalario que levanta sospechas frecuentes de endocarditis infecciosa. En una cohorte con bacteriemia por microorganismos usuales, se pretende determinar la prevalencia de endocarditis, sus características epidemiológicas asociadas y el impacto pronóstico de su diagnóstico.
MétodosEstudio retrospectivo que incluyó a pacientes con hemocultivos positivos entre abril de 2019 y septiembre de 2020 en una comunidad autónoma española para las principales bacterias asociadas a endocarditis infecciosa: Staphylococcus aureus, estafilococos coagulasa-negativos, Streptococcus spp. y Enterococcus spp. Los datos se extrajeron de la base centralizada del laboratorio de microbiología y de la revisión de la historia clínica electrónica.
ResultadosSe incluyeron 900 casos de hemocultivos positivos en 873 pacientes. El grupo de microorganismos más aislados fueron los estafilococos coagulasa-negativos (548 casos, 60,9%) y el menos frecuente el Enterococcus spp. (97; 10,8%). Se diagnosticaron 36 casos de endocarditis infecciosa (4,0%). La mayor prevalencia se produjo para S. aureus (9,40%; p<0,001). La cardiopatía predisponente y el número de frascos con aislamiento se asociaron positivamente con esta endocarditis.
ConclusionesEn pacientes con hemocultivos positivos para bacterias habituales, la prevalencia de endocarditis infecciosa fue del 4%, con S. aureus como el microorganismo más prevalente. El número de frascos ≥ 3 y el antecedente de valvulopatía/dispositivo intracardiaco fueron factores predictores de su diagnóstico.
Bacteremia is mostly an in-hospital event that frequently raises suspicions of infective endocarditis (I). This work aims to determine the prevalence of infective endocarditis in a cohort with bacteriemia by common germs, to determine the associated epidemiological characteristics and to assess the prognostic impact of the diagnosis.
MethodsRetrospective study that included patients with positive blood cultures for the bacteria most frequently associated with infective endocarditis: Staphylococcus aureus, coagulase-negative staphylococci, streptococci, and enterococci, between April 2019 and September 2020 in an autonomous community of Spain. Data were extracted both from the centralized database of the microbiology laboratory and from the electronic medical records.
ResultsA total of 900 positive blood cultures from 873 patients were included. The most frequently isolated (group of) microorganisms were coagulase-negative staphylococci (548 cases, 60.9%) and the least frequent was enterococcus (97, 10.8%). Thirty-six cases of endocarditis (4.0%) were diagnosed. The highest prevalence occurred for S. aureus (9.40%) (P <.001). Underlying predisposing heart disease and the number of bottles with germ isolation were positively associated with infective endocarditis.
ConclusionsAmong patients with positive blood cultures for common bacteria, the prevalence of infective endocarditis was 4%. S. aureus was the most prevalent germ. The predictors of diagnosis were the number of bottles ≥ 3 and the history of valve disease/intracardiac device.
La bacteriemia es un evento clínicamente relevante tanto por su incidencia creciente en ciertos contextos clínicos1-5 como por su impacto pronóstico1,6,7. La presencia de hemocultivos positivos siempre plantea la posibilidad de endocarditis infecciosa (EI) como origen de la bacteriemia o, según el contexto, como complicación derivada de la propia bacteriemia. Actualmente, Staphylococcusaureus(S. aureus), los Staphylococcus coagulasa-negativos (S. CoN), los Streptococcus spp. y los Enterococcus spp. son causantes del 70-80% de todas las EI en países desarrollados8,9. Ante un aislamiento positivo para alguno de estos microorganismos, está justificado descartar la presencia de EI por las implicaciones del diagnóstico10, pero esto se contrapone a los inconvenientes del proceso diagnóstico y al consumo de recursos que implica dicho proceso. La prevalencia de EI en pacientes con bacteriemia es muy variable, oscila entre el 1,6% y el 32% y depende, fundamentalmente, del tipo de microorganismo aislado y del ámbito y metodología del estudio11-28. La mayoría de los estudios se centran en un determinado microorganismo. Hasta ahora solo 2 estudios han analizado la prevalencia de EI y sus predictores en pacientes con bacteriemia producida por los 4 tipos de cocos grampositivos más asociados a EI. En un estudio realizado en Dinamarca, Østergaard et al.11 encontraron que los Enterococcus spp. eran el género asociado con más frecuencia a EI, seguidos del S. aureus. En otro estudio también danés y del ámbito hospitalario, Andersen et al.21 encontraron unas prevalencias algo más elevadas de EI en una cohorte igualmente multietiológica, en un contexto de uso liberal de la ecocardiografía (71% de los casos).
En este contexto, el presente estudio tiene como objetivo: 1) determinar la prevalencia de EI en nuestro medio en una cohorte de pacientes con bacteriemia por los tipos de bacterias causantes de EI más frecuentes; 2) determinar qué características epidemiológicas se asocian significativamente a dicha prevalencia y 3) determinar las implicaciones pronósticas del diagnóstico de EI.
MétodosFuente de los datosSe realizó un estudio observacional y retrospectivo de todos los episodios de bacteriemia diagnosticados en un laboratorio de microbiología que centraliza desde abril de 2019 todos los cultivos realizados en la Comunidad Autónoma de Cantabria, constituida por 584.000 habitantes. Todos los centros públicos de la comunidad (un hospital de tercer nivel y 2 de segundo nivel) comparten una historia clínica electrónica única. Cada incorporación de un paciente se actualiza en una estructura centralizada indexada mediante la tarjeta sanitaria del Sistema Nacional de Salud y se actualiza, asimismo, si el paciente ha fallecido, siempre que lo haga dentro de la comunidad, mediante consulta periódica semanal al Registro Civil. Para cada paciente se puede acceder a los resultados del laboratorio de microbiología y a los recursos de atención primaria. Los datos clínicos de los pacientes se obtuvieron de la revisión de las historias clínicas electrónicas mediante un formulario específicamente establecido para los propósitos del estudio. El estado vital se comprobó con fecha de 31 de enero de 2022. En este artículo se cumple con las responsabilidades éticas y no aparecen datos de pacientes.
Cohorte de estudio y definicionesLa población del estudio incluyó a todos los pacientes con un hemocultivo positivo para cocos grampositivos, clasificados en 4 grupos sin rigor microbiológico, pero de uso habitual en el contexto de las EI: S. aureus, S. CoN, Enterococcus spp. o Streptococcus spp., que suponen alrededor del 70-80% de los episodios de EI en Europa8,9. El periodo de estudio incluyó los datos desde abril de 2019 hasta septiembre de 2020. Se excluyó a pacientes menores de 18 años, a los residentes en otra comunidad autónoma o a los sujetos a protección de datos. Se incluyó tanto a pacientes hospitalizados como a los tratados ambulatoria o domiciliariamente.
Se consideró hemocultivo positivo el aislamiento en al menos un frasco de uno de los microorganismos citados y el mismo caso en los cultivos positivos para el mismo microorganismo en un mismo paciente en un periodo ≤ 30 días. Pasados 30 días se consideraron como casos independientes. Si había varios microorganismos se consideró como culpable al primero en la línea temporal o aquel con mayor número de frascos positivos si el aislamiento fue en la misma fecha. Se consideró como de origen nosocomial si el tiempo transcurrido entre el ingreso hospitalario y la fecha de extracción del primer hemocultivo positivo fue mayor de 48 h.
Se consideraron episodios de EI los casos que cumplían criterios de Duke o los casos con aislamiento microbiológico en material valvular obtenido por cirugía o necropsia10. Con fines estrictamente descriptivos, el tiempo hasta el diagnóstico de EI se midió entre la fecha del primer hemocultivo positivo y la primera fecha en que constaba el diagnóstico en la historia clínica. Los ecocardiogramas fueron llevados a cabo en los centros hospitalarios correspondientes por operadores expertos con nivel III de la American Society of Echocardiography.
Objetivo del estudioEl objetivo primario del estudio fue establecer la prevalencia de EI. Los objetivos secundarios fueron determinar los factores demográficos o epidemiológicos asociados al diagnóstico definitivo de EI y determinar el impacto sobre la supervivencia de dicho diagnóstico.
Análisis estadísticoLas variables categóricas se resumen como frecuencia y porcentaje y las variables cuantitativas como media±desviación estándar o mediana y rango intercuartílico (RIC), según se distribuyeran o no normalmente. Para las comparaciones entre grupos se empleó el test de χ2 para variables categóricas y, debido a la presencia de distribución no normal, el test de Kruskall Wallis para las variables cuantitativas. La asociación de las variables demográficas y clínicas con el diagnóstico de EI se analizó mediante regresión logística penalizada según lo descrito por Firth et al.29. Con este procedimiento se pretendió evitar el problema de predicción perfecta o casi perfecta que se observó en algunas variables explicativas de nuestro estudio. La relación entre las características de la población y la supervivencia se modeló mediante regresión de riesgos proporcionales de Cox, calculándose asimismo la hazard ratio (HR) y el intervalo de confianza del 95% (IC 95%). En los análisis multivariables se introdujeron las variables que consiguieron una significación <0,10 en la regresión univariable. El tiempo hasta la muerte, o hasta que el caso se censuró, se analizó mediante el método de Kaplan-Meier y las curvas correspondientes se compararon mediante el test log-rank. En todas las regresiones, los intervalos de confianza se estimaron mediante remuestreo (bootstraping) con el uso de 100 repeticiones.
Para ajustar los resultados al hecho de que no en todos los episodios de bacteriemia se hizo ecocardiografía y que, en la mayoría de los casos, el diagnóstico de EI se basa en los hallazgos ecocardiográficos, se hicieron 2 tipos de análisis. En primer lugar, se hizo un análisis de sensibilidad en el que se repitieron los modelos solo en la población en la que se había realizado ecocardiografía. En segundo lugar, se ajustaron los distintos modelos predictivos mediante un sistema de modelos estructurales marginales30. En estos modelos, la contribución de cada episodio se ponderó por la inversa de su probabilidad de haberse realizado ecocardiografía condicionada a las variables del estudio. Adicionalmente, para evitar la gran variabilidad en las ponderaciones derivada de la alta correlación observada entre algunas variables y el haberse realizado ecocardiografía (tabla 1 del material adicional), se usaron ponderaciones estabilizadas31. Las ponderaciones estabilizadas se definen como el cociente entre la probabilidad bruta de haber hecho ecocardiografía dividida por la probabilidad de haberla hecho condicionada a las variables del estudio (P[Eco]/P[Eco/variables del estudio]) para los episodios en los que se hizo ecocardiografía y 1-P[Eco]/1-P[Eco/variables del estudio] para los episodios en los que no se hizo. Las probabilidades se estimaron mediante regresión logística en la que se usaron todas las variables consideradas en el estudio. El valor crítico se estableció en p <0,05 siempre en pruebas de 2 colas. El análisis estadístico se calculó con el programa estadístico Stata 16.1 (Station College, Estados Unidos).
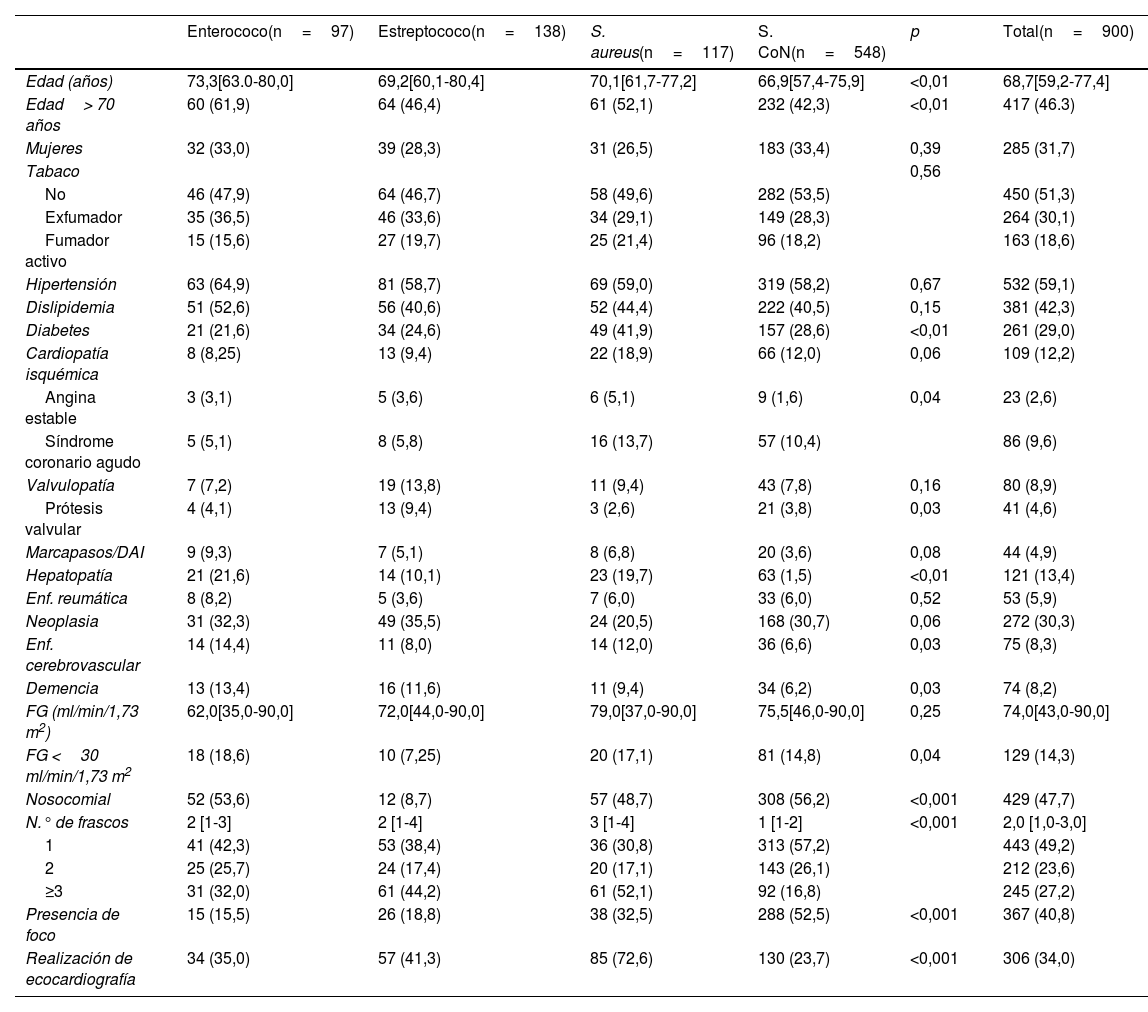
ResultadosCaracterísticas de la poblaciónSe incluyeron un total de 900 casos de hemocultivos positivos en 873 pacientes. Durante el periodo de estudio, 26 pacientes tuvieron 2 episodios de bacteriemia y un paciente tuvo 3. Los microorganismos más aislados fueron los S. CoN (548 casos; 60,9%), seguido de los Streptococcus spp. (138 casos; 15,3%), S. aureus (117 casos; 13,0%) y los Enterococcus spp. (97 casos; 10,8%). En la tabla 1 se resumen, según el microorganismo aislado, las principales características de la población total y por grupos. La mediana de edad fue de 69 años y 2 tercios de los pacientes fueron varones. No hubo diferencias entre grupos para el sexo. Se encontraron diferencias significativas entre grupos para la edad (mayor para Enterococcus spp.), diabetes mellitus y cardiopatía isquémica (más frecuentes en el S. aureus), prótesis valvulares cardiacas (más frecuentes en Streptococcus spp.), antecedentes de hepatopatía (más frecuente para Enterococcus spp. y S. aureus) y antecedentes de enfermedad cerebrovascular, demencia y disfunción renal avanzada (más frecuente en Enterococcus spp.). La adquisición se consideró nosocomial en casi la mitad de los casos (47,7%) y fue más frecuente en el caso de los S. CoN (56,2%) y menos frecuente para Streptococcus spp. (8,7%).
Características de la población total y por grupos según el microorganismo aislado
| Enterococo(n=97) | Estreptococo(n=138) | S. aureus(n=117) | S. CoN(n=548) | p | Total(n=900) | |
|---|---|---|---|---|---|---|
| Edad (años) | 73,3[63.0-80,0] | 69,2[60,1-80,4] | 70,1[61,7-77,2] | 66,9[57,4-75,9] | <0,01 | 68,7[59,2-77,4] |
| Edad> 70 años | 60 (61,9) | 64 (46,4) | 61 (52,1) | 232 (42,3) | <0,01 | 417 (46.3) |
| Mujeres | 32 (33,0) | 39 (28,3) | 31 (26,5) | 183 (33,4) | 0,39 | 285 (31,7) |
| Tabaco | 0,56 | |||||
| No | 46 (47,9) | 64 (46,7) | 58 (49,6) | 282 (53,5) | 450 (51,3) | |
| Exfumador | 35 (36,5) | 46 (33,6) | 34 (29,1) | 149 (28,3) | 264 (30,1) | |
| Fumador activo | 15 (15,6) | 27 (19,7) | 25 (21,4) | 96 (18,2) | 163 (18,6) | |
| Hipertensión | 63 (64,9) | 81 (58,7) | 69 (59,0) | 319 (58,2) | 0,67 | 532 (59,1) |
| Dislipidemia | 51 (52,6) | 56 (40,6) | 52 (44,4) | 222 (40,5) | 0,15 | 381 (42,3) |
| Diabetes | 21 (21,6) | 34 (24,6) | 49 (41,9) | 157 (28,6) | <0,01 | 261 (29,0) |
| Cardiopatía isquémica | 8 (8,25) | 13 (9,4) | 22 (18,9) | 66 (12,0) | 0,06 | 109 (12,2) |
| Angina estable | 3 (3,1) | 5 (3,6) | 6 (5,1) | 9 (1,6) | 0,04 | 23 (2,6) |
| Síndrome coronario agudo | 5 (5,1) | 8 (5,8) | 16 (13,7) | 57 (10,4) | 86 (9,6) | |
| Valvulopatía | 7 (7,2) | 19 (13,8) | 11 (9,4) | 43 (7,8) | 0,16 | 80 (8,9) |
| Prótesis valvular | 4 (4,1) | 13 (9,4) | 3 (2,6) | 21 (3,8) | 0,03 | 41 (4,6) |
| Marcapasos/DAI | 9 (9,3) | 7 (5,1) | 8 (6,8) | 20 (3,6) | 0,08 | 44 (4,9) |
| Hepatopatía | 21 (21,6) | 14 (10,1) | 23 (19,7) | 63 (1,5) | <0,01 | 121 (13,4) |
| Enf. reumática | 8 (8,2) | 5 (3,6) | 7 (6,0) | 33 (6,0) | 0,52 | 53 (5,9) |
| Neoplasia | 31 (32,3) | 49 (35,5) | 24 (20,5) | 168 (30,7) | 0,06 | 272 (30,3) |
| Enf. cerebrovascular | 14 (14,4) | 11 (8,0) | 14 (12,0) | 36 (6,6) | 0,03 | 75 (8,3) |
| Demencia | 13 (13,4) | 16 (11,6) | 11 (9,4) | 34 (6,2) | 0,03 | 74 (8,2) |
| FG (ml/min/1,73 m2) | 62,0[35,0-90,0] | 72,0[44,0-90,0] | 79,0[37,0-90,0] | 75,5[46,0-90,0] | 0,25 | 74,0[43,0-90,0] |
| FG <30 ml/min/1,73 m2 | 18 (18,6) | 10 (7,25) | 20 (17,1) | 81 (14,8) | 0,04 | 129 (14,3) |
| Nosocomial | 52 (53,6) | 12 (8,7) | 57 (48,7) | 308 (56,2) | <0,001 | 429 (47,7) |
| N.° de frascos | 2 [1-3] | 2 [1-4] | 3 [1-4] | 1 [1-2] | <0,001 | 2,0 [1,0-3,0] |
| 1 | 41 (42,3) | 53 (38,4) | 36 (30,8) | 313 (57,2) | 443 (49,2) | |
| 2 | 25 (25,7) | 24 (17,4) | 20 (17,1) | 143 (26,1) | 212 (23,6) | |
| ≥3 | 31 (32,0) | 61 (44,2) | 61 (52,1) | 92 (16,8) | 245 (27,2) | |
| Presencia de foco | 15 (15,5) | 26 (18,8) | 38 (32,5) | 288 (52,5) | <0,001 | 367 (40,8) |
| Realización de ecocardiografía | 34 (35,0) | 57 (41,3) | 85 (72,6) | 130 (23,7) | <0,001 | 306 (34,0) |
Las variables continuas se resumen como mediana [rango intercuartílico]; las variables categóricas se resumen como número (porcentaje). La comparación entre grupos se ha realizado con el test de Kruskal-Wallis para variables cuantitativas y con el test de χ2 para variables categóricas.
DAI: desfibrilador automático implantable; Enf.: enfermedad; FG: filtrado glomerular; S.: Staphylococcus.
En un tercio de los casos se hizo ecocardiograma transtorácico, que se siguió de ecocardiografía transesofágica en 65 casos (7,2% del total de los episodios de bacteriemia). La exploración ecocardiográfica fue más frecuente en el caso de bacteriemia por S. aureus (72,6% de los casos) y menos frecuente tras el aislamiento de S. CoN (23,7%). S. aureus fue el aislamiento en el que con más frecuencia fueron positivos 3 o más frascos (52,1% de los casos) y los S. CoN en los que menos (16,8%; p<0,001). Los aislamientos fueron sospechosos de contaminación en 156 casos (17,3% del total de los episodios), de los que 155 correspondieron a S. CoN (el 28,3% de los aislamientos por este tipo de microorganismos) y uno a S. aureus.
En menos de la mitad de los casos (40,8%) se localizó el origen de la bacteriemia, que fue particularmente baja en el caso de los Streptococcus spp. (8,8%). Aparte de la posible contaminación, los focos más frecuentes fueron el respiratorio (18,3%), catéter o dispositivos intracardiacos (incluidas prótesis valvulares) (12,0%), abdominal (9,5%), piel y partes blandas (9,3%) y urinario (5,7%). La piel/partes blandas y los dispositivos intracardiacos fueron los focos más frecuentes para S. aureus (el 63,2% de los casos para este germen), el abdominal y urinario (73,3%) para los Enterococcus spp. y el respiratorio y piel/partes blandas (69,2%) para los Streptococcus spp.
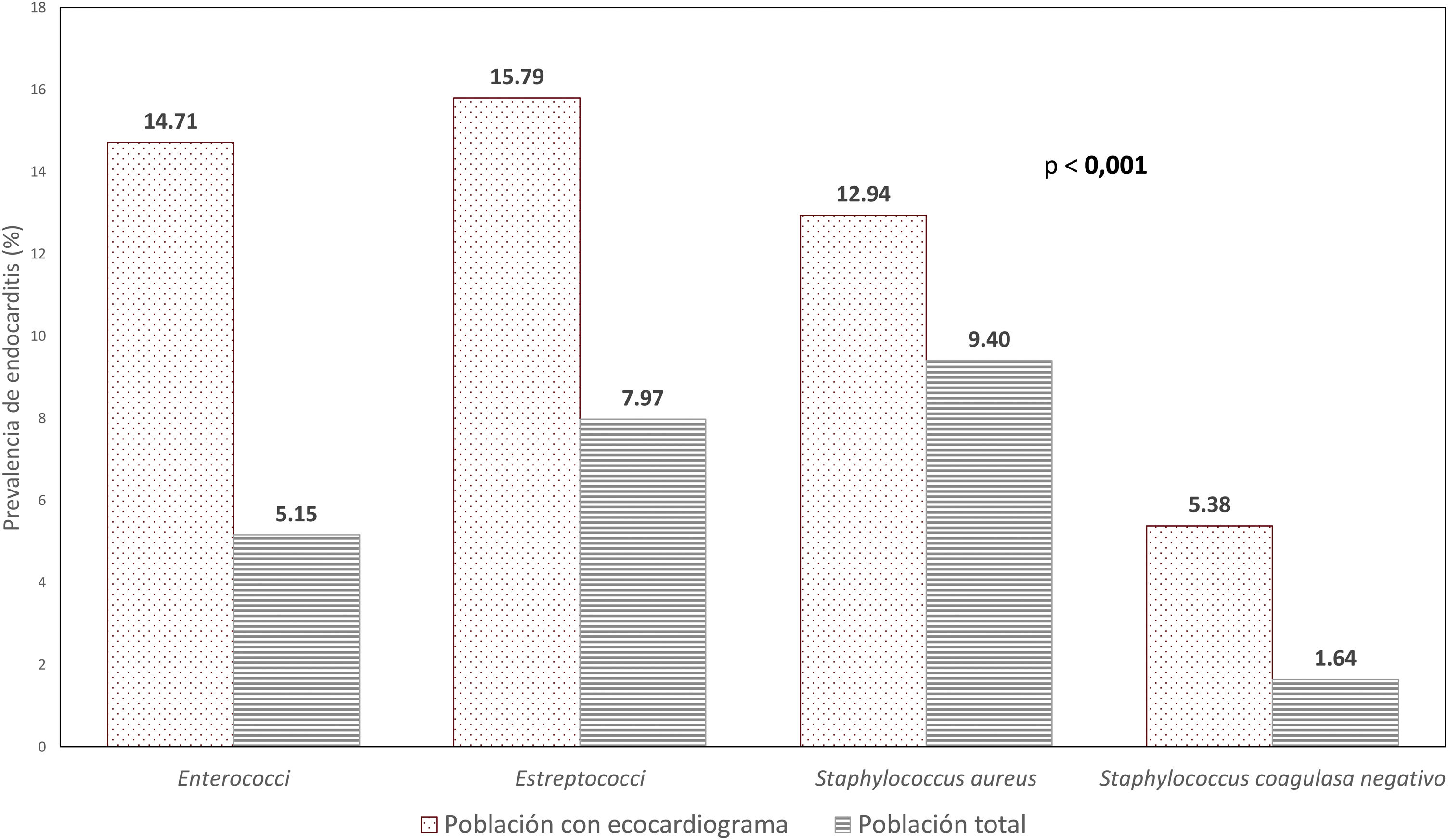
Prevalencia de endocarditis infecciosaSe diagnosticaron 36 casos de EI (4,0%). La EI se diagnosticó durante el primer episodio de bacteriemia en 34 casos y en un segundo episodio en 2 casos. El tiempo promedio (mediana) hasta el diagnóstico fue de 5,0 días (RIC=1,5-12 días). Para un seguimiento acumulado de 1.273,9 hemocultivos-año, la incidencia fue de 2,8×100 hemocultivos-año. La EI se diagnosticó por ecocardiografía en 32 casos (88,9%), mediante la anatomía patológica de la válvula nativa tras cirugía por insuficiencia valvular aguda en un caso y por técnicas nucleares, también con material valvular obtenido en la cirugía, en 3 casos. La mayor prevalencia de EI se produjo para S. aureus (9,40%), seguido de Streptococcus spp. (7,97%), Enterococcus spp. (5,15%) y S. CoN (1,64%) (p<0,0001). Limitando el análisis a los pacientes a quienes se les hizo ecocardiografía, la prevalencia global fue del 10,5%, con la mayor prevalencia de EI para el Streptococcus spp., seguido de Enterococcus spp. y S. aureus (fig. 1).
Prevalencia de endocarditis infecciosa en la población total y en la población en la que se realizó ecocardiografía según el microorganismo. Se expresan porcentajes sobre la población total (barra rayada; n=900) y sobre la población en la que se realizó ecocardiograma (barra con puntos; n=306).
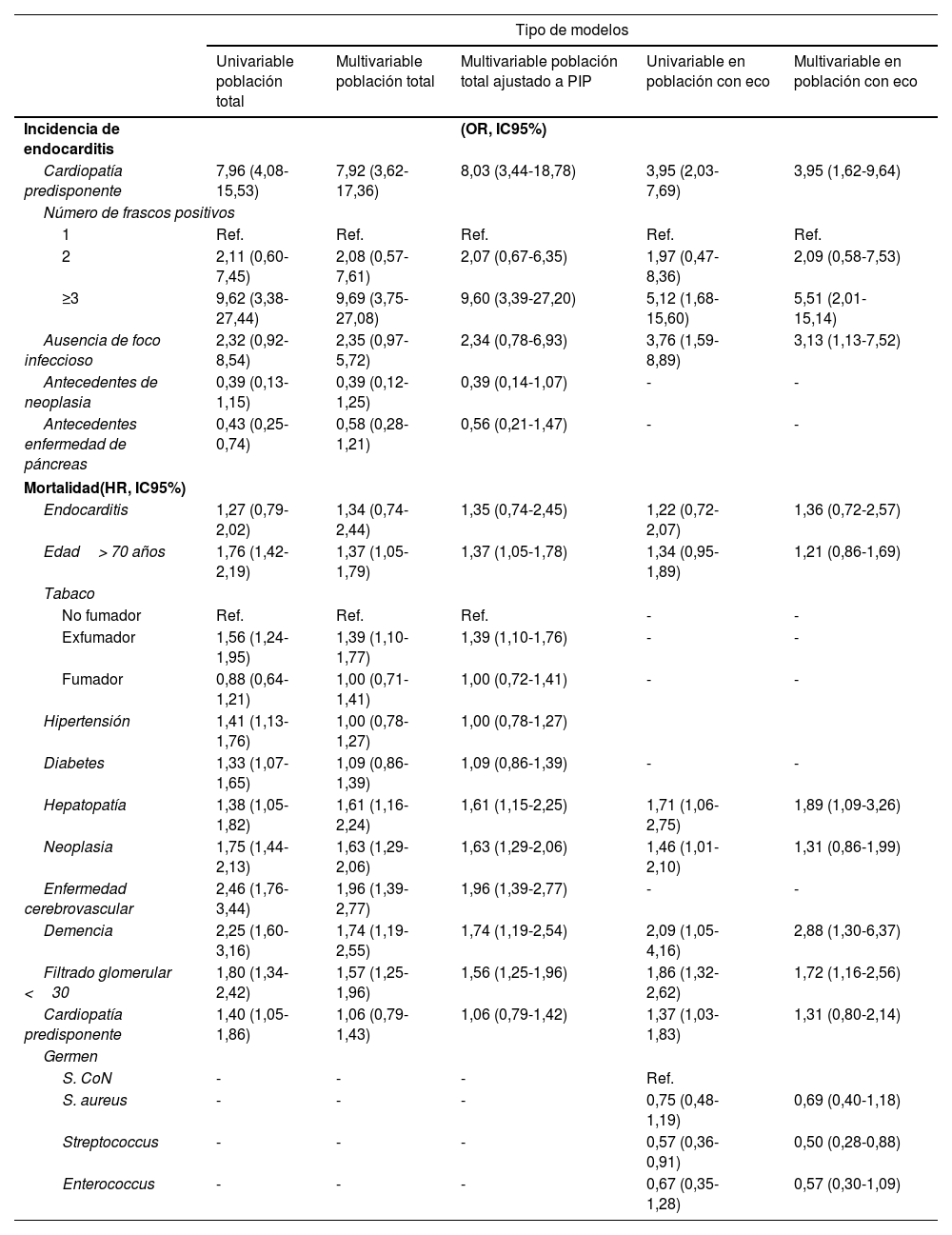
Para la determinación de los factores de riesgo de EI, debido al bajo número de eventos registrados y para evitar colinealidad, se construyó una nueva variable para analizar de forma conjunta los antecedentes de valvulopatía cardiaca, con o sin prótesis valvular, y los dispositivos electrónicos intracardiacos (que incluían marcapasos, desfibrilador y resincronizador). Los resultados de los distintos modelos utilizados se resumen en la tabla 2. En la tabla 2 del material adicional se resume el análisis uni- y multivariable de factores asociados a la incidencia de EI. La cardiopatía predisponente, el número de frascos con aislamiento positivo y los antecedentes de enfermedad pancreática se asociaron positivamente a la incidencia de EI. Mostraron tendencias no significativas a la asociación con EI tanto la ausencia de foco infeccioso evidente (positiva) como el diagnóstico previo de neoplasia (negativa). En el análisis ajustado, mantuvieron la significación la presencia de cardiopatía predisponente y el número de frascos con aislamiento positivo, pero no el antecedente de enfermedad pancreática o la ausencia de foco infeccioso. El antecedente neoplásico solo mostró una tendencia no significativa como factor protector. La mitad de las EI se produjeron en pacientes con cardiopatía predisponente y el 72% tuvieron 3 o más frascos con aislamiento positivo. Los resultados no cambiaron sustancialmente en el modelo multivariable ajustado a la ponderación con la probabilidad inversa de hacer ecocardiografía.
Análisis de la asociación entre los posibles factores predisponentes de endocarditis infecciosa evaluados y la incidencia de endocarditis en la población total y en la población en la que se realizó ecocardiografía
| Tipo de modelos | |||||
|---|---|---|---|---|---|
| Univariable población total | Multivariable población total | Multivariable población total ajustado a PIP | Univariable en población con eco | Multivariable en población con eco | |
| Incidencia de endocarditis | (OR, IC95%) | ||||
| Cardiopatía predisponente | 7,96 (4,08-15,53) | 7,92 (3,62-17,36) | 8,03 (3,44-18,78) | 3,95 (2,03-7,69) | 3,95 (1,62-9,64) |
| Número de frascos positivos | |||||
| 1 | Ref. | Ref. | Ref. | Ref. | Ref. |
| 2 | 2,11 (0,60-7,45) | 2,08 (0,57-7,61) | 2,07 (0,67-6,35) | 1,97 (0,47-8,36) | 2,09 (0,58-7,53) |
| ≥3 | 9,62 (3,38-27,44) | 9,69 (3,75-27,08) | 9,60 (3,39-27,20) | 5,12 (1,68-15,60) | 5,51 (2,01-15,14) |
| Ausencia de foco infeccioso | 2,32 (0,92-8,54) | 2,35 (0,97-5,72) | 2,34 (0,78-6,93) | 3,76 (1,59-8,89) | 3,13 (1,13-7,52) |
| Antecedentes de neoplasia | 0,39 (0,13-1,15) | 0,39 (0,12-1,25) | 0,39 (0,14-1,07) | - | - |
| Antecedentes enfermedad de páncreas | 0,43 (0,25-0,74) | 0,58 (0,28-1,21) | 0,56 (0,21-1,47) | - | - |
| Mortalidad(HR, IC95%) | |||||
| Endocarditis | 1,27 (0,79-2,02) | 1,34 (0,74-2,44) | 1,35 (0,74-2,45) | 1,22 (0,72-2,07) | 1,36 (0,72-2,57) |
| Edad> 70 años | 1,76 (1,42-2,19) | 1,37 (1,05-1,79) | 1,37 (1,05-1,78) | 1,34 (0,95-1,89) | 1,21 (0,86-1,69) |
| Tabaco | |||||
| No fumador | Ref. | Ref. | Ref. | - | - |
| Exfumador | 1,56 (1,24-1,95) | 1,39 (1,10-1,77) | 1,39 (1,10-1,76) | - | - |
| Fumador | 0,88 (0,64-1,21) | 1,00 (0,71-1,41) | 1,00 (0,72-1,41) | - | - |
| Hipertensión | 1,41 (1,13-1,76) | 1,00 (0,78-1,27) | 1,00 (0,78-1,27) | ||
| Diabetes | 1,33 (1,07-1,65) | 1,09 (0,86-1,39) | 1,09 (0,86-1,39) | - | - |
| Hepatopatía | 1,38 (1,05-1,82) | 1,61 (1,16-2,24) | 1,61 (1,15-2,25) | 1,71 (1,06-2,75) | 1,89 (1,09-3,26) |
| Neoplasia | 1,75 (1,44-2,13) | 1,63 (1,29-2,06) | 1,63 (1,29-2,06) | 1,46 (1,01-2,10) | 1,31 (0,86-1,99) |
| Enfermedad cerebrovascular | 2,46 (1,76-3,44) | 1,96 (1,39-2,77) | 1,96 (1,39-2,77) | - | - |
| Demencia | 2,25 (1,60-3,16) | 1,74 (1,19-2,55) | 1,74 (1,19-2,54) | 2,09 (1,05-4,16) | 2,88 (1,30-6,37) |
| Filtrado glomerular <30 | 1,80 (1,34-2,42) | 1,57 (1,25-1,96) | 1,56 (1,25-1,96) | 1,86 (1,32-2,62) | 1,72 (1,16-2,56) |
| Cardiopatía predisponente | 1,40 (1,05-1,86) | 1,06 (0,79-1,43) | 1,06 (0,79-1,42) | 1,37 (1,03-1,83) | 1,31 (0,80-2,14) |
| Germen | |||||
| S. CoN | - | - | - | Ref. | |
| S. aureus | - | - | - | 0,75 (0,48-1,19) | 0,69 (0,40-1,18) |
| Streptococcus | - | - | - | 0,57 (0,36-0,91) | 0,50 (0,28-0,88) |
| Enterococcus | - | - | - | 0,67 (0,35-1,28) | 0,57 (0,30-1,09) |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; OR: odds ratio; PIP: ponderación por la probabilidad inversa de realización de ecocardiograma; Ref.: referencia.
Los resultados en la población en la que se realizó ecocardiografía se resumen en la tabla 3 del material adicional. No se encontraron variaciones sustanciales, a excepción de los antecedentes de neoplasia, que perdió su significación estadística y la ausencia de foco aparente de la bacteriemia, que se asoció a EI de manera muy significativa (tabla 2).
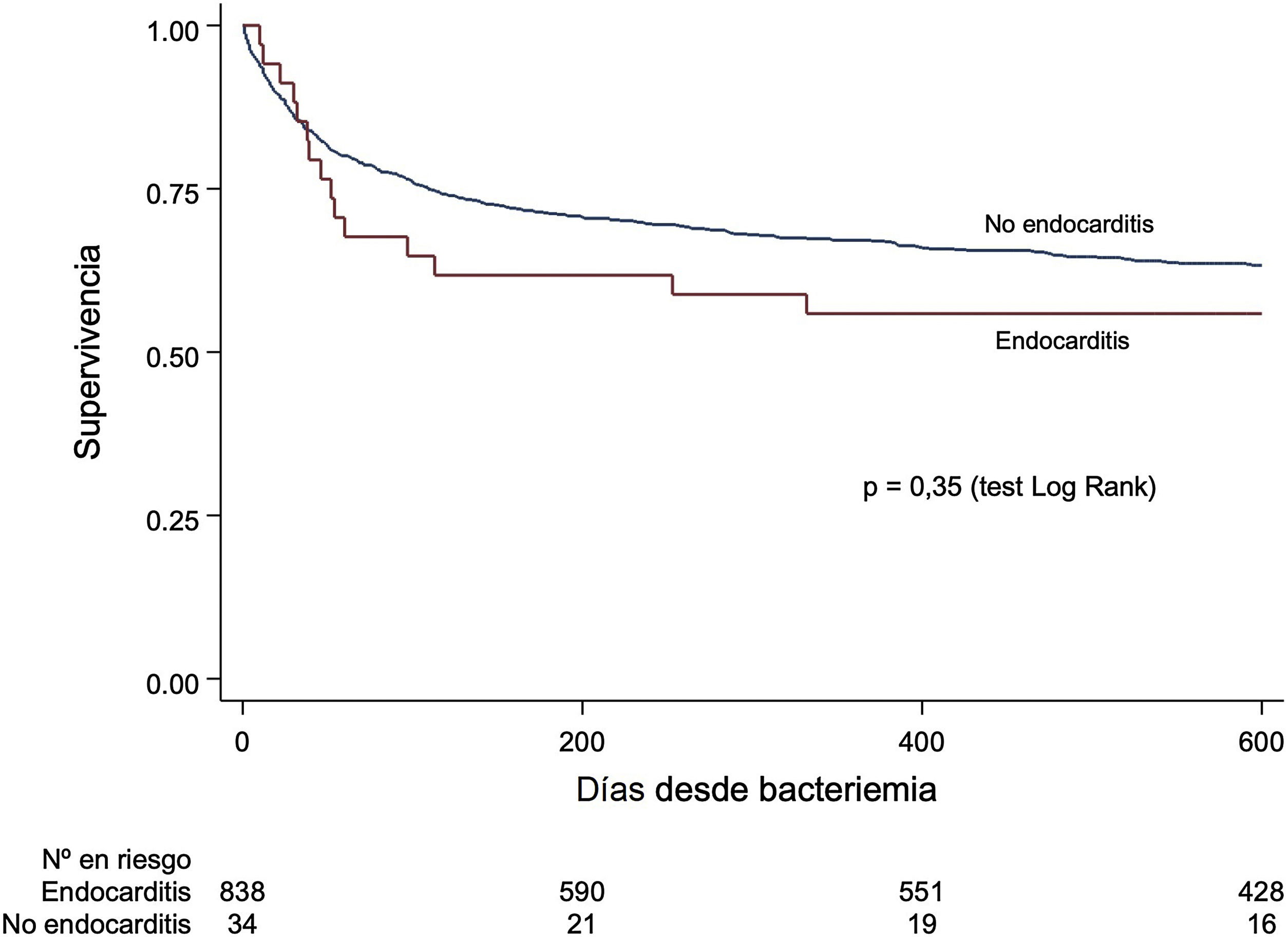
PronósticoEn 873 pacientes, con un tiempo de seguimiento (mediana) de 605 días (RIC=101-78), se produjeron 349 muertes (40,0%). Fallecieron 17 pacientes con EI (47,2%) y 342 pacientes sin EI (39,6%; p=0,36). Los análisis uni- y multivariable de las variables asociadas a mortalidad se resumen en la tabla 4 del material adicional para la población total y en la tabla 5 del material adicional para la población en la que se realizó ecocardiografía. La incidencia de EI no se asoció a la mortalidad (HR=1,26; IC 95%: 0,77-2,09; p=0,36) (fig. 2) y los hallazgos no cambiaron ni en el modelo ajustado ni en el ajuste por la ponderación de la probabilidad inversa de realización de ecocardiograma. En la población en la que se realizó ecocardiografía hubo 126 muertes (41,9%) y tampoco se detectó asociación significativa entre el diagnóstico de EI y la mortalidad (tabla 2). En el análisis ajustado, la mortalidad se relacionó de forma significativa con la edad avanzada, ser exfumador y los antecedentes de neoplasia, hepatopatía, enfermedad cerebrovascular, demencia y disfunción renal avanzada. No hubo diferencias significativas entre los distintos microorganismos, aunque se apreció una tendencia a mayor mortalidad con respecto a los S. CoN para S. aureus (p=0,08) y Enterococcus spp. (p=0,06). Para los pacientes no diagnosticados de EI, no se detectaron diferencias entre aquellos a quienes no se les hizo ecocardiograma respecto a los que sí (HR=0,94; IC 95%: 0,75-1,18; p=0,61).
DiscusiónEn el presente estudio, con más de 800 pacientes consecutivos contemporáneos con 900 hemocultivos positivos para algún coco grampositivo considerado habitualmente asociado a EI, los principales hallazgos fueron: 1) la prevalencia global de EI fue del 4% (incidencia de 2,8×100 hemocultivos-año); 2) se diagnosticó EI en uno de cada 11 hemocultivos positivos para S. aureus, en uno de cada 12 para Streptococcus spp., en uno de cada 19 para Enterococcus spp. y en uno de cada 61 para S. CoN; 3) el riesgo de EI se asoció a la presencia de una cardiopatía predisponente o dispositivo intracardiaco, la positividad en 3 o más frascos de cultivo y, marginalmente, a la ausencia de un foco evidente.
La prevalencia de EI en pacientes con bacteriemia es muy variable en los estudios publicados, dependiente fundamentalmente del microorganismo, del tipo de estudio (ámbito poblacional frente a hospitalario, prospectivo frente a retrospectivo), que condiciona, a su vez, la tasa de realización de ecocardiografía y las características de la población. En 2 estudios previos se analizó la prevalencia de EI para el grupo de microorganismos grampositivos usualmente asociados a EI analizado en nuestro estudio. Østergaard et al.11 encontraron una prevalencia de EI del 4,9% en un total de 69.021 episodios de bacteriemia en un estudio de ámbito poblacional. Andersen et al.21, en un estudio de 585 casos de ámbito hospitalario, indicaron una prevalencia global del 16%. Nuestra prevalencia global fue del 4,0%, algo inferior a la de Østergaard et al.11 y muy inferior a la comunicada por Andersen et al.21. Nuestra inferior prevalencia respecto a ambos estudios se puede deber a varios factores: 1) el mayor número de bacteriemias por S. CoN en nuestra serie (60,9%, respecto al 11,1% del estudio de Andersen y 49,0% en el de Østergaard), microorganismo que menos frecuentemente se complica con EI; 2) el porcentaje de realización de ecocardiograma (34% en nuestro estudio, 71% en el estudio de Andersen), que favorece el aumento de diagnósticos falsos negativos y 3) diferencias en las características de la población, como el porcentaje de pacientes con neoplasia (30,3% en nuestro estudio; 28,3% en el de Østergaard y 4,1% en el de Andersen). Respecto a la prevalencia para cada microorganismo, las publicadas son muy variables, oscilan del 5,9-31,9% para S. aureus, del 4,3-26,1% para el Enterococcus spp., del 7,1-10,6% para el Streptococcus spp. y del 1,6-14,8% para los distintos S. CoN, datos similares a nuestros resultados.
Es importante establecer los factores asociados a la presencia de EI en pacientes con bacteriemia, tanto para no demorar el diagnóstico como para evitar la futilidad diagnóstica. Así, se han propuesto diferentes escalas de puntuación para S. aureus16,23,26, Enterococcus spp.19 y Streptococcus spp.28, con rendimientos diagnósticos comparativos muy diversos24,25 y caracterizados por el alto valor predictivo negativo y el limitado valor predictivo positivo. En nuestro estudio se han encontrado factores de riesgo similares a los de otros estudios. El factor más fuertemente asociado a EI fue la existencia de una cardiopatía predisponente, que se puede considerar un hallazgo universal13-19,21,23,26,28,32. El número de frascos positivos13,15,18,21,28,32 o la ausencia de un foco infeccioso evidente13,18 son 2 parámetros que nuestro estudio comparte con otros. La menor prevalencia de EI en los pacientes con cáncer es un hallazgo ya descrito en el estudio de Andersen et al.21. Grillo et al.32 confirmaron este hallazgo en un estudio multicéntrico muy reciente diseñado para los casos de bacteriemia por S. aureus. Se atribuyó esta menor prevalencia de EI en pacientes con neoplasia a características demográficas (suelen ser más jóvenes y, por tanto, con menor prevalencia de cardiopatía predisponente o dispositivos intracardiacos), o a la más alta incidencia de bacteriemia relacionada con catéter o procedimientos diagnósticos y terapéuticos, que se relacionan con bacteriemias menos persistentes.
La EI es una enfermedad que todavía conlleva una alta letalidad9. La mayoría de los estudios12, aunque no todos7, destinados a valorar la repercusión de la incidencia de EI en pacientes con bacteriemia, al menos para S. aureus12, han encontrado una mortalidad significativamente mayor en los pacientes con EI. Nosotros observamos una tendencia similar, aunque sin significación estadística. La elevada mortalidad asociada a comorbilidades graves en nuestra serie (neoplasia, hepatopatía, disfunción renal avanzada) puede diluir el efecto de la incidencia de EI. Otros factores que han podido influir es la rapidez en el diagnóstico de EI desde que se conoce el resultado del hemocultivo, cuya mediana en nuestro estudio fue de solo 5 días, o el limitado número de S. aureus en nuestra serie, microorganismo que conlleva un peor pronóstico9.
Limitaciones del estudioEl diseño retrospectivo conlleva un riesgo alto de sesgos que muy a menudo son de difícil manejo y que limitan las conclusiones del estudio. La inclusión de una serie de casos consecutivos, con criterios de exclusión muy limitados, procedentes de un laboratorio centralizado único para toda la región, ayuda a disminuir los sesgos de selección. El diagnóstico de EI descansó en los criterios de Duke. Para disminuir los falsos positivos, solo se consideraron casos de EI aquellos en los que el diagnóstico se estableció como definitivo y se excluyeron los definidos como probables o posibles. Existe aún el riesgo de diagnósticos falsamente negativos si se considera que solo se realizó ecocardiografía en un tercio de los pacientes. Este riesgo está disminuido, ya que se tuvo acceso a toda la información sanitaria de la población después del evento y que solo se incluyó a pacientes adscritos al correspondiente servicio de salud con historia clínica electrónica unificada, que incluyó información actualizada sobre el estado vital. Adicionalmente, la confirmación de los resultados obtenidos mediante técnicas de ponderación estadística y en el análisis de sensibilidad, junto al similar pronóstico de los pacientes en los que no se realizó ecocardiografía respecto a los que sí se exploraron, aportaron consistencia a nuestros hallazgos.
Dado el estrecho margen de tiempo utilizado para la inclusión de los casos no fue posible analizar si existía alguna tendencia temporal en nuestros hallazgos. No se recogió información sobre las distintas especies de microorganismos dentro de cada grupo, lo cual puede repercutir en los resultados por las diferencias entre ellas en incidencia de EI y pronóstico15,20,27. No se puede descartar la presencia de riesgos competitivos, dadas las comorbilidades presentes en los pacientes incluidos en el estudio.
Por último, el limitado tamaño muestral, sobre todo cuando se trata de análisis de subgrupos, ha podido afectar a la potencia estadística de algunos test.
ConclusionesLa prevalencia de EI en pacientes con bacteriemia por cocos grampositivos es reducida pero no desdeñable. Dada la gravedad del diagnóstico, la identificación de factores predisponentes puede ayudar al diagnóstico, pero no sustituir el juicio clínico en cada caso.
- •
La bacteriemia es un evento mayoritariamente hospitalario que con frecuencia levanta sospechas de endocarditis infecciosa.
- •
La mayoría de los casos de endocarditis infecciosa en países desarrollados son causadas por Staphylococcusaureus, los Staphylococcus coagulasa-negativos, los Streptococcus spp. y los Enterococcus spp.
- •
Ante un aislamiento positivo para alguno de estos microorganismos, está justificado descartar la endocarditis infecciosa por las implicaciones del diagnóstico. Sin embargo, esto conlleva los inconvenientes del proceso diagnóstico y consumo de recursos.
- •
En una cohorte de pacientes con diagnóstico de bacteriemia por gérmenes usualmente productores de endocarditis, la prevalencia de endocarditis infecciosa fue reducida pero no desdeñable.
- •
Dada la gravedad del diagnóstico de endocarditis infecciosa, la identificación de factores predisponentes puede ayudar al diagnóstico, pero no sustituir el juicio clínico en cada caso.
- •
El número de frascos mayor de 3y el antecedente de una valvulopatía o de un dispositivo intracardiaco resultan factores predictores del diagnóstico de endocarditis infecciosa.
Ninguna.
Contribución de los autoresA. Teira Calderón ha concebido el estudio y su diseño, participado en la recolección de datos y participado en el análisis e interpretación de estos. J.A. Vázquez de Prada Tiffe y Francisco González Vilchez han concebido el estudio y su diseño y participado en el análisis e interpretación de los datos. R. Teira Cobo y J.M. de la Torre Hernández han participado en la interpretación de los datos. I. Santiago Setién, C. Abad Pérez, I. Cabrera Rubio, M. Lozano González, J. Zubiaur Zamacola, A. Margarida de Castro, A. de Malet Pintos-Fonseca y R. Pérez Barquín han participado en la recolección de datos. Todos los autores han participado en la lectura crítica del manuscrito, cuya versión final han aprobado, y asumen la responsabilidad sobre todos los aspectos del artículo, incluyendo la resolución de cualquier cuestión sobre su veracidad.
Conflicto de interesesLos autores del artículo declaran la ausencia de algún tipo de conflicto de interés.