Las enfermedades cardiovasculares constituyen la primera causa de muerte en los países desarrollados y suponen más de un tercio del gasto sanitario. El síndrome coronario agudo (SCA) suele ser una de las primeras manifestaciones. Existen importantes diferencias en el abordaje clínico tras un SCA entre centros y comunidades autónomas, así como en los criterios clínicos para aplicar las pautas de continuación del tratamiento antiagregante plaquetario doble (TAPD). A pesar de que el número de candidatos a prolongar el TAPD más allá de un año es elevado, datos recientes sugieren que únicamente se produce en alrededor de un tercio de los pacientes. En este contexto, homogeneizar los criterios del tratamiento y seguimiento podría contribuir a reducir las complicaciones isquémicas y hemorrágicas tras un SCA. Por ello, proponemos un flujo de manejo asistencial con criterio práctico en nuestros centros. Otro de los objetivos de este documento es sintetizar las pautas de las guías de práctica clínica sobre la estratificación del riesgo post-SCA y la optimización del TAPD, para lo que proponemos un algoritmo de toma de decisiones. En línea con la guía europea vigente sobre el abordaje y tratamiento del SCA, recomendamos valorar la prolongación en pacientes que toleran el TAPD durante el primer año y presentan un riesgo trombótico residual significativo (moderado o alto) sin riesgo hemorrágico elevado. Para valorar el riesgo hemorrágico, recomendamos la escala ARC-HBR, mientras que las escalas PRECISE-DAPT y DAPT pueden usarse para integrar el riesgo isquémico y hemorrágico al alta y al año tras SCA, respectivamente.
Cardiovascular diseases are the leading cause of death in developed countries and account for more than a third of their healthcare costs. Acute coronary syndrome (ACS) is frequently one of the first manifestations of cardiovascular disease. There are important differences in post-ACS clinical management between centres and autonomous communities in Spain, as well as the clinical criteria used for applying the continuation of dual antiplatelet treatment (DAPT). Although there is an elevated number of potential candidates for prolonging DAPT beyond 1 year, recent data suggest that it is only applied in around one third of patients. Therefore, homogenizing treatment and follow-up criteria could contribute to reducing hospital stay and in-hospital mortality associated with ACS. To help this purpose, we propose a protocol of patient care management with practical applicability in our centres. This document also has the objective of synthesizing the recommendations of the clinical practice guidelines on post-ACS risk stratification and optimization of DAPT, proposing an algorithm to guide decision making. In line with the latest European clinical practice guidelines on ACS, we advise considering DAPT prolongation in patients who tolerated the treatment during the first year and have a significant residual thrombotic risk (moderate or high) without high bleeding risk. To assess bleeding risk, we recommend using the ARC-HBR scale, while the PRECISE-DAPT and DAPT scales can be used to integrate ischemic and haemorrhagic risk at discharge and 1 year after ACS, respectively.
Las enfermedades cardiovasculares, en las que el síndrome coronario agudo (SCA) suele ser una de las primeras manifestaciones, constituyen la primera causa de muerte en países desarrollados y suponen más de un tercio de su gasto sanitario1. Pese a que los tratamientos hipolipemiantes y avances en las técnicas terapéuticas han conseguido descender las tasas de mortalidad en los últimos años, es necesario seguir avanzando en la mejora de la salud cardiovascular de nuestra población2,3. La incidencia de cardiopatía isquémica en España en el año 2019 era de 361,4/100.000 habitantes, más elevada en varones (463,4) que en mujeres (263,6). Dado que esta tasa se incrementa de forma significativa con la edad, se espera que continúe la tendencia creciente como consecuencia del envejecimiento poblacional, con el consiguiente incremento del gasto sanitario4.
En España, el Ministerio de Sanidad lanzó en 2022 la denominada «Estrategia de Salud Cardiovascular», con la participación de pacientes, profesionales sanitarios, gestores, investigadores y las comunidades autónomas5. Esta estrategia supone una continuación y extensión de la Estrategia de Cardiopatía Isquémica del Sistema Nacional de Salud iniciada en 20076. En lo relativo a la atención del SCA con elevación de ST (SCACEST), en España se han desarrollado redes asistenciales regionales para dar respuesta a estos casos en un plazo máximo de 2horas desde el inicio de los síntomas (angioplastia primaria), y de este modo reducir la mortalidad y morbilidad asociadas. Sin embargo, su implementación se ha desarrollado de manera desigual en las diferentes comunidades a pesar de su importancia. A diferencia del SCACEST, la atención a los pacientes con SCA sin elevación del segmento ST (SCASEST) no es tan dependiente del tiempo, salvo en los pacientes de muy alto riesgo.
Uno de los retos asistenciales actuales en la atención a los SCA es la mejora de la estratificación del riesgo y su tratamiento, donde el uso del tratamiento antiagregante plaquetario doble (TAPD) tiene un papel crucial, algo que sigue priorizando la guía de práctica clínica vigente7. La rehabilitación cardiaca está expresamente recomendada en estos pacientes debido a los beneficios funcionales, psicológicos y de mejora de morbimortalidad. Sin embargo, existe un déficit de unidades y de implementación de estos programas en muchas zonas de España.
Datos intra- y extrahospitalarios y otros indicadores de calidad asistencialEl informe RECALCAR8, promovido desde hace años por la Sociedad Española de Cardiología (SEC) en su apuesta por la calidad asistencial, pretende elaborar un diagnóstico de situación actualizado sobre la asistencia cardiológica en España, a través del desarrollo de propuestas de políticas de mejora de la calidad y eficiencia en la atención al paciente con cardiopatía en el Sistema Nacional de Salud. Este estudio tiene 2 grandes vertientes. Por una parte, gracias a la cesión del Ministerio de Sanidad de la base de datos de altas hospitalarias, se investiga la relación entre la estructura y los recursos de cada centro con los resultados de la atención al paciente con enfermedad cardiovascular. Por otra parte, el registro RECALCAR, mediante una encuesta dirigida a los responsables sanitarios, analiza los recursos, actividad y diversos indicadores de calidad de las unidades asistenciales de cardiología. Otro de los objetivos del proyecto es que ambas vertientes confluyan para lograr una mayor sinergia en la información disponible.
En el periodo 2007-2022 se han logrado reducciones estadísticamente significativas de la estancia hospitalaria y mortalidad intrahospitalaria del SCACEST y SCASEST, que probablemente se puedan reducir aún más con mejores prácticas de gestión clínica2. La evolución de estos indicadores en el SCACEST ha sido muy buena, con acortamiento de los tiempos de atención y mejoras muy notables de los resultados en salud. Sin embargo, sigue habiendo diferencias importantes entre centros y comunidades autónomas. Además, en RECALCAR no se ha analizado el uso del TAPD en el SCA.
Los indicadores básicos de calidad de la Sociedad Europea de Cardiología (ESC) para el SCA7,9 comprenden 7 ítems, que incluyen la evaluación de a) la organización del centro, b) la estrategia de reperfusión, c) la evaluación de riesgos intrahospitalarios, d) el tratamiento antitrombótico durante la hospitalización, e) los tratamientos al alta de prevención secundaria, f) la satisfacción del paciente y g) la mortalidad a 30 días ajustada por riesgo. Por lo tanto, la medición del TAPD influye en 2 de los indicadores básicos de calidad.
Recomendaciones de las guías sobre el tratamiento antiagregante plaquetario dobleEl TAPD hace referencia a la combinación de ácido acetilsalicílico y un inhibidor del receptor plaquetario de adenosina difosfato P2Y12 (clopidogrel10, prasugrel11, ticagrelor12 o cangrelor13), y es una de las opciones de tratamiento más intensamente investigadas en las últimas décadas en medicina cardiovascular. Este tratamiento tras el SCA o tras la intervención coronaria percutánea (ICP) ha demostrado disminuir la recurrencia de eventos cardiovasculares, aunque se asume un mayor riesgo hemorrágico14. La intensidad de la combinación elegida, así como su duración, deberá individualizarse siempre en cada paciente dependiendo del tipo de SCA, del riesgo de nuevo evento isquémico y del riesgo hemorrágico asociado al tratamiento15. Sin embargo, en general se recomienda que la duración del TAPD inicial sea de al menos un año16. Los algoritmos que permiten la elección del mejor tratamiento se discuten en los siguientes apartados, donde se analizan los riesgos y oportunidades, así como los diferentes protocolos prácticos de identificación y tratamiento.
La ESC ha publicado recientemente su última guía de práctica clínica sobre el SCA7 insistiendo en el papel fundamental del TAPD. La guía introduce varias novedades, como la recomendación de pautar doble antiagregación durante al menos 12 meses tras el SCA revascularizado mediante ICP o cirugía de revascularización coronaria. Se mantiene la recomendación del pretratamiento en el SCASEST como clase III (no dar de rutina) y sigue siendo IIb si no se va a hacer la coronariografía en <24h. Por otro lado, la recomendación de pretratamiento en el SCACEST baja su grado de recomendación de I a IIb (tabla 1 del material adicional). Sin embargo, se insiste en que el TAPD no debe suspenderse antes de los 30 días tras el SCA.
La guía también describe la posibilidad de intensificar el tratamiento antitrombótico y propone la combinación de ácido acetilsalicílico con rivaroxabán como alternativa a la prolongación del TAPD, especialmente en los pacientes polivasculares7. Esta recomendación es de clase IIa y IIb para pacientes de riesgo isquémico alto y moderado, respectivamente (en cualquier caso, sin alto riesgo hemorrágico). La recomendación de esta estrategia proviene del estudio COMPASS17, que demostró una reducción significativa del riesgo combinado de ictus, muerte cardiovascular e infarto agudo de miocardio, del 42% en ictus, del 22% en muerte por causa cardiovascular y del 18% en la mortalidad por cualquier causa, con un aumento esperable en las hemorragias mayores; sin embargo, las tasas de hemorragia fueron bajas y no se observó un aumento significativo en las hemorragias mortales e intracraneales. Sin embargo, es importante destacar que el rivaroxabán no está disponible en España a la dosis necesaria para prevención cardiovascular. Por lo tanto, aunque sea una alternativa según la guía, de momento no es una opción factible en nuestro país.
Datos del abordaje actual con tratamiento antiagregante plaquetario doble y seguimiento de las guíasLos datos disponibles sobre el cumplimiento de las guías ESC sobre el tratamiento antiagregante tras el SCA se centran en la guía del 20219 y previas, como las del 201718. A pesar de que criterios clave, como la adherencia a las guías y la reducción de la variabilidad en la práctica clínica, se consideran referentes de calidad asistencial, pocos estudios en la vida real han evaluado estos aspectos a gran escala. Un estudio estadounidense publicado en 2020, con más de 24.000 pacientes en seguimiento por un periodo de al menos 3 meses tras un infarto de miocardio, reveló que la adherencia a las guías de práctica clínica fue superior al 70%, superando a lo que se había visto en estudios previos19. Lo más relevante del estudio es que demostró que cuando la adherencia a las guías es superior, la morbimortalidad durante el seguimiento es significativamente menor, incluso durante un periodo de tan solo 3 meses19. Otro estudio de origen alemán publicado en 2020 destaca el significativo descenso en la prescripción de doble antiagregación y del resto de medicación dirigida a la prevención secundaria una vez superado el primer mes tras el infarto agudo de miocardio20. En España, destaca un estudio publicado en 2019 con más de 10.000 pacientes inscritos de 2010 a 2015 tras una intervención coronaria en el contexto de un SCA. La adherencia al TAPD durante 12 meses subió desde el 58% en 2010 al 73% en 2015, ya con una nueva guía y mayor evidencia científica apoyando dicho tratamiento a largo plazo21. A pesar de ello, estos estudios tienen la limitación de basarse en guías de práctica clínica que se han actualizado posteriormente.
Riesgo residual del paciente con síndrome coronario agudoEvidencia científica en la vida real: resultados en salud del paciente y costes del sistema sanitario asociados al tratamiento actualA pesar de que los resultados del ensayo clínico PEGASUS-TIMI 5422 motivaron la recomendación en las guías de práctica clínica de prolongar el TAPD en pacientes con antecedentes de SCA con alto riesgo isquémico y sin riesgo hemorrágico elevado9, la implementación de esta recomendación en la práctica clínica en la vida real ha sido muy deficiente. Tras el alta por un SCA, paradójicamente, a los pacientes de mayor riesgo trombótico habitualmente se los trata de forma más conservadora, probablemente por la percepción (no siempre real) de un mayor riesgo hemorrágico23. Además, entre los potenciales candidatos a prolongar el TAPD a partir de los 12 meses, únicamente alrededor de un 30-35% de los casos reciben esta estrategia en la práctica clínica habitual24. Este es un aspecto especialmente relevante, ya que el número de potenciales candidatos a prolongar el TAPD tras un SCA en nuestro medio es elevado25.
Varios estudios han sugerido que la reducción de eventos y la mejoría en calidad de vida de un tratamiento optimizado podría compensar el gasto económico asociado al uso de antiagregantes más potentes, como el ticagrelor26–28. Además, el tratamiento antiagregante plaquetario guiado por pruebas de función plaquetaria y análisis genómicos ha mostrado que puede ser coste-efectivo en algunos contextos específicos29–31. Se ha descrito que la carga de comorbilidad (habitualmente asociada a una mayor complejidad de la enfermedad coronaria) es uno de los principales condicionantes del coste económico asociado al SCA en pacientes de edad avanzada32.
Riesgo de no optimizar el tratamiento antiagregante plaquetario doble a largo plazo: margen de mejora y llamada a la acciónVarios estudios han mostrado el frágil equilibrio entre el riesgo trombótico y hemorrágico en los pacientes con SCA sometidos a ICP y la importancia de seleccionar a los pacientes en base a ambos perfiles de riesgo33. Se ha demostrado que infratratar a los pacientes con alto riesgo trombótico residual puede conllevar una mayor incidencia de reinfarto, nuevas revascularizaciones y mortalidad cardiovascular34. Sin embargo, prolongar la doble antiagregación en pacientes con alto riesgo hemorrágico puede incrementar de forma significativa la incidencia de complicaciones hemorrágicas durante el seguimiento35,36. Por estos motivos, optimizar el tratamiento antitrombótico mediante una protocolización más estricta, y la coordinación entre los distintos niveles asistenciales, podría contribuir a reducir la incidencia de eventos adversos en este contexto y a conseguir una utilización más racional de los recursos sanitarios.
Varios estudios han demostrado que prolongar el TAPD más allá de un año reduce la incidencia de eventos cardiovasculares en pacientes con riesgo trombótico residual, especialmente aquellos con antecedentes de diabetes mellitus, enfermedad arterial periférica, enfermedad coronaria multivaso, ICP repetidas y altos niveles de lipoproteína (a)34,35,37. Recientemente se han publicado los datos del registro internacional ALETHEIA38, donde se demuestra que, en los pacientes elegibles a prolongar el TAPD a los 12 meses de iniciar ticagrelor 60mg/12h, la incidencia de un evento isquémico (infarto agudo de miocardio, ictus o mortalidad global) es 3 veces superior que el riesgo de presentar un evento hemorrágico (intervalo de confianza del 95%, 3,33%; 2,73-4,04 frente a 0,96%; 0,69-1,33). Por lo tanto, el infratratamiento del perfil de paciente de alto riesgo isquémico puede suponer un incremento significativo en los costes asociados a reingresos hospitalarios, estancias prolongadas y costes asociados a ICP potencialmente evitables.
Descripción del paciente que se puede beneficiar del tratamiento a medio-largo plazoComo se ha expuesto anteriormente, el manejo antitrombótico del paciente con SCA supone un reto clínico que requiere una minuciosa valoración del equilibrio entre el riesgo trombótico y hemorrágico33. Los pacientes de alto riesgo isquémico son aquellos con enfermedad arterial periférica, enfermedad coronaria multivaso, diabetes mellitus, infarto recurrente, trombosis del stent o revascularización compleja (múltiples stents, ICP, bifurcaciones); mientras que los de alto riesgo hemorrágico incluyen a pacientes con neoplasia activa, anemia, hemorragias previas, anticoagulación oral o bajo peso. Sin embargo, ciertos factores que aumentan el riesgo de eventos isquémicos suelen comportar de forma inherente un aumento en el riesgo hemorrágico, como la insuficiencia renal (filtrado glomerular <60ml/min) o edad superior a 65 años, por lo que la predicción selectiva de ambos riesgos es compleja. A pesar de ello, algunos factores están mucho más vinculados al riesgo trombótico residual, como la complejidad de la anatomía coronaria, el resultado angiográfico tras la revascularización, los antecedentes de trombosis del stent y factores de riesgo cardiovascular, como la diabetes mellitus o la enfermedad arterial periférica. El estudio que sentó la indicación de prolongar la doble antiagregación con ticagrelor tras un SCA, el ensayo PEGASUS TIMI 5422, incluyó a pacientes que habían sufrido un infarto de miocardio 1-3 años antes, de edad >50 años y que presentasen alguno de los siguientes criterios de forma adicional: edad >65 años, diabetes mellitus tratada, un segundo infarto de miocardio, enfermedad coronaria multivaso o insuficiencia renal. Se excluyó a aquellos pacientes con indicación de anticoagulación, antecedentes de sangrado, ictus o circunstancias que incrementasen el riesgo hemorrágico. Algunas variables asociadas de forma muy potente con el riesgo hemorrágico son la anemia, los antecedentes de sangrado, el bajo peso y la presencia de neoplasias activas.
Según las recomendaciones de la guía ESC39, cabe considerar la prolongación del TAPD en aquellos pacientes que, habiendo tolerado correctamente el tratamiento durante el primer año, presentan un riesgo trombótico residual significativo sin un riesgo hemorrágico elevado ni indicación de anticoagulación oral concomitante. Debería considerarse especialmente en aquellos pacientes con enfermedad coronaria compleja (ateromatosis difusa, con afectación multivaso o de tronco común), pacientes con múltiples revascularizaciones y antecedentes de trombosis del stent, así como pacientes con diabetes mellitus, arteriopatía periférica y episodios de SCA repetidos39. La edad por sí sola no debería contraindicar unas pautas de doble antiagregación prolongadas, especialmente en casos de alto riesgo trombótico residual sin un riesgo hemorrágico elevado. Por otro lado, en pacientes con factores como la anemia, hemorragias previas o neoplasias activas con riesgo de sangrado se justificaría un manejo antiagregante más conservador. También según las recomendaciones de las guías39, la prolongación de la doble antiagregación se puede hacer con cualquier inhibidor P2Y12. No obstante, el estudio DAPT40, realizado con clopidogrel y prasugrel, generó dudas al respecto en base a la mortalidad no cardiovascular, por lo que la evidencia para prolongar el TAPD se centra fundamentalmente en los resultados del estudio PEGASUS con ticagrelor 60mg22.
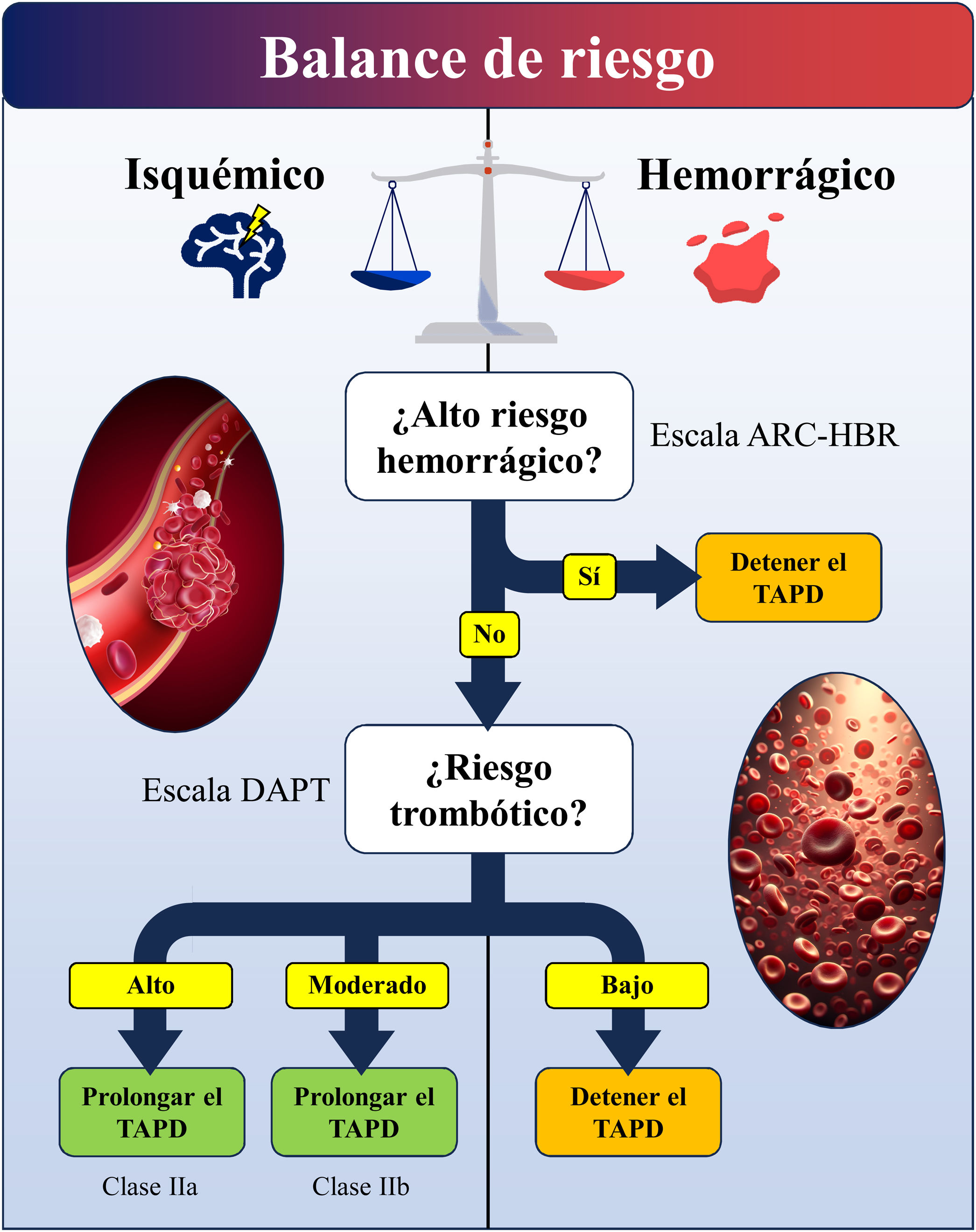
Protocolo práctico de manejo a medio y largo plazo con tratamiento antiagregante plaquetario doble y seguimiento asistencialProcedimiento para valorar la prolongación de la doble antiagregación a los 12 meses basado en el riesgo isquémico y de sangradoLa guía ESC 2023 sobre SCA7 recomienda el TAPD prolongado más allá de los 12 meses desde el SCA en aquellos pacientes considerados al menos de riesgo trombótico moderado, sin un riesgo de sangrado mayor incrementado o que comprometa la vida y que hayan tolerado la doble antiagregación sin complicación de sangrado a los 12 meses. Esta recomendación es de clase IIa cuando el riesgo trombótico es alto, y de clase IIb si el riesgo trombótico es moderado (tabla 1 del material adicional). Basándonos en estas recomendaciones, proponemos el algoritmo que se muestra en la figura 1.41,42
Algoritmo de decisión sobre la prolongación del TAPD a los 12 meses en función del balance de riesgo isquémico/trombótico. Recomendamos usar primero la escala ARC-HBR41 para evaluar el riesgo hemorrágico, como se muestra en la tabla 1, y después la escala DAPT42 para evaluar el riesgo trombótico, como se muestra en la figura 2. ARC-HBR: Academic Research Consortium for High Bleeding Risk; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
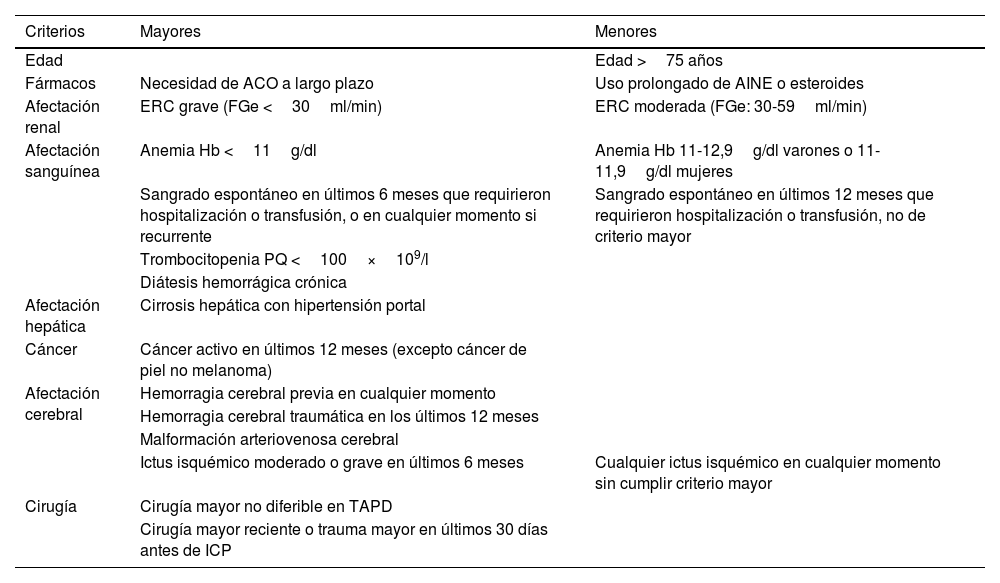
Como primer paso, recomendamos descartar que el paciente cumpla criterios de alto riesgo de sangrado (tabla 1). La identificación del riesgo de sangrado a corto plazo en pacientes con SCA tratados con angioplastia coronaria se realiza con las escalas CRUSADE (valoración del riesgo hemorrágico durante la hospitalización)43 o ACUITY44 (valoración del riesgo hemorrágico en los primeros 30 días tras SCA). Sin embargo, estas escalas no se han evaluado en pacientes tratados únicamente con tratamiento médico ni en aquellos que tienen además indicación de anticoagulación. Para valorar el riesgo hemorrágico, planteamos como alternativa la valoración de la Academic Research Consortium for High Bleeding Risk (ARC-HBR)41. Esta definición de consenso de pacientes con alto riesgo de hemorragia se desarrolló para proporcionar consistencia a los ensayos clínicos que evalúan la seguridad y efectividad de dispositivos y fármacos para pacientes sometidos a angioplastia coronaria. La evaluación ARC-HBR representa un enfoque pragmático que incluye los ensayos más recientes realizados en pacientes con alto riesgo de hemorragia, que fueron previamente excluidos de ensayos clínicos para evaluar la duración del TAPD o su intensidad.
Criterios mayores y menores para valorar alto riesgo de sangrado según el Academic Research Consortium
| Criterios | Mayores | Menores |
|---|---|---|
| Edad | Edad >75 años | |
| Fármacos | Necesidad de ACO a largo plazo | Uso prolongado de AINE o esteroides |
| Afectación renal | ERC grave (FGe <30ml/min) | ERC moderada (FGe: 30-59ml/min) |
| Afectación sanguínea | Anemia Hb <11g/dl | Anemia Hb 11-12,9g/dl varones o 11-11,9g/dl mujeres |
| Sangrado espontáneo en últimos 6 meses que requirieron hospitalización o transfusión, o en cualquier momento si recurrente | Sangrado espontáneo en últimos 12 meses que requirieron hospitalización o transfusión, no de criterio mayor | |
| Trombocitopenia PQ <100×109/l | ||
| Diátesis hemorrágica crónica | ||
| Afectación hepática | Cirrosis hepática con hipertensión portal | |
| Cáncer | Cáncer activo en últimos 12 meses (excepto cáncer de piel no melanoma) | |
| Afectación cerebral | Hemorragia cerebral previa en cualquier momento | |
| Hemorragia cerebral traumática en los últimos 12 meses | ||
| Malformación arteriovenosa cerebral | ||
| Ictus isquémico moderado o grave en últimos 6 meses | Cualquier ictus isquémico en cualquier momento sin cumplir criterio mayor | |
| Cirugía | Cirugía mayor no diferible en TAPD | |
| Cirugía mayor reciente o trauma mayor en últimos 30 días antes de ICP |
Tabla elaborada con datos de Byrne et al.7, con permiso. ACO: anticoagulantes orales; AINE: antiinflamatorio no esteroideo; ERC: enfermedad renal crónica; FGe: filtración glomerular estimada; ICP: intervención coronaria percutánea; PQ: plaquetas; TAPD: tratamiento antiagregante plaquetario doble.
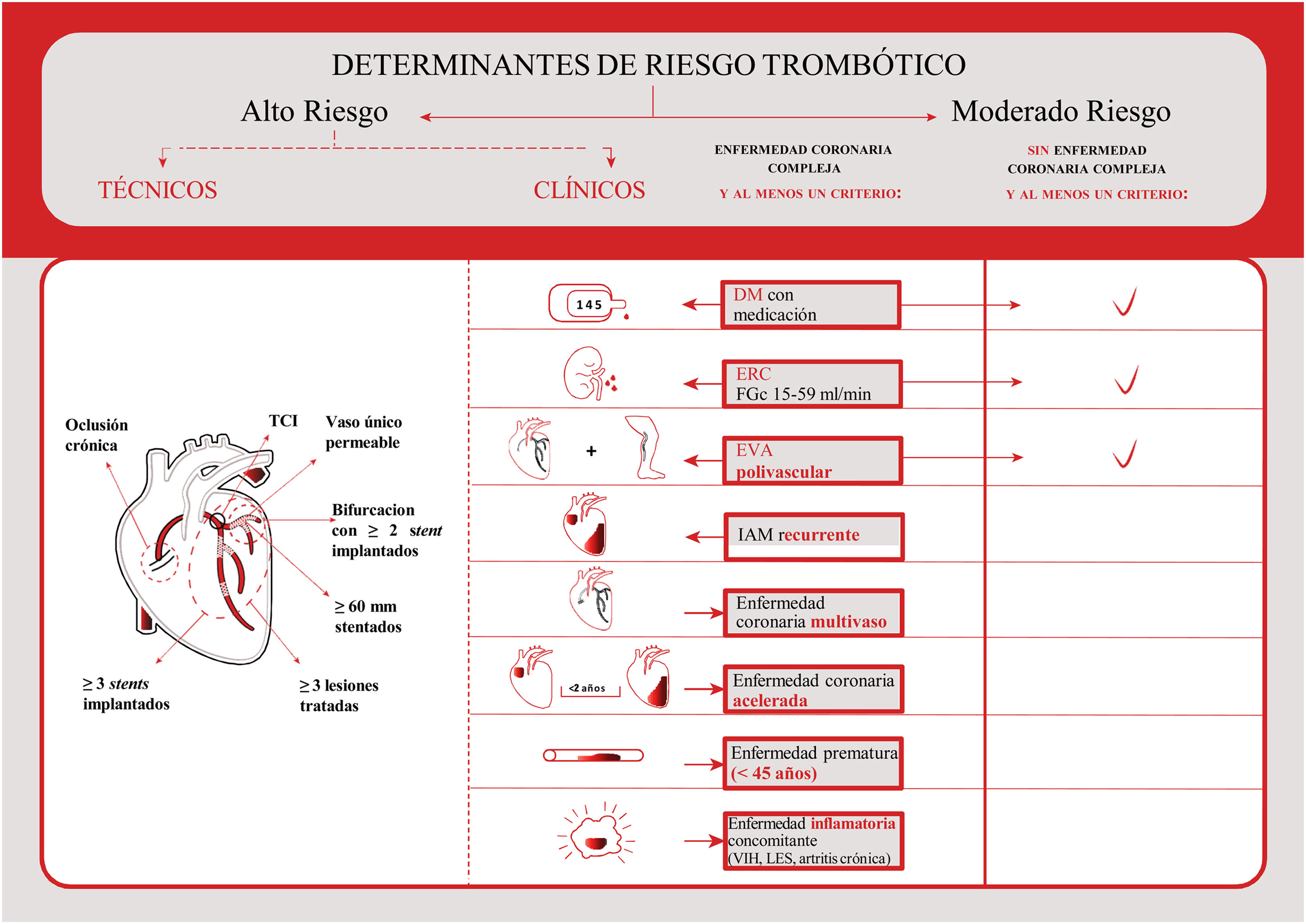
Una vez descartado que el paciente cumpla criterios de alto riesgo de sangrado, valoraremos de forma simultánea si existe alto riesgo de nuevos eventos isquémicos (fig. 2). Para esta evaluación, utilizaremos factores de riesgo como reinfarto, necesidad de revascularización, rehospitalización o trombosis del stent. Las escalas DAPT y PRECISE-DAPT, que combinan factores clínicos y angiográficos, se diseñaron con el objetivo de combinar la predicción de riesgo isquémico y hemorrágico en una sola herramienta para ayudar en la toma de decisión de la duración del TAPD. Estas escalas se construyeron a partir de una extensa población de pacientes sometidos a ICP, procedentes de varios ensayos clínicos40,45–47. La escala PRECISE-DAPT es aplicable tras el alta del paciente48, mientras que la DAPT es una estimación de riesgo de sangrado que se emplea al año tras el evento índice42. En el estudio post hoc de la escala DAPT49, las puntuaciones DAPT ≥2 se asociaron con una reducción en eventos isquémicos en pacientes con tratamiento prolongado con tienopiridinas, comparado con placebo y con sangrados similares, mientras que con puntuaciones DAPT <2, el tratamiento prolongado con tienopiridinas se asoció a un aumento significativo de sangrados, pero con una proporción similar de eventos isquémicos. Es importante destacar que la escala DAPT se diseñó para pacientes que no tuvieron eventos durante los primeros 12 meses, sin contraindicaciones para la doble antiagregación y que toleraron bien el tratamiento.
Determinantes de riesgo trombótico (riesgo alto o moderado) para valorar la prolongación del TAPD de forma extendida, más allá de los primeros 12 meses tras un SCA. DM: diabetes mellitus; ERC: enfermedad renal crónica; EVA: enfermedad vascular aterosclerótica; FGc: filtrado glomerular calculado; IAM: infarto agudo de miocardio; LES: lupus eritematoso sistémico; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TCI: tronco coronario izquierdo; VIH: virus de la inmunodeficiencia humana.
Respecto a la estrategia COMPASS17, sería una buena alternativa a la prolongación del TAPD en caso de coexistir una arteriopatía periférica importante. Se puede considerar también de forma genérica en pacientes con riesgo isquémico alto (infarto agudo de miocardio previo, isquemia recurrente -con doble antiagregación-, diabetes, enfermedad renal crónica, afectación polivascular o insuficiencia cardiaca) y hemorrágico bajo. Especialmente, el paciente con afectación polivascular es un claro candidato a esta estrategia. Por el contrario, el perfil de paciente que hemos definido como de riesgo isquémico alto, en caso de enfermedad multivaso o intervencionismo complejo, sería más tributario de la prolongación del TAPD más allá de los 12 meses. En todo caso, estas recomendaciones solo podrán empezar a aplicarse en España cuando el rivaroxabán esté disponible a dosis cardiovascular.
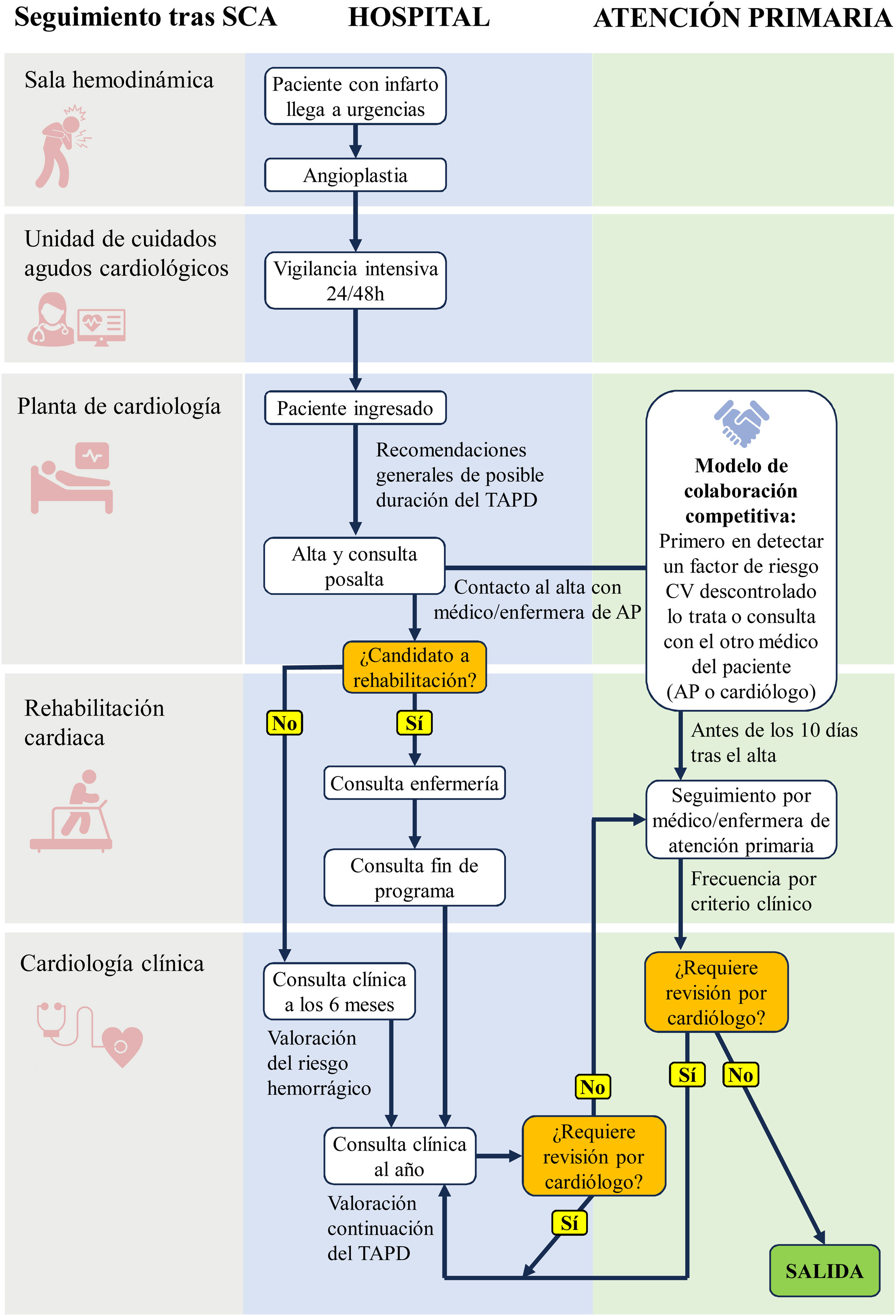
Recomendaciones generales de seguimiento asistencial y continuidad con atención primariaEl seguimiento del paciente es clave tras un SCA debido al impacto que puede tener en la probabilidad de presentar eventos cardiovasculares recurrentes. Es crucial que las decisiones médicas sean compartidas entre el cardiólogo, el médico de atención primaria y los pacientes (y en ocasiones también la familia) como clave para reducir el riesgo residual de futuros eventos cardiovasculares50. Debe efectuarse una transición bien planificada entre el cardiólogo que lo atiende en los primeros días durante el ingreso en el hospital al médico de atención primaria. Dentro de las iniciativas recomendadas para fomentar la continuidad asistencial, destaca el programa SEC-Primaria de la SEC51. En síntesis, el programa se focaliza en 3 elementos que se integran entre sí: proporcionar la formación específica en el proceso cardiovascular, protocolizar actuaciones mediante la creación de informes estándar con los correspondientes indicadores de calidad, y mejorar la comunicación y relación entre asistencia primaria y especializada. En este sentido, es fundamental la elaboración de un informe de alta completo, junto con la derivación precoz a un programa de prevención cardiovascular que incluya la rehabilitación cardiaca y que facilite el seguimiento del paciente por un equipo multidisciplinar.
En los programas de prevención cardiovascular debe asegurarse un contacto regular durante el primer año tras el SCA52. Las citas de seguimiento deben abordarse como una oportunidad de optimizar de forma dinámica y continua el enfoque del tratamiento, para reducir los resultados clínicos adversos y mejorar la calidad de vida del paciente de forma individualizada. La visita durante el primer mes debe centrarse en repetir los mensajes educativos clave para mantener la adherencia y el cumplimiento a largo plazo, explicar los beneficios del tratamiento, así como la optimización de los objetivos y evaluar sus posibles efectos secundarios, como las hemorragias. La segunda visita (entre los 3 y los 6 meses) permite realizar una optimización del tratamiento siempre que sea necesaria y una evaluación del riesgo hemorrágico en pacientes frágiles, en los que el TAPD puede interrumpirse o sustituirse por un tratamiento antiagregante plaquetario simple. Finalmente, la evaluación al año por parte del cardiólogo (entre los 6 y los 12 meses) debe centrarse en la consecución de los objetivos generales de prevención secundaria e identificar a los pacientes que pueden beneficiarse de un TAPD prolongado más allá del año. Esta visita permite la reevaluación del riesgo/beneficio clínico neto del TAPD para valorar su continuación (fig. 3). Tras el primer año de seguimiento, se deben trasladar unas recomendaciones para el seguimiento por atención primaria con unos flujos bien establecidos que aseguren la comunicación bidireccional.
Proceso ideal del seguimiento del TAPD en un paciente tras un SCA, en el ámbito hospitalario y de atención primaria. Adaptado de Pérez de Isla et al.52, con permiso. AP: atención primaria; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
Este documento tiene la finalidad de sintetizar las pautas de las guías de práctica clínica sobre la estratificación del riesgo post-SCA y su tratamiento con TAPD. Dadas las importantes diferencias en el abordaje clínico tras un SCA entre centros y comunidades autónomas, así como la variabilidad médica existente en la aplicación de las pautas para la continuación de la doble antiagregación, una mayor homogeneización de los criterios del tratamiento y seguimiento pueden contribuir a reducir la estancia hospitalaria y la mortalidad intrahospitalaria asociada al SCA.
Varios estudios destacan el significativo descenso en la prescripción de TAPD y del resto de medicación dirigida a la prevención secundaria una vez superado el primer mes tras un SCA19–21. Sin embargo, es recomendable que la duración del TAPD inicial sea de al menos un año en todos los pacientes que no presenten alto riesgo hemorrágico9. Tras el primer año de tratamiento, la guía recomienda prolongar el TAPD en pacientes con gran riesgo isquémico y sin riesgo hemorrágico alto39. A pesar de que el número de potenciales candidatos a prolongar la doble antiagregación es elevado25, datos recientes sugieren que únicamente se produce en alrededor de un tercio de los pacientes24. Varios autores han sugerido que la reducción de eventos y la mejoría en calidad de vida de un tratamiento optimizado podría compensar el gasto económico asociado al uso de antiagregantes más potentes como el ticagrelor26–28.
Globalmente, cabe considerar la prolongación del TAPD en aquellos pacientes que, habiéndolo tolerado correctamente durante el primer año, presentan un riesgo trombótico residual significativo sin un riesgo hemorrágico elevado39. Los pacientes de alto riesgo isquémico son aquellos con diabetes mellitus, enfermedad arterial periférica, SCA recurrentes, enfermedad renal crónica, enfermedad coronaria compleja, múltiples revascularizaciones y antecedentes de trombosis del stent. La vigente guía ESC 2023 para el tratamiento del SCA recomienda prolongar el TAPD al año en aquellos pacientes de riesgo trombótico moderado (recomendación de clase IIb) o alto (recomendación de clase IIa) que hayan tolerado bien el tratamiento hasta la fecha y no presenten alto riesgo hemorrágico mayor que pueda comprometer su vida7. Para la valoración del riesgo hemorrágico, recomendamos usar la escala ARC-HBR41, mientras que las escalas PRECISE-DAPT48 y DAPT42 pueden usarse para integrar el riesgo isquémico y hemorrágico al alta y al año tras un SCA, respectivamente.
- •
Aunque los avances en el manejo del SCA han conseguido descender las tasas de mortalidad en los últimos años, es necesario seguir avanzando en la mejora de la salud cardiovascular de nuestra población.
- •
Datos recientes sugieren que la prolongación del TAPD más allá de un año solo se produce en alrededor de un tercio de los pacientes candidatos, por lo que existe un amplio margen de mejora.
- •
Una mayor homogeneización del seguimiento y los criterios para prolongar el TAPD pueden contribuir a reducir la estancia y mortalidad hospitalaria asociada al SCA, con el consecuente coste sociosanitario que conlleva.
- •
Las decisiones sobre la duración del TAPD deben integrarse como parte fundamental del seguimiento del paciente que ha sufrido un evento.
- •
El riesgo trombótico debe evaluarse adecuadamente, dentro del riesgo residual, como un objetivo más en prevención secundaria.
- •
Debe valorarse prolongar el TAPD en pacientes que la hayan tolerado correctamente y presenten un alto riesgo isquémico sin riesgo hemorrágico elevado.
- •
Es fundamental optimizar el seguimiento del paciente para poder ajustar correctamente el TAPD durante todo el proceso asistencial.
Proyecto financiado por AstraZeneca.
Declaración sobre el uso de inteligencia artificialNo se ha utilizado inteligencia artificial.
Contribución de los autoresLas opiniones expresadas en este artículo se basan en la evidencia científica disponible en el momento de elaboración del manuscrito. Son el resultado de una reflexión crítica, imparcial y rigurosa, con la intención de contribuir de manera responsable y pragmática a la mejora de la práctica clínica. Todos los autores han contribuido significativamente a la concepción, redacción, elaboración de contenido, y revisión de este artículo. A. Viana Tejedor, T. Ripoll-Vera y M.R. Fernández Olmo participaron por igual en la coordinación del proyecto. A. Viana Tejedor y T. Ripoll-Vera contribuyeron por igual a este trabajo y comparten la primera autoría. Todos los autores cumplen con los criterios de autoría y aprueban la publicación del artículo.
Conflicto de interesesA. Viana Tejedor: asesoría científica y honorarios por ponencia de AstraZeneca, Daiichi-Sankyo, Amgen y Boehringer. T. Ripoll-Vera: asesoría científica de AstraZeneca, BMS, Pfizer, Alnylam, Amicus y Chiesi; honorarios por ponencias de Pfizer, Alnylam y Amicus; becas de investigación: Pfizer y AstraZeneca. M.S. Bravo Amaro: asesoría científica y honorarios en AstraZeneca, Servier, Novartis, Amarín, Amgen, Sanofi, Novo Nordisc, Ferrer y Daiichi-Sankyo. A. Ariza-Solé: asesoría científica y honorarios en AstraZeneca y Boehringer Ingleheim. M. Sandín Rollán: asesoría científica y honorarios en AstraZeneca, Servier, Novartis, Amarín, Ferrer y Daiichi-Sankyo. D. Vivas Balcones: asesoría científica y honorarios por ponencia de AstraZeneca, Daiichi-Sankyo y Lilly. N. Romero Rodríguez: asesoría científica y honorarios en AstraZeneca y Boehringer. M.R. Fernández Olmo no tiene conflictos de intereses que declarar.
Los autores agradecen a Ánchel González Barriga de Medical Science Consulting (España) por brindar apoyo editorial, siguiendo instrucciones detalladas de los autores, corrigiendo el estilo y preparando tablas, figuras y referencias.