Actualización y novedades en cardiología. Visión del cardiólogo joven
More infoLa amiloidosis cardiaca (AC) es una enfermedad miocárdica infiltrativa provocada por el depósito intersticial de material amiloide. Su forma más frecuente es la causada por la transtirretina (AC-ATTR), concretamente su subtipo no hereditario o wild-type (AC-ATTRwt). Para diagnosticar esta enfermedad es imprescindible establecer adecuadamente su sospecha basándonos en datos aportados por la historia clínica, la exploración física y algunas pruebas complementarias fundamentales. La confirmación diagnóstica de AC-ATTR puede conseguirse en la mayoría de los casos realizando una gammagrafía con bifosfonatos y evaluando la existencia de un componente monoclonal en sangre y orina; en el resto va a ser necesario llevar a cabo estudios histológicos. En todos los pacientes con AC-ATTR ha de realizarse secuenciación del gen de la transtirretina. En cuanto a su tratamiento, diferenciamos dos aspectos fundamentales: un tratamiento general de las manifestaciones derivadas de la afectación cardiaca y un tratamiento específico dirigido a frenar el proceso amiloidogénico.
Cardiac amyloidosis (CA) is an infiltrative myocardial disease caused by interstitial deposition of amyloid fibrils. The most common type is caused by transthyretin (ATTR-CA), specifically the non-hereditary subtype, also called wild-type (ATTRwt-CA). For the diagnosis, it is essential to have a high index of suspicion based on the clinical history, physical examination, and some fundamental investigations. Diagnostic confirmation of ATTR-CA can be achieved in most cases non-invasively by performing a bone scintigraphy and evaluating the presence of monoclonal proteins in blood and urine. In the rest of cases, histological confirmation will be required. In all patients with ATTR-CA, transthyretin gene sequencing must be performed. There are e two fundamental aspects for the treatment of ATTR-CA: supportive treatment of the manifestations derived from cardiac involvement and a specific treatment aiming to stop the amyloidogenic process.
«Amiloidosis» es un término genérico que abarca un grupo heterogéneo de enfermedades caracterizadas por el depósito patológico en el intersticio de los tejidos del amiloide, un material insoluble de origen proteico, lo que provoca una alteración de la estructura y función de múltiples órganos. Aunque son cerca de 40 las proteínas descritas que pueden causar la enfermedad, más del 98% de los casos de amiloidosis cardiaca (AC) se deben a 2 de ellas: las cadenas ligeras (AL) y la transtirretina (ATTR), en la que se diferencian una forma hereditaria o variante (ATTRv) y una forma no hereditaria o wild-type (ATTRwt)1,2.
Clásicamente se ha considerado la AC-AL la forma más frecuente de AC. Sin embargo, el mejor conocimiento de la enfermedad ha permitido saber que la AC-ATTRwt, una entidad hasta hace poco infradiagnosticada, es en realidad el subtipo más prevalente1.
Además de los avances que se han producido en relación con el diagnóstico de la AC-ATTR, recientemente también ha habido interesantes novedades respecto al tratamiento de esta patología, que se asocian en algunos casos a un beneficio pronóstico. El objetivo de este artículo es llevar a cabo una revisión actualizada del abordaje diagnóstico y terapéutico de la AC-ATTR.
DiagnósticoA pesar de que la AC-ATTR es relativamente fácil de diagnosticar, algunos registros publicados sobre la enfermedad demuestran que en aproximadamente la mitad de los pacientes se establecen previamente otros juicios clínicos (principalmente de cardiopatías con un fenotipo similar, como la miocardiopatía hipertrófica, la cardiopatía hipertensiva y la insuficiencia cardiaca [IC] con fracción de eyección conservada)3–5. Este dato ilustra la importancia de saber establecer la sospecha de AC-ATTR para posteriormente solicitar las pruebas complementarias que permitan confirmar el diagnóstico. Desde un punto de vista didáctico, podemos dividir el proceso diagnóstico de la AC-ATTR en 2 aspectos: la sospecha y la confirmación.
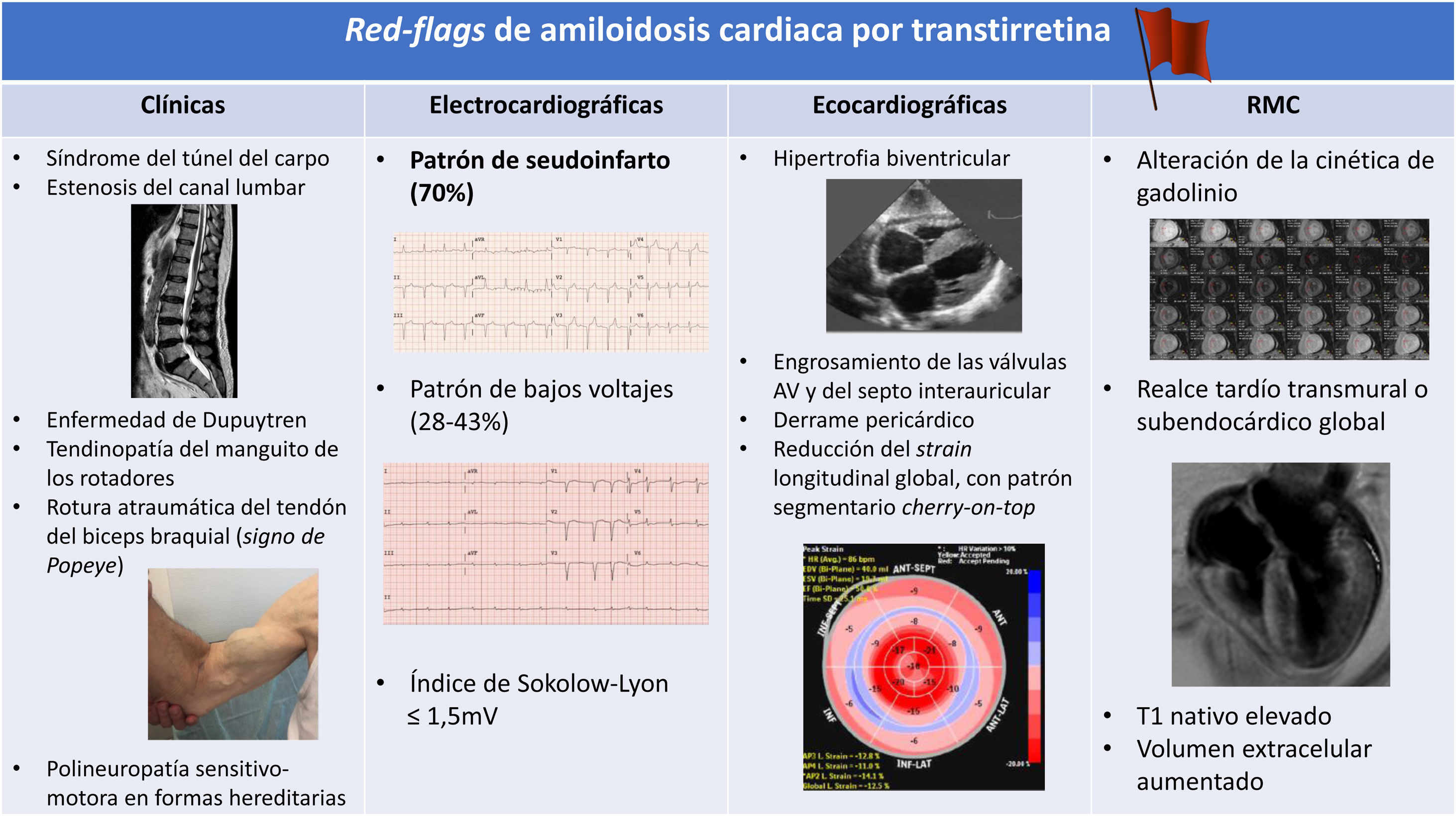
Sospecha diagnósticaLa sospecha de AC-ATTR se establece basada en datos sugestivos de la enfermedad (los signos de alerta, también denominados red flags) aportados por la historia clínica, la exploración física, el electrocardiograma, el ecocardiograma transtorácico y la resonancia magnética cardiaca (fig. 1).
La forma de presentación clínica más frecuente de la AC-ATTR es la IC4–6. Aunque en la mayoría de los pacientes suele observarse al diagnóstico una fracción de eyección ventricular izquierda conservada, se ha descrito que hasta el 40% puede presentarse con valores <50%5,6. Un grupo español encontró una prevalencia de AC-ATTRwt en pacientes >60 años con engrosamiento ventricular izquierdo >12mm ingresados por IC con fracción de eyección conservada o <50% del 13% y el 11%, respectivamente7,8. Otras manifestaciones con las que puede hacer su aparición clínica esta patología son los trastornos del ritmo cardiaco, el síncope o la valvulopatía aórtica; además, hay una proporción no despreciable de pacientes a quienes se detecta en el contexto de un diagnóstico diferencial de engrosamiento ventricular izquierdo4–6,9.
La valoración de una sospecha de AC-ATTR siempre debe incluir una revisión exhaustiva de los antecedentes médicos y quirúrgicos del paciente. En esta entidad (sobre todo en su forma wild-type) es típica una historia previa de diversas conectivopatías, entre las que destacan el síndrome de túnel carpiano, la estenosis de canal lumbar, la enfermedad de Dupuytren y la tendinopatía del manguito rotador del hombro, que antecede al diagnóstico de la cardiopatía entre 5 y 10 años6,9. La manifestación extracardiaca más característica de la AC-ATTRv es la afectación del sistema nervioso periférico y el grado de expresividad clínica está relacionado con la variante genética presente9.
En cuanto a la exploración física, de nuevo las conectivopatías tienen gran protagonismo, especialmente la rotura atraumática del tendón proximal del bíceps braquial, cuya expresión semiológica es el signo de Popeye10. Este hallazgo, junto con cualquier grado de contractura de Dupuytren, se ha observado en hasta el 38% de los pacientes con AC-ATTR6.
El electrocardiograma continúa siendo una prueba fundamental para orientar la sospecha diagnóstica de AC-ATTR. Hoy en día sabemos que los criterios clásicos de bajos voltajes, sumatorio de la amplitud del complejo QRS en todas las derivaciones frontales ≤0,5mV o en todas las derivaciones precordiales ≤1mV tienen una baja prevalencia en esta enfermedad (entre el 28-43% en derivaciones frontales y el 8-28% en derivaciones precordiales)2,6. Los hallazgos más frecuentes, observados en hasta el 70% de los casos, son el índice de Sokolow-Lyon ≤1,5mV y el patrón de seudoinfarto (existencia de ondas Q patológicas en ≥2 derivaciones consecutivas en ausencia de historia previa de infarto de miocardio)2,5,6.
El ecocardiograma transtorácico tiene un papel fundamental en el proceso diagnóstico de la AC-ATTR. Aunque la alteración estructural más característica es el engrosamiento concéntrico de las paredes del ventrículo izquierdo ≥12mm, en la actualidad sabemos que los patrones de afectación asimétrica, como el de predomino septal, no son infrecuentes y pueden presentarse hasta en el 23-29% de los pacientes5,6. Otros hallazgos frecuentes son el derrame pericárdico y el engrosamiento de las paredes del ventrículo derecho, las válvulas auriculoventriculares o el septo interauricular. La reducción del strain longitudinal global con el característico patrón de conservación apical relativa, o cherry-on-top (valores reducidos en segmentos basales y medios, conservados en segmentos apicales), tiene una alta sensibilidad y especificidad para identificar la enfermedad, especialmente en estadios precoces. Recientemente se ha propuesto una escala ecocardiográfica multiparamétrica para orientar la sospecha de AC-ATTR en pacientes con engrosamiento ventricular izquierdo ≥12mm11. Los parámetros utilizados son el grosor parietal relativo (>0,6=3 puntos), la relación E/é (>11=1 punto), el desplazamiento sistólico del plano del anillo tricuspídeo, o TAPSE (≤19mm=2 puntos), el strain longitudinal global (≥–13=1 punto) y la relación entre los valores de strain longitudinal apical y basal (>2,9=3 puntos). Una puntuación total <2 excluye el diagnóstico de AC-ATTR con una sensibilidad del 98%, mientras que si es ≥8 sugiere claramente el diagnóstico (especificidad del 98%).
Un hallazgo característico en la resonancia magnética cardiaca es el depósito difuso de gadolinio en las paredes del ventrículo izquierdo a nivel subendocárdico o transmural12, aunque también puede observarse en otras regiones, como el ventrículo derecho o la aurícula izquierda. Otras características de esta patología son la cinética alterada de gadolinio, el volumen extracelular aumentado y los valores muy elevados en los mapas de T112,13; estos 2 últimos han demostrado una alta precisión diagnóstica desde estadios subclínicos14.
La Sociedad Europea de Cardiología considera establecida la sospecha de AC ante un engrosamiento ventricular izquierdo ≥12mm y al menos un signo de alerta (red flag); otros consensos de expertos no establecen dicho punto de corte y aconsejan sospechar la enfermedad simplemente ante datos indicativos de la misma15.
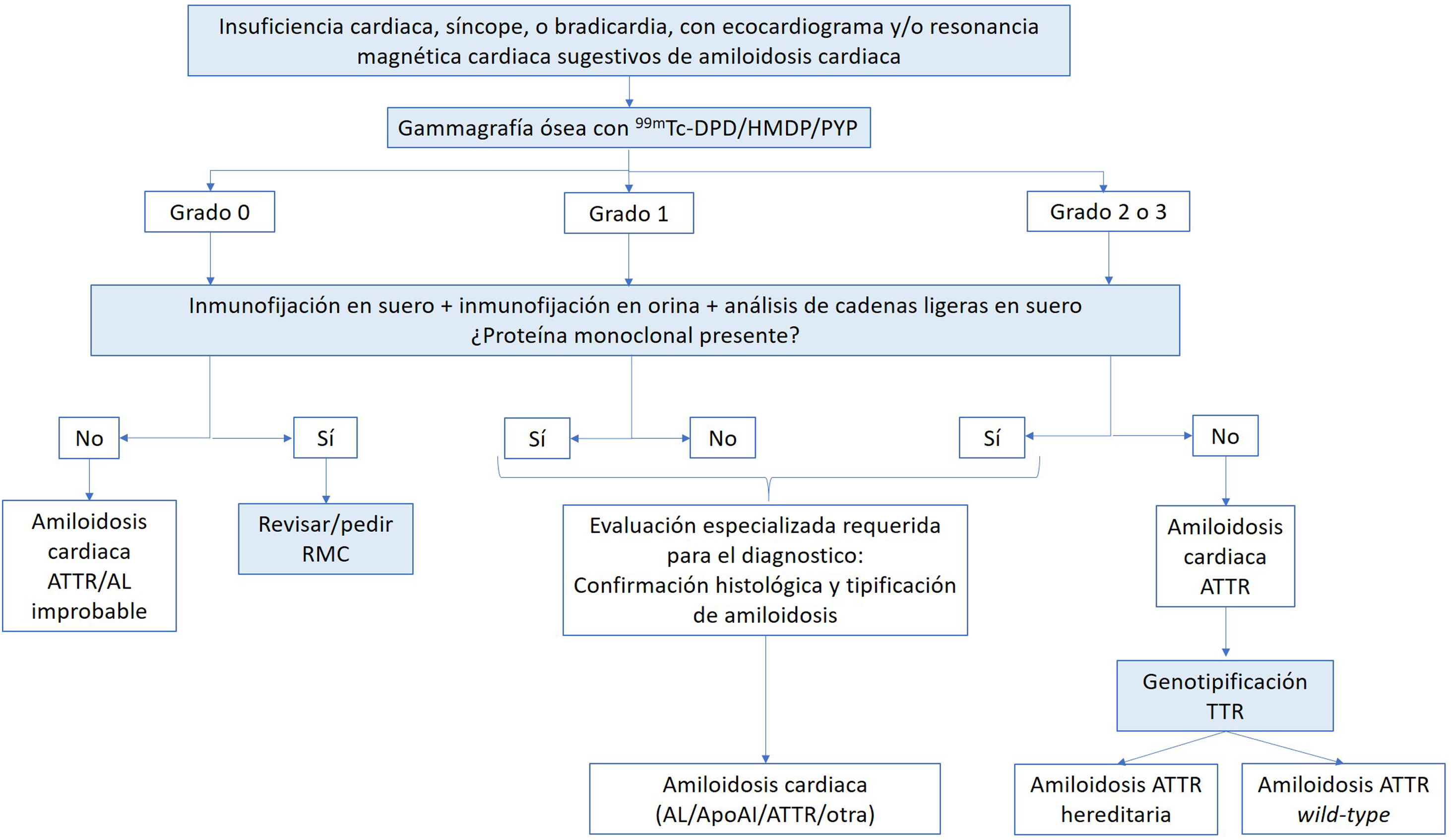
Confirmación diagnósticaEn 2016 se demostró que la combinación de una gammagrafía con bifosfonatos marcados con tecnecio 99 que evidenciara una captación cardiaca de grado ≥2, junto con la ausencia de un componente monoclonal verificada con la determinación de cadenas ligeras libres en sangre e inmunofijación en sangre y orina, permitía el diagnóstico de AC-ATTR con una especificidad del 100%16. Actualmente, esta posibilidad evita realizar estudios histológicos a más del 75% de los pacientes con este tipo de AC4,6 y por ello las sociedades científicas recomiendan iniciar la confirmación diagnóstica de la enfermedad con ambos estudios, simultánea o secuencialmente15. En los casos en los que la gammagrafía muestre una captación cardiaca grado 1 o exista un componente monoclonal, se necesitarán estudios histológicos para poder confirmar el diagnóstico de AC-ATTR (fig. 2), teniendo en cuenta además la alta prevalencia de gammapatía monoclonal de significado incierto en pacientes con AC-ATTR, que en algunas series llega hasta el 39% en formas wild-type17.
Algoritmo diagnóstico de la amiloidosis cardiaca. Reproducido y adaptado con permiso de Gillmore et al.16. 99mTC: tecnecio 99; AL: amiloidosis por cadenas ligeras; ApoAI: amiloidosis por apolipoproteína AI; ATTR: amiloidosis por transtirretina; DPD: ácido 3,3-difosfono-1,2-propanodicarboxílico; HMDP: hidroximetilen difosfonato; PYP: pirofosfato; RMC: resonancia magnética cardiaca.
Finalmente, en todos los pacientes con AC-ATTR, independientemente de su edad, se recomienda realizar secuenciación del gen de la transtirretina para evaluar la presencia de variantes genéticas y así poder diferenciar los subtipos AC-ATTRv y AC-ATTRwt15.
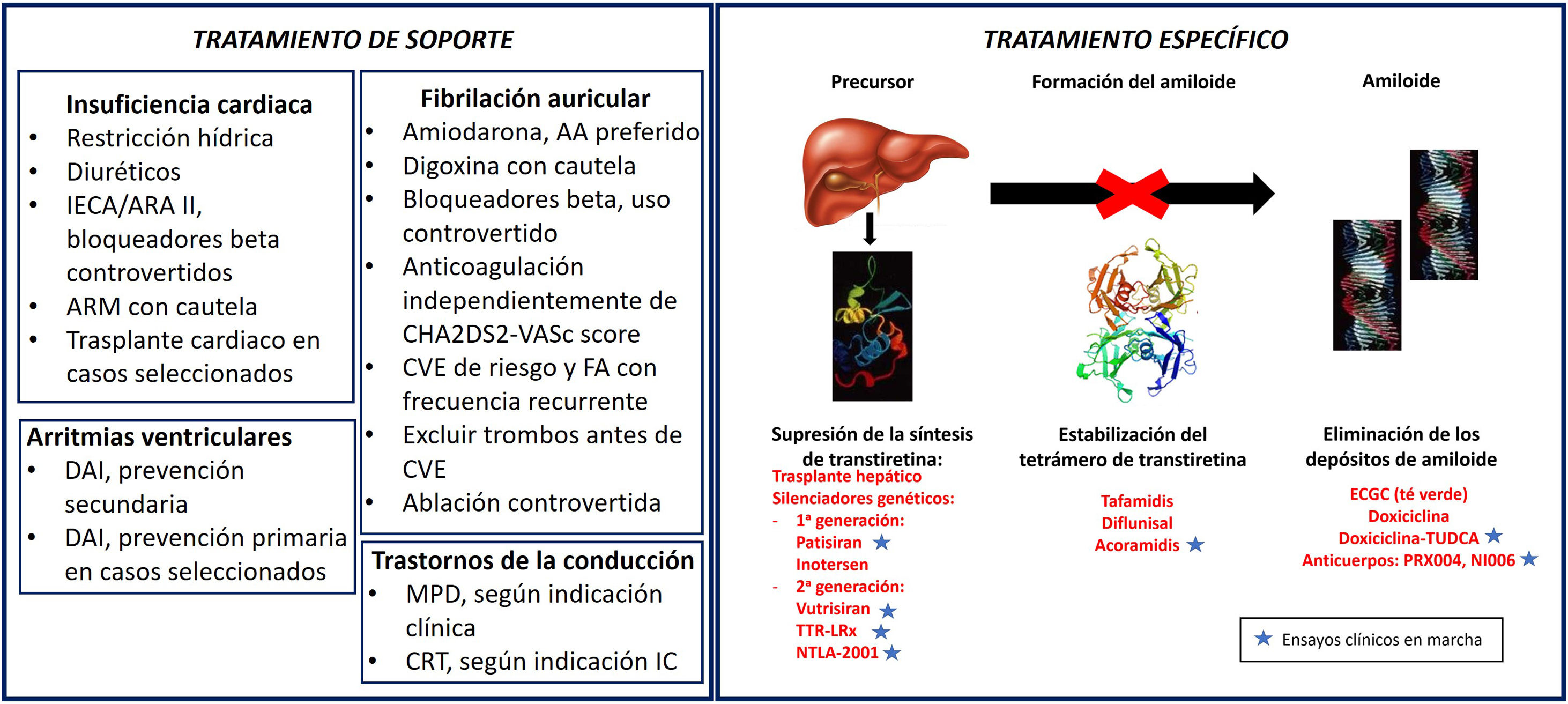
TratamientoLa estrategia terapéutica en la AC-ATTR consta de 2 elementos principales: tratamiento de las complicaciones derivadas de la afectación cardiaca (tratamiento general o de soporte) y actuar sobre el proceso amiloidogénico (tratamiento específico) (fig. 3).
Esquema del tratamiento general (de soporte) y específico de la amiloidosis cardiaca por transtirretina. AA: antiarrítmico; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor mineralocorticoide; CRT: terapia de resincronización cardiaca; CVE: cardioversión eléctrica; DAI: desfibrilador automático implantable; ECGC: epigalocatequina-3-galato; FA: fibrilación auricular; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; MPD: marcapasos definitivo; TUDCA: ácido tauroursodeoxicólico.
El uso de los diuréticos para el alivio de la congestión en la AC goza de un consenso total entre los diferentes documentos publicados por las sociedades científicas (todas establecen un grado de recomendación I)15. La torasemida y la bumetanida son los diuréticos de asa preferidos por presentar mayor biodisponibilidad por vía oral; la experiencia aportada por los centros especializados en la enfermedad recomienda añadir dosis bajas de antagonistas del receptor mineralocorticoide (ARM) si se desea conseguir una respuesta diurética mayor. También es importante instruir al paciente en las medidas de autocuidado, como el control diario del peso, útil en la detección precoz de descompensaciones, y la restricción hidrosalina.
El uso en esta cardiopatía de inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas del receptor de la angiotensina II (ARA-II), bloqueadores beta y ARM (con una intención diferente a su acción diurética) carece por el momento de la suficiente evidencia científica. Esto, sumado a que, teniendo en cuenta argumentos fisiopatológicos, la mayoría de los expertos considera que estos fármacos pueden tener un impacto desfavorable, explica que algunos de los consensos aboguen por evitar su uso15. La Sociedad Japonesa de Cardiología considera su prescripción con un grado de recomendación IIB y la American Heart Association y la Canadian Cardiovascular Society contemplan el uso de los ARM con grados de recomendación I y IIB, respectivamente. Recientemente se han publicado estudios observacionales que analizan el papel del tratamiento neurohormonal en la AC. Por un lado, Aimo et al.18 demostraron en una cohorte de 99 pacientes con AC (67% con AC-ATTR) que este tratamiento era bien tolerado en ausencia de contraindicaciones siempre que se iniciase a dosis bajas y con una regulación posterior de la dosis lenta; en concreto, los bloqueadores beta se suspendieron únicamente en el 7% de los pacientes, su inicio o dosificación tras el diagnóstico de AC no se asoció a mayor incidencia de efectos secundarios y el riesgo de complicaciones asociadas a su prescripción fue mayor en la cohorte de AC-AL en comparación con la de AC-ATTR. Además, un estudio basado en 128 pacientes con AC-ATTR incluidos en el registro AMIGAL19 observó que la exposición a los bloqueadores beta parece asociarse a una reducción significativa de la mortalidad por cualquier causa. Contrariamente a estos resultados favorables, un análisis de 309 pacientes con AC-ATTR encontró que el tratamiento con IECA o ARA-II, bloqueadores beta o ARM no parece asociarse con una mejoría de la supervivencia20. Esta evidencia controvertida acentúa la necesidad de llevar a cabo estudios diseñados específicamente para evaluar la utilidad del tratamiento neurohormonal en la AC-ATTR.
La utilidad de la terapia de resincronización cardiaca se evaluó en un pequeño estudio de 60 pacientes con AC-ATTR21; el grupo que recibió el implante del dispositivo experimentó una mejoría sintomática, de la fracción de eyección ventricular izquierda y de la supervivencia. La recomendación general es la de instaurar esta terapia siguiendo las indicaciones habituales en IC, especialmente si se espera un elevado porcentaje de estimulación15.
Las opciones de tratamiento de los pacientes con AC-ATTR e IC avanzada son escasas. En primer lugar, la edad media al diagnóstico de la forma más prevalente (la AC-ATTRwt) está en torno a los 80 años4–6, por lo que no suelen ser candidatos a las terapias indicadas. Por otra parte, el implante de una asistencia circulatoria de larga duración no suele considerarse una buena opción en esta cardiopatía, caracterizada por una cavidad ventricular izquierda de pequeño tamaño y fracción de eyección habitualmente conservada; además, la mortalidad publicada está muy por encima de la observada con la utilización de estos dispositivos en otras cardiopatías22. Finalmente, los resultados del trasplante cardiaco en la AC-ATTR han mejorado notablemente en los últimos años gracias a la mejor selección de los candidatos por medio de estudios pretrasplante ampliados dirigidos a descartar una afectación sistémica relevante23. Recientemente se ha publicado que hasta el 50% de los receptores de un trasplante cardiaco por AC-ATTR pueden presentar nuevos depósitos extracardiacos de transtirretina en el postrasplante24, lo que destaca la importancia de hacer un seguimiento activo y valorar la instauración de terapias específicas contra el proceso amiloidogénico en ese periodo.
La fibrilación auricular está presente en el 40-50% de los pacientes con AC-ATTRwt en el momento del diagnóstico4–6. Para controlar la respuesta ventricular se deben evitar los calcioantagonistas, ya que se asocian con un incremento del riesgo de trastornos avanzados de la conducción y shock cardiogénico. El uso de los bloqueadores beta en este contexto resulta igual de controvertido que en la IC15; la digoxina, hasta hace poco absolutamente contraindicada, parece que es segura si se utiliza a dosis bajas y con una monitorización estrecha de sus niveles plasmáticos, la función renal y los electrolitos25. Algunos expertos posicionan a la amiodarona como fármaco de primera línea para el control de la respuesta ventricular en la AC15, pero no debemos olvidar la frecuente y, en ocasiones, grave toxicidad extracardiaca asociada a este fármaco. Si se decide llevar a cabo una estrategia farmacológica para el control del ritmo, la amiodarona es el fármaco recomendado. Si se opta por una cardioversión eléctrica, hay que tener en cuenta que, aunque la tasa de éxito es similar a la observada en otras cardiopatías, el riesgo de complicaciones es mayor y que, dada la elevada prevalencia de trombos intracardiacos, se recomienda siempre realizar previamente un ecocardiograma transesofágico26. Es precisamente por esta mayor trombogenicidad de la fibrilación auricular en la AC que la reciente guía norteamericana para el tratamiento de la IC aconseja indicar la anticoagulación independientemente de la puntuación en la escala CHA2DS2-VASc con un grado de recomendación 2A27; además, en ausencia de estudios aleatorizados, los anticoagulantes directos parecen ser tan eficaces y seguros como la warfarina en pacientes con AC-ATTR28. Por último, la ablación de las venas pulmonares en esta cardiopatía es controvertida, por lo que no pueden establecerse recomendaciones al respecto15.
Los trastornos de la conducción y la muerte súbita tienen una elevada incidencia en la AC-ATTR. El implante de un dispositivo de estimulación permanente debe seguir las indicaciones generales15. A pesar de que la muerte súbita es una causa frecuente de fallecimiento en la AC-ATTR6, es más probable que esté causada por bradicardias extremas o disociación electromecánica que por arritmias ventriculares. Si a esto le sumamos que el desfibrilador automático implantable no ha demostrado mejorar la supervivencia en esta enfermedad29, entendemos por qué hoy en día se cuestiona su uso en la mayoría de las situaciones clínicas. En general, hay un claro consenso en indicarlo cuando el paciente ya ha presentado un evento (prevención secundaria), mientras que la decisión de implantarlo en el contexto de la prevención primaria debe seguir un enfoque individualizado15.
La estenosis valvular aórtica y la AC-ATTR son 2 entidades íntimamente relacionadas, que coexisten en hasta el 16% de los pacientes. Aunque se han planteado varias hipótesis para justificar esta asociación, sigue sin estar completamente explicada30. La presencia de esta valvulopatía empeora el pronóstico de la enfermedad, y su tratamiento mediante el implante de una prótesis biológica transcatéter logra reducir la mortalidad y las hospitalizaciones por IC de manera similar a como lo consigue en la población sin AC-ATTR31.
Tratamiento específicoEl tratamiento específico de la ATTR es el dirigido contra el proceso de formación del amiloide, o amiloidogénesis. Teniendo en cuenta la fase en la que actúan, podemos distinguir 3 grupos principales de tratamientos: los que suprimen la síntesis de la transtirretina, los que estabilizan el tetrámero de transtirretina e impiden su disociación en unidades de bajo peso molecular y los que eliminan los depósitos de amiloide.
Supresión de la síntesis de transtirretinaEl trasplante hepático fue el primer tratamiento utilizado para detener la síntesis de la transtirretina. Es útil únicamente en la ATTRv por la presencia de una proteína mutada y no es un tratamiento indicado en la ATTRwt. Descrito por primera vez en 1990 para el tratamiento de la polineuropatía amiloidótica familiar, ha demostrado en este contexto un incremento significativo de la supervivencia32. Sin embargo, los resultados del trasplante hepático no son tan favorables con otras variantes genéticas que no sean la Val50Met y se ha demostrado que tras la intervención puede continuar el depósito de la transtirretina no mutada en los tejidos por un mecanismo no bien conocido. Esto, añadido a la limitada disponibilidad de órganos, los riesgos asociados con la cirugía, la necesidad de inmunosupresión crónica y la disponibilidad de nuevas alternativas terapéuticas, ha hecho que esta técnica se considere actualmente obsoleta.
El ARN mensajero (ARNm) que transmite la información necesaria para la síntesis de la transtirretina es la diana de un grupo farmacológico denominado silenciadores genéticos, que bloquean la traducción del ARNm en la proteína, logrando reducir su producción por parte de los hepatocitos y, en consecuencia, sus niveles plasmáticos. Se han desarrollado 2 tipos de silenciadores genéticos: los ARN de interferencia pequeños (ARNip) y los oligonucleótidos antisentido (OAS).
Los ARNip son moléculas de ARN de doble hebra con una longitud de 20-25 nucleótidos que inducen la degradación de su ARNm diana. El patisirán es un ARNip específico contra el ARNm de la transtirretina con utilidad tanto en la ATTRv como en la ATTRwt. En el ensayo de fase III APOLLO33, en el que se incluyó a 225 pacientes con ATTRv y polineuropatía, se observó que aquellos bajo tratamiento con patisirán experimentaron una mejoría significativa de los síntomas neurológicos y de la calidad de vida en comparación con los incluidos en el brazo de placebo. Aunque de forma global los efectos adversos fueron más frecuentes con el patisirán, no se observaron diferencias estadísticamente significativas respecto a aquellos considerados graves. Por el momento, la eficacia del patisirán en la AC-ATTR únicamente se ha evaluado en un subestudio del ensayo APOLLO que incluyó a 126 pacientes con evidencia ecocardiográfica de afectación cardiaca34, en el que se advirtió que en el grupo de tratamiento se producía una reducción significativa del grosor del ventrículo izquierdo y de los valores de péptido natriurético NT-proBNP, así como un incremento significativo del volumen telediastólico del ventrículo izquierdo. El patisirán ha sido aprobado por las agencias del medicamento norteamericana y europea para el tratamiento de la polineuropatía por ATTRv, mientras que su uso en la AC-ATTR ha de esperar a los resultados del ensayo clínico APOLLO-B, actualmente en marcha (NCT 03997383).
Los OAS son cadenas de entre 13 y 25 nucleótidos con una secuencia de bases complementaria a un fragmento de su ARNm diana que bloquean su traducción a la proteína. El inotersén es un OAS específico para el ARNm de la transtirretina que puede utilizarse en los 2 subtipos de ATTR. En el ensayo de fase III NEURO-TTR35, se aleatorizó a 172 pacientes con polineuropatía por ATTRv a recibir inotersén o placebo. El fármaco demostró ser bien tolerado y enlentecer la progresión del daño neurológico. Actualmente no disponemos de datos sólidos sobre la utilidad del inotersén en la AC-ATTR y tampoco existen ensayos clínicos en marcha. Al igual que para el patisirán, las agencias del medicamento norteamericana y europea han aprobado el uso del inotersén para el tratamiento de la polineuropatía por ATTRv.
Otros silenciadores genéticos son el revusirán, cuyo estudio tuvo que suspenderse precozmente al observarse un aumento de la mortalidad; el vutrisirán, que ha mostrado resultados prometedores en los estudios preliminares y cuya utilidad en la AC-ATTR se está evaluando en el ensayo clínico de fase III HELIOS-B (NCT 04153149); y el eplontersén (anteriormente conocido como IONIS-TTR-LRx), un OAS de nueva generación que se está estudiando en ensayos clínicos de fase III para el tratamiento de la AC-ATTR (NCT 04136171) y la polineuropatía por ATTRv (NCT 04136184).
El NTLA-2001 es un nuevo agente de edición genética in vivo diseñado para el tratamiento de la ATTR que reduce los niveles plasmáticos de transtirretina. Este tratamiento se basa en la técnica CRISPR-Cas9 que utiliza una nanopartícula lipídica que encapsula el ARNm de la proteína Cas9 y un ARN guía dirigido a la transtirretina36.
Estabilización del tetrámero de transtirretinaEl tafamidis es un fármaco de administración oral que actúa uniéndose a la transtirretina en el lugar reservado a la tiroxina, estabilizando el tetrámero e impidiendo su disociación en unidades de bajo peso molecular, lo que finalmente consigue evitar su depósito en los tejidos y la formación del amiloide. El tafamidis fue el primer medicamento modificador de la enfermedad aprobado para el tratamiento de la polineuropatía por ATTRv en estadios iniciales37. Sin embargo, el gran protagonismo que ha adquirido esta molécula en los últimos años se debe a los resultados obtenidos en el ensayo de fase III ATTR-ACT38, en el que se incluyó a 441 pacientes con AC-ATTR (335 AC-ATTRwt y 106 AC-ATTRv) aleatorizados a recibir tafamidis meglumina (80mg o 20mg al día vía oral) o placebo durante 30 meses. El uso del fármaco se asoció con una reducción significativa del 30% de la mortalidad total y del 32% de los ingresos de causa cardiovascular, sin provocar un aumento significativo de la incidencia de efectos adversos; además, consiguió mejorar la sintomatología y la calidad de vida. El tafamidis fue superior a placebo en todos los subgrupos preespecificados salvo en el que incluía a pacientes en una clase funcional NYHA III, donde el tratamiento se asoció con una mayor incidencia de hospitalizaciones; esta observación probablemente sea reflejo del incremento de la supervivencia en un grupo en una fase avanzada de la enfermedad con una notable repercusión sintomática. Recientemente se han publicado los resultados de la fase de extensión del ensayo ATTR-ACT39, en el que tanto los pacientes incluidos inicialmente en el brazo de tratamiento como en el de placebo comenzaron a recibir desde el trigésimo mes de seguimiento una dosis diaria de 61mg de tafamidis ácido libre (bioequivalente a tafamidis meglumina 80mg). El principal hallazgo fue una reducción del 41% de la mortalidad total en el grupo tratado con el fármaco desde el principio en comparación con el tratado inicialmente con placebo, lo que enfatiza la importancia de un diagnóstico y tratamiento precoces de la AC-ATTR.
Tras la publicación del ensayo ATTR-ACT, las agencias del medicamento norteamericana y europea aprobaron el uso del tafamidis en la AC-ATTR, con lo que se convirtió en la primera molécula disponible para el tratamiento específico de esta entidad. Además, la guía europea para el tratamiento de la IC otorga un grado de recomendación I a su uso en pacientes con AC-ATTRwt o AC-ATTRv e IC en clase funcional NYHA I-II40; por su parte, la guía norteamericana, también con un grado de recomendación I, amplía su indicación a pacientes en clase funcional NYHA I-III27. Lamentablemente, el 24 de febrero de 2022 la Agencia Española de Medicamentos y Productos Sanitarios emitió una resolución de no financiación del tafamidis para el tratamiento de la AC-ATTR41, por lo que en nuestro país continúa sin estar disponible para esta indicación.
El diflunisal es un antiinflamatorio no esteroideo de administración oral que también actúa estabilizando el tetrámero de la transtirretina. En un ensayo clínico de fase III demostró reducir significativamente la progresión de la afectación neurológica en pacientes con polineuropatía por ATTRv; sin embargo, que el 56% de los pacientes no finalizasen el estudio resta valor a los resultados obtenidos42. A pesar de no disponer de la suficiente evidencia científica que justifique la prescripción de diflunisal en la AC-ATTR, se ha utilizado con cierta frecuencia en centros con gran experiencia en el tratamiento de esta enfermedad. El grupo de la Universidad de Boston ha publicado recientemente que el tratamiento con diflunisal en una cohorte de 104 pacientes con AC-ATTRwt logró una significativa mejoría de la supervivencia; sin embargo, es importante resaltar que el 40% de los pacientes en el grupo de tratamiento suspendieron el fármaco por presentar efectos secundarios, el más frecuente de ellos, el deterioro de la función renal43.
El acoramidis es el último de los fármacos estabilizadores de la transtirretina en desarrollo. Tras demostrar en un ensayo de fase II ser bien tolerado y conseguir un incremento significativo de los niveles plasmáticos de transtirretina, el ensayo clínico de fase III ATTRIBUTE-CM (NCT 03860935) está evaluando su eficacia en pacientes con AC-ATTR.
Eliminación de los depósitos de amiloideLa epigalocatequina-3-galato es la catequina más abundante en el té verde. Ha demostrado in vitro impedir la agregación de oligómeros y favorecer la degradación de las fibras de amiloide; sin embargo, por el momento no se ha probado que conlleve un beneficio clínico en la AC-ATTR44.
Las tetraciclinas, incluida la doxiciclina, han demostrado in vitro su capacidad de disgregar completamente las fibras de amiloide, efecto que se intensifica al unirse con el ácido tauroursodeoxicólico. La utilidad clínica de esta combinación en la AC-ATTR se estudió en 2 ensayos de fase II y en un pequeño estudio observacional45. Los resultados traducen una pequeña capacidad de estabilizar diversos marcadores de progresión de la enfermedad y una tolerabilidad aceptable, a pesar de que uno de los trabajos documenta una tasa de abandono del 86% atribuible a varias causas. Será interesante conocer los resultados del Doxy/TUDCA (NCT 03481972), un ensayo clínico de fase III actualmente en marcha.
Tras abandonarse la investigación con anticuerpos dirigidos al amiloide sérico P, en la actualidad se desarrollan anticuerpos específicos contra la transtirretina (PRX004, NI006) que buscan la eliminación de los depósitos de amiloide a través de la vía del complemento y la activación de macrófagos (NCT 04360434, NCT 03336580).
ConclusionesLa AC-ATTR, concretamente su subtipo wild-type, es la forma más frecuente de AC. Su diagnóstico puede confirmarse en la mayoría de los casos sin llevar a cabo estudios histológicos, con una gammagrafía con bifosfonatos y evaluando la existencia de un componente monoclonal en sangre y orina; para ello, es esencial sospechar con anterioridad la enfermedad utilizando los datos aportados por la historia clínica, la exploración física, el electrocardiograma, el ecocardiograma transtorácico y la resonancia magnética cardiaca. Su detección tiene importantes implicaciones terapéuticas: por un lado, el tratamiento de las manifestaciones cardiacas como la IC o la fibrilación auricular presenta notables diferencias respecto a su tratamiento en el contexto de otras cardiopatías; por otro, actualmente se dispone de un fármaco específico contra el proceso amiloidogénico (tafamidis) asociado a un beneficio pronóstico, y es previsible que este arsenal terapéutico se vea incrementado a corto plazo.
FinanciaciónNinguna.
Contribución de los autoresTodos los autores han contribuido por igual en la elaboración de este manuscrito.
Conflicto de interesesLos autores no declaran ningún conflicto de interés en relación con este manuscrito.