El sacubitrilo-valsartán (SV) ha demostrado reducir la mortalidad cardiovascular y los reingresos en pacientes con insuficiencia cardiaca con fracción de eyección reducida (ICFEr). Nuestro objetivo es analizar en una cohorte de pacientes ambulatorios con ICFEr de la vida real el efecto de sustituir los inhibidores de la enzima de conversión de angiotensina por SV.
MétodosRegistro retrospectivo de pacientes ambulatorios tratados con SV en un centro de tercer nivel.
ResultadosEntre 2016 y 2020, se incluyó en el estudio a 419 pacientes con una mediana de seguimiento de 34 meses. El 16,9% (IC95%, 12,49-19,51) suspendió el fármaco. La mortalidad fue de 7,17 por cada 100 pacientes/año. El 15% (IC95%, 11,58-18,42) reingresó por insuficiencia cardiaca. El 28,2% (IC95%, 23,89-32,51) mejoró la fracción de eyección, lo cual asoció una menor mortalidad cardiovascular y hospitalización por insuficiencia cardiaca (p<0,001). Esta mejoría permitió al 63,3% abandonar la indicación de dispositivos en prevención primaria. Los predictores de mejoría de la función ventricular fueron la etiología no isquémica (OR=2,85; IC95%, 1,81-4,54; p<0,001) y el menor tiempo de evolución (OR=4,9; IC95%, 2,84-8,45; p<0,001). Los pacientes con ICFEr de larga evolución también tuvieron un incremento de la fracción de eyección del ventrículo izquierdo del 5% (IC95%, 2,91-7,09) con la introducción del SV.
ConclusionesSustituir los inhibidores de la enzima de conversión de angiotensina por SV en pacientes con ICFEr asocia una mejoría significativa de la función ventricular, con un impacto directo en la morbimortalidad, beneficio que también existe en pacientes con mayor cronología de la enfermedad. Dicha mejoría también asoció una reducción en la indicación de dispositivos, especialmente en no isquémicos.
Sacubitril/valsartan (SV) has been shown to reduce cardiovascular mortality and readmissions in patients with heart failure and reduced ejection fraction (HFrEF). Our goal is to analyze in a real-life outpatient cohort of patients with HFrEF the effect of replacing angiotensin-converting-enzyme inhibitors with SV.
MethodsRetrospective registry that included outpatients treated with SV in a third-level center.
ResultsBetween 2016 and 2020, 419 patients with a median follow-up of 34 months were included; 16% (95%CI, 12.49-19.51) discontinued the drug. Mortality was 7.17 per 100 patients/year; 15% (95%CI, 11.58-18.42) had a heart failure hospitalization; 28.2% (95%CI, 23.89-32.51) improved ejection fraction, being a group with lower cardiovascular mortality and heart failure hospitalization (P<.001); 63.3% abandoned the previous indication of devices in primary prevention after initiation of SV. The predictors of improvement were the non-ischemic etiology (OR=0,35; 95%CI, 0.22-0.55; P<001) and the shortest evolution of the disease (OR=4.17; 95%CI, 2.35-7.38; P<.001). Patients with long-term HFrEF also showed improvement in left ventricular ejection fraction.
ConclusionsReplacing angiotensin-converting-enzyme inhibitors with SV in patients with HFrEF had a significative impact in left ventricular ejection fraction, which implies an improvement in cardiovascular mortality and morbidity, a benefit that also exists in patients with a longer chronology of the disease. This improvement also associated a reduction in the indication of devices, especially in non-ischemic patients.
La insuficiencia cardiaca constituye actualmente una verdadera epidemia en los países occidentales que, lejos de solucionarse, va en claro aumento. Esto se debe al incremento de la incidencia derivado de la reducción en mortalidad de enfermedades como el infarto agudo de miocardio y a la mejoría de la supervivencia por los tratamientos disponibles para la enfermedad, que aumentan, consecuentemente, su prevalencia. Por ello, el último informe del programa RECALCAR de la Sociedad Española de Cardiología1 la sitúa como uno de los principales retos del Sistema Nacional de Salud y de la cardiología, y es el primer motivo de ingreso hospitalario en mayores de 65 años2-4.
Desde los primeros ensayos clínicos a finales de la década de los 80 hasta los últimos con los inhibidores del cotransportador sodio-glucosa de tipo 2 (iSGLT2), se ha configurado un tratamiento médico que reduce la mortalidad total de los pacientes con insuficiencia cardiaca con fracción de eyección reducida (ICFEr), motivo por el que la reciente guía europea de insuficiencia cardiaca5ha abandonado el tratamiento escalonado por uno horizontal en el que se aboga por introducir lo antes posible este tratamiento.
Sin embargo, pese a los resultados del estudio PARADIGM-HF6, los inhibidores de la neprilisina y del receptor de angiotensina no se han posicionado por encima de los inhibidores de la enzima de conversión de angiotensina (IECA), lo cual ha generado controversia, al proponer como opcional la vía de la inhibición de la neprilisina cuando hay pruebas que apoyan su incorporación a los pilares básicos del tratamiento de la ICFEr.
Dada esta controversia, cobran relevancia series de la vida real que muestren el efecto de sustituir los IECA o los antagonistas de los receptores de angiotensina II (ARA-II) por sacubitrilo-valsartán (SV) en pacientes con ICFEr, cambio que, según el estudio PROVE-HF y otras series de la vida real, lleva asociado una mejoría significativa en el remodelado de estos pacientes con un aumento significativo en la fracción de eyección del ventrículo izquierdo (FEVI)7-11.
Nuestro objetivo es analizar en profundidad una cohorte de pacientes ambulatorios con ICFEr a los que se les sustituyó el IECA o ARA-II por SV para ver su evolución clínica y aquellos factores que se relacionan con un mayor aumento de la FEVI.
MétodosEstudio observacional retrospectivo llevado a cabo en el servicio de cardiología de un hospital de tercer nivel, cuyo objetivo es analizar y describir el efecto de la sustitución de los IECA o ARA-II por SV en una cohorte de pacientes consecutivos con ICFEr. Al tratarse de un estudio meramente observacional retrospectivo del seguimiento habitual de los pacientes de nuestras consultas basándose en lo recogido en las historias clínicas, no se contó con una aprobación específica del comité de ética ni con consentimiento informado específico del estudio. No obstante, los consentimientos informados de los pacientes que se sometieron a pruebas complementarias se han almacenado correctamente.
PoblaciónSe incluyó de forma consecutiva a todos los pacientes mayores de 18 años con diagnóstico de ICFEr con un grado funcional ii-iv de la New York Heart Association (NYHA) que iniciaron tratamiento con SV establecido por un cardiólogo de nuestro centro.
Se excluyó a los pacientes que iniciaron el tratamiento durante un cuadro de insuficiencia aguda, a pacientes con inicio de insuficiencia cardiaca, apacientes sin tratamiento previo con IECA o ARA-II, a aquellos con comorbilidades graves que condicionaran una expectativa de vida inferior a un año y a aquellos en los que no se podía calcular la FEVI con ecocardiografía transtorácica (ETT).
Desarrollo del estudioSe incluyó a los pacientes en el registro en la visita médica en la que se iniciaba el tratamiento con SV y se recogían antecedentes, anamnesis y grado funcional. Antes del inicio del tratamiento se había hecho a los pacientes un electrocardiograma de 12 derivaciones y una ETT basal.
El diagnóstico de ICFEr se hizo según los criterios diagnósticos de la guía europea de insuficiencia cardiaca vigente. El seguimiento posterior lo llevaba a cabo el cardiólogo que había iniciado el SV según el tratamiento clínico ajustado a la guía de práctica clínica, incluido el implante de dispositivos si estaban indicados.
Se revisaba a los pacientes en las consultas externas de cardiología con una frecuencia decidida por cada clínico, donde se incluía al menos una ETT de seguimiento a los 6 meses de haber iniciado el tratamiento. En el seguimiento se recogieron todos los eventos de muerte o trasplante cardiaco, ingreso por causa cardiovascular, ingresos por insuficiencia cardiaca e ingresos por otras causas.
Se definió FEVI mejorada la de los pacientes con FEVI basal inferior al 40% que en el seguimiento manifestaban un aumento de FEVI hasta más del 40%, si este aumento era de, al menos, el 10%.
EcocardiografíaLos estudios de ETT los llevaba a cabo la unidad de imagen de nuestro servicio con aparatos ie33 o Affinity (Philips, Países Bajos), siguiendo las recomendaciones de la cuantificación de cámaras de American Society of Echocardiography y la European Association of Cardiovascular Imaging12. La FEVI se calculaba a través del método de Simpson biplano.
Análisis estadísticoLas variables cualitativas se expresan con frecuencias y porcentajes. Las variables continuas se definen con medias y desviación estándar o mediana y rango intercuartílico, según proceda dependiendo de la prueba de normalidad de Kolmogorov-Smirnov. Se utilizó la prueba de χ2 o la prueba exacta de Fisher para comparar variables categóricas y la prueba de la t de Student o la de Mann-Whitney para comparar variables cuantitativas, según correspondía. Se utilizó la regresión de Cox para el estudio multivariante y se incluyeron en el modelo las variables que presentaron significación en el análisis bivariante. Se verificó el supuesto de riesgos proporcionales. Se hizo un análisis de supervivencia de mortalidad global y del combinado mortalidad u hospitalización por insuficiencia cardiaca, comparando, además, las curvas entre pacientes con FEVI mejorada y el resto de la serie mediante la prueba de log-rank (Mantel-Cox). La significación estadística se estableció para el valor de p<0,05. El análisis estadístico se hizo con el programa R4.1.0 y el SPSS versión 24.0 (Armonk, Estados Unidos).
ResultadosEntre el 1 de noviembre de 2016 y el 31 de diciembre de 2020 se incluyó a 419 pacientes, 311 varones (74,22%), con una mediana de edad de 69 años (Q1-Q3: 60-76). Se detectó una elevada prevalencia de factores de riesgo cardiovascular: 66,59% de hipertensión arterial, 59,67% de dislipidemia y 41,53% de diabetes mellitus. El ritmo del electrocardiograma basal era sinusal en el 65,5% y de fibrilación auricular en el 34,5%.
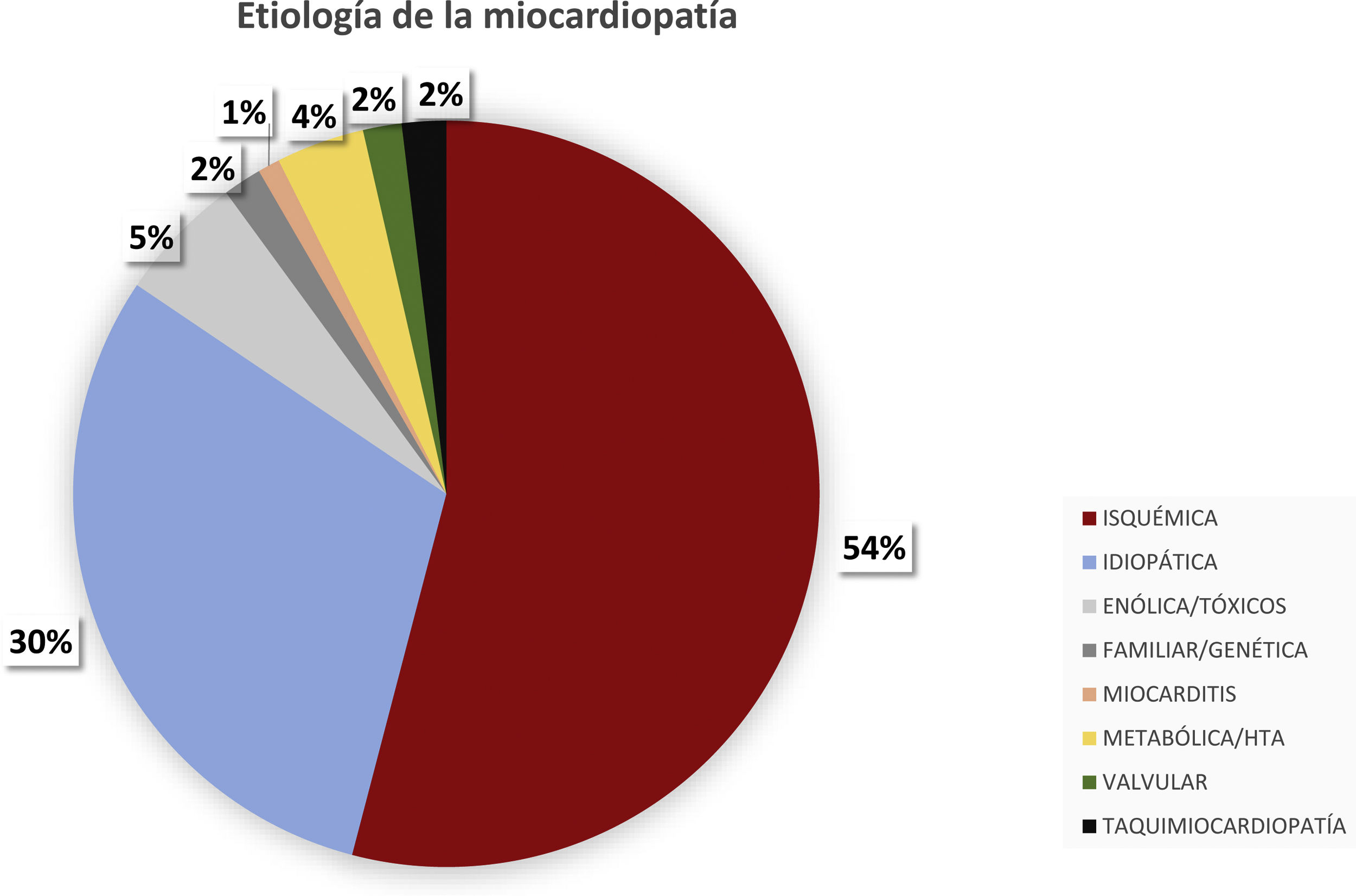
La etiología de la ICFEr se muestra en la figura 1; la miocardiopatía dilatada isquémica fue la causa más frecuente (226 pacientes; 53,94%).
El tratamiento médico basal antes de iniciar SV incluía bloqueadores β en el 94,51%, antagonistas de los receptores de mineralocorticoides en el 70,88%, ivabradina en el 12,89%, digoxina en el 9,55% y el 3,3% recibía tratamiento con iSGLT2.
Se analizó el tiempo de evolución de la ICFEr desde la aparición de la enfermedad hasta el momento del inicio del SV, que fue inferior al año en el 27,4%, de entre 1 y 5 años en el 28,2% y de larga evolución, superior a 5 años, en el 44,4%.
Tras un seguimiento mediano de 34 meses (Q1-Q3: 22-42 meses), se alcanzó la dosis máxima de SV en 70 pacientes (16,7%) y la de 49/51mg en 147 (35,1%); 202 pacientes (48,2%) quedaron con la dosis de 24/26mg. La dosis de bloqueadores β fue equivalente a 2,5mg de bisoprolol en 175 (42%), equivalente a 5-7,5mg en 124 (30%) y equivalente a 10mg en 82 (20%). La dosis de antagonistas de los receptores de mineralocorticoides alcanzada fue baja en 243 (58%) y alta en 231 (55%).
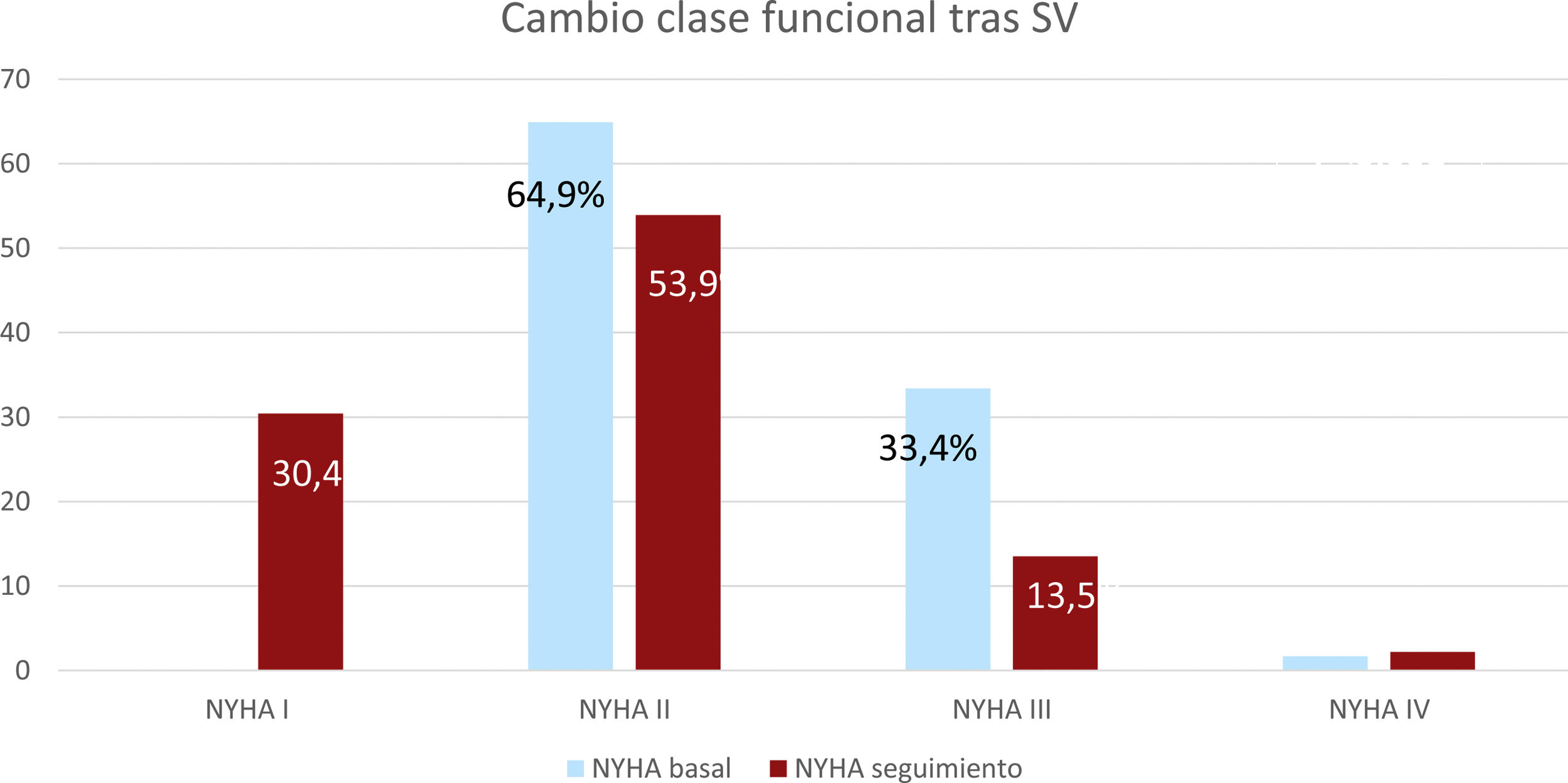
La FEVI basal era del 32% (Q1-Q3: 26-36) y en el seguimiento del 39% (Q1-Q3: 32-45) (p<0,001). El grado funcional basal y tras el tratamiento con SV se muestra en la figura 2.
Un total de 132 pacientes (31,5%) eran portadores de dispositivos al inicio del tratamiento: 88 (21%) de un desfibrilador automático implantable (DAI), 32 (7,6%) de desfibrilador y terapia de resincronización cardiaca (DAI-TRC) y 12 (2,9%) de TRC-P. De los pacientes que no portaban dispositivos, 147 (35% de la población total) tenían una FEVI inferior al 35% al inicio y, tras el seguimiento, 93 pacientes (63,3%) experimentaron un incremento de la FEVI que les permitió superar este umbral. Este grupo que superó el umbral del 35% estaba mayormente representado por pacientes no isquémicos (57) en comparación con los isquémicos (36; p=0,003).
Eventos durante el seguimientoUn total de 153 pacientes (36,5%) presentaron algún ingreso, 91 de ellos (59,5%) por causa cardiovascular debido a insuficiencia cardiaca descompensada (63 pacientes, 69,2%, lo que supone el 15% del total de la muestra, con IC95%, 11,58%-18,42%), síndrome coronario agudo (12; 13,2%), arritmias ventriculares (9; 9,9%), accidente vascular cerebral (3; 3,3%), isquemia arterial aguda de miembros inferiores (1; 1,1%), tromboembolia pulmonar (1; 1,1%), endocarditis (1; 1,1%) y bloqueo auriculoventricular (1; 1,1%). La tasa de reingreso anual media fue del 14,5%. Además, 27 pacientes (6,4%) desarrollaron fibrilación auricular de novo y 15 (3,6%) presentaron un accidente vascular cerebral en el seguimiento.
Se registraron 85 fallecimientos (20,3%), 45 (52,9%) de etiología cardiovascular: insuficiencia cardiaca (27; 60%), tormenta arrítmica (2; 4,44%), muerte súbita (10; 22,22%), síndrome coronario agudo (3; 6,67%), endocarditis (2; 4,44%) y accidente vascular cerebral (1; 2,22%). La tasa de mortalidad total fue del 7,17 por cada 100 pacientes/año.
Pacientes con fracción de eyección del ventrículo izquierdo mejoradaUn total de 118 pacientes (28,2%; IC95%, 23,89-32,51) de nuestra población alcanzaron los criterios de FEVI mejorada en el primer control de ETT realizado en el seguimiento. La comparación de las características clínicas basales frente al resto de la serie y el análisis univariante se muestran en la tabla 1. En la tabla 2 se muestra el análisis multivariante para identificar los predictores que condicionan una mejoría de la función ventricular de nuestra serie.
Comparación entre los pacientes con mejoría de FEVI y el resto de la serie
| Características clínicas | Totaln (%) | Mejoría de FEVIn (%) | p | OR (IC95%) | |
|---|---|---|---|---|---|
| No (n = 301) | Sí (n= 118) | ||||
| Edad (rango) | 69 (60-76) | 69 (59-76) | 67 (59-75) | 0,65 | - |
| Varones | 311 (74) | 234 (78) | 77 (65) | 0,015a | 0,55 (0,34-0,89) |
| Hábito tabáquico | 116 (28) | 77 (26) | 39 (33) | 0,65 | 1,14 (0,64-2,04) |
| SAOS/EPOC | 119 (28) | 86 (29) | 33 (28) | 0,4 | 1,28 (0,71-2,32) |
| HTA | 279 (67) | 209 (69) | 70 (59) | 0,07 | 0,66 (0,42-1,04) |
| DM | 174 (42) | 130 (43) | 44 (37) | 0,53 | 0,86 (0,55-1,35) |
| DLP | 250 (60) | 187 (62) | 63 (53) | 0,09 | 0,68 (0,43-1,05) |
| Etiología no isquémica | 226 (54) | 186 (62) | 40 (34) | <0,001a | 2,85 (1,81-4,54) |
| Enf. arterial periférica | 44 (11) | 29 (10) | 15 (2) | 0,75 | 0,86 (0,36-2,13) |
| Insuficiencia renal | 111 (27) | 89 (30) | 22 (19) | 0,07 | 0,58 (0,34-1) |
| Filtrado glomerular | 76 (59-91) | 76 (58-91) | 76 (63-89) | 0,3 | - |
| AVC previo | 60 (14) | 48 (16) | 12 (10) | 0,13 | 2,13 (0,88-5) |
| Demencia | 16 (4) | 14 (5) | 2 (2) | 0,13 | 4,34 (0,54-33,3) |
| Depresión | 63 (15) | 42 (14) | 21 (18) | 0,76 | 0,89 (0,44-1,81) |
| NT-proBNP | 1,464 (656-3,240) | 1,702 (771-3,322) | 1,269 (550-2,932) | 0,3 | - |
| Anemia | 161 (38) | 113 (38) | 48 (41) | 0,57 | 1,17 (0,68-2,04) |
| Ferropenia | 229 (54) | 154 (51) | 75 (63) | 0,45 | 0,80 (0,45- 1,43) |
| Tratamiento basal | |||||
| Bloqueadores beta | 393 (95) | 286 (95) | 110 (93) | 0,28 | 0,6 (0,23-1,54) |
| ARM | 297 (71) | 208 (69) | 89 (75) | 0,22 | 1,37 (0,83-2,22) |
| Ivabradina | 54 (13) | 38 (13) | 16 (14) | 0,87 | 1,05 (0,56-2) |
| Digoxina | 40 (10) | 34 (11) | 6 (5) | 0,06 | 0,43 (0,17-1,08) |
| Dosis del fármaco | |||||
| 24-26mg | 202 (48,2) | 148 (49) | 54 (46) | 0,45 | 0,77 (0,43-1,4)b |
| 49-51mg | 147 (35,1) | 108 (36) | 39 (33) | 0,67 (0,36-1,24)b | |
| 97-103mg | 70 (16,7) | 45 (15) | 25 (21) | ||
| Tiempo de evolución | |||||
| <1 año | 115 (27) | 60 (20) | 55 (47) | <0,001a | 4,9 (2,84-8,45)b |
| 1-5 años | 118 (28) | 86 (29) | 32 (27) | 2,05 (1,15-3,63)b | |
| >5 años | 186 (45) | 155 (51) | 31 (26) | ||
Análisis univariante de factores predictores de mejoría de FEVI. Las variables cuantitativas se expresan como mediana (rango intercuartílico) y las cualitativas, como n (%).
ARM: antagonistas de los receptores de mineralocorticoides; AVC: accidente vascular cerebral; DLP: dislipidemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; NT-proBNP: N-terminal propéptido natriurético cerebral; NYHA: clasificación funcional de la New York Heart Association; SAOS: síndrome de apnea obstructiva del sueño.
Análisis multivariante de predictores de mejoría de FEVI
| Variables | OR | IC95% | p | |
|---|---|---|---|---|
| Li | Ls | |||
| Varones | 0,69 | 0,41 | 1,17 | 0,17 |
| HTA | 0,66 | 0,39 | 1,10 | 0,11 |
| DLP | 1,13 | 0,68 | 1,88 | 0,64 |
| Etiología no isquémica | 2,54 | 1,54 | 4,22 | <0,001 |
| Insuficiencia renal | 1,43 | 0,79 | 2,59 | 0,24 |
| Digoxina | 0,43 | 0,16 | 1,12 | 0,08 |
| Tiempo de la enfermedada | ||||
| <1 año | 4,17 | 2,35 | 7,38 | <0,001 |
| 1-5 años | 2,28 | 1,25 | 4,15 | 0,007 |
Calibración: porcentaje de pacientes con recuperación de FEVI, observado 31,68%, pronosticado 18,32%.
Discriminación: porcentaje de concordancia de recuperación FEVI 38,84%; porcentaje de concordancia de no recuperación FEVI 91,19%. Test de Hosmer-Lemeshow χ2 4,98; p=0,764. Estadística c (0,728); p<0,001.
DLP: dislipidemia; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IC95%: intervalo de confianza del 95%; Li: límite inferior; Ls: límite superior; OR: odds ratio.
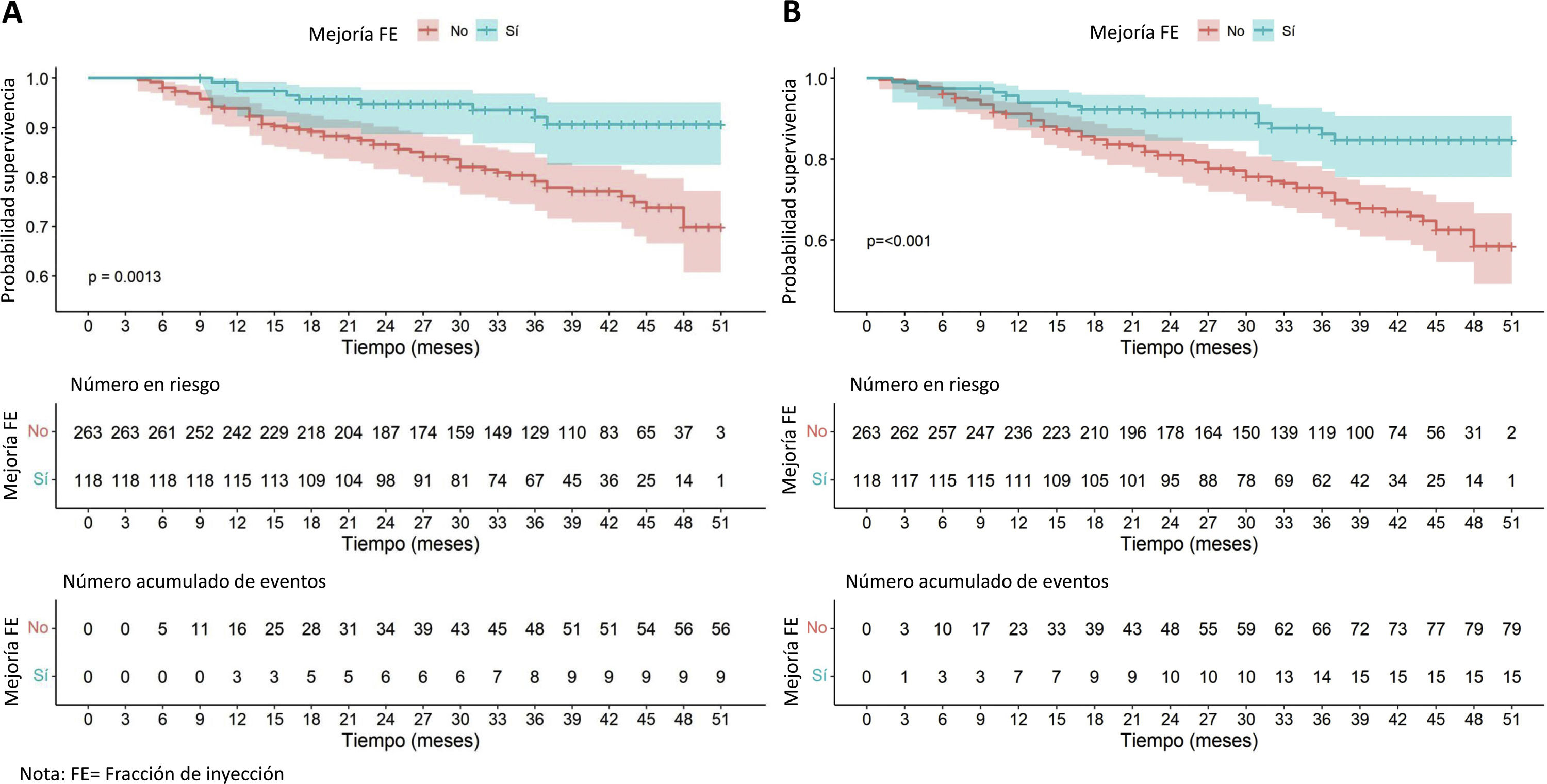
Los pacientes con FEVI mejorada presentaron mayor supervivencia en comparación con el resto de la serie (fig. 3), solo destacan 9 fallecimientos entre los 118 pacientes con FEVI mejorada. En cuanto al objetivo combinado de muerte u hospitalización por insuficiencia cardiaca, el grupo que mejoró la FEVI también mostró un beneficio estadísticamente significativo.
Pacientes con insuficiencia cardiaca de larga evoluciónEl subgrupo de pacientes que iniciaron SV tras al menos 5 años de evolución de la enfermedad fue de 172. El seguimiento mediano de este subgrupo fue de 37,5 meses (25-46), durante el que un 54,7% mantuvo la misma clase funcional y el 33,5% la mejoró, el número de pacientes en clase funcional NYHA I-II aumentó y hubo una mejoría estadísticamente significativa de la clase funcional de la serie en el seguimiento (p<0,05).
En cuanto a la FEVI, se observa una mediana de mejora tras introducir SV del 5% (0-10; IC95%, 2,91-7,09) y el 16,7% del total alcanzó criterios de FEVI mejorada.
Pacientes que suspendieron el fármacoSuspendieron el fármaco 71 pacientes, lo que supone el 16,9% (IC95%, 12,49-19,51); 40 (56%) lo hicieron por hipotensión, 9 (13%) por intolerancia, 8 (11%) por motivos económicos, 5 (7%) por deterioro de la función renal, 4 (6%) por hiperpotasemia y los 5 restantes (7%) por otras razones. Entre los pacientes a los que se les suspendió el SV, en el 31% se sustituyó por un IECA, en el 35% por un ARA-II y en el 34% se suspendió sin alternativa terapéutica.
Al analizar este subgrupo de pacientes que suspendió el SV, hemos documentado que estos 71 pacientes concentran un 29% de la mortalidad de la serie, por lo que hay diferencias de mortalidad entre los que suspendieron el fármaco y los que lo mantuvieron (35,2 frente a 17,3% de mortalidad en el seguimiento; p<0,001).
DiscusiónSe usó el SV en nuestra serie en una población muy similar a la del estudio fundamental PARADIGM-HF6, compuesta en su mayoría por varones (74,22 y 79%, respectivamente), con miocardiopatía isquémica (53,9 frente a 59,9%), en clase funcional II de la NYHA (65,4 frente a 71,6%) y con una FEVI similar (31 frente a 29,6%). Por el contrario, en nuestra serie los pacientes eran de edad más avanzada (69 frente a 63 años), con mayor proporción de diabéticos (41,5 frente a 34,7) y de pacientes tratados con antagonistas de los receptores de mineralocorticoides (70,9 frente a 54,2%). Pese a no contar con periodo de preacondicionamiento previo a la inclusión como en el ensayo fundamental, la tasa de suspensión del fármaco también ha sido escasa (16,9% frente a 18% del ensayo clínico). En cuanto a la baja tasa inicial de prescripción de iSGLT2, cabe destacar que se inscribió al 87% de la muestra antes de los estudios fundamentales de iSGLT2 en ICFEr y que, a la luz de las nuevas pruebas en los últimos años de seguimiento de esta serie13,14, se aprecia un aumento de su prescripción, que alcanzó el 14,1% de penetrancia, cuando basalmente solo estaba en el 3,3%.
En cuanto a los dispositivos, el tratamiento con SV produjo un incremento de la FEVI del que se puede concluir, aunque con muchas limitaciones, que reduce la necesidad de su implante. En nuestra serie, concretamente entre los pacientes no portadores de DAI al inicio del estudio y que tenían indicación de implante en prevención primaria, el 63,3% experimentó un incremento de la FEVI que le permitió superar el umbral del 35%, cifras similares a las de otros estudios15,16. Quizás la lectura más apropiada es la que se hace últimamente, bajo la cual, aparte de la fracción de eyección, es preciso identificar a los pacientes con alto riesgo arrítmico debido a la reducción progresiva de muerte súbita que se ha apreciado en los distintos ensayos clínicos fundamentales17. Así, en aquellos pacientes con miocardiopatía dilatada no isquémica y buenos predictores de remodelado ventricular con el tratamiento médico, se podría plantear posponer la indicación del DAI más allá de los 3 meses mínimos recogidos en las guías18.
Respecto a los resultados pronósticos globales de nuestro estudio, en un seguimiento de 34 meses de una cohorte con ICFEr hemos obtenido una tasa anual media de reingresos por insuficiencia cardiaca del 14,5%, una mortalidad total del 20,3%, similar a la de otras series19 y una tasa de mortalidad anual cercana al 8%, también muy parecida a la de series de pacientes ambulatorios de registros europeos20,21 y que reinciden en el mal pronóstico de la ICFEr. Respecto a estos resultados, debemos destacar una mediana de edad de 69 años en nuestra serie así como que en el 44% habían transcurrido más de 5 años desde el inicio a su inclusión en el estudio, lo que habla del perfil de riesgo de la muestra.
En cuanto al remodelado, en nuestra serie el 28,2% de la muestra (118 pacientes) llegó a mejorar la FEVI: salieron del grupo de FEVI reducida y pasaron a FEVI mejorada. Son, por tanto, cifras muy contundentes para no tratarse de un subgrupo de pacientes con inicio de ICFEr y que va en línea de lo ya comentado sobre los pacientes con miocardiopatía dilatada no isquémica, que fueron los que más experimentaron este remodelado (hasta el 40,4% respecto al 17,7% de los pacientes con miocardiopatía isquémica).
En nuestra muestra, los factores predictores de mejoría de función ventricular fueron la etiología no isquémica y el menor tiempo de evolución de la enfermedad, ambos factores también plasmados en otros estudios22-27. En cuanto al sexo femenino y la ausencia de digoxina en el tratamiento, predictores de mejoría de FEVI en otros manuscritos22,25, nuestra población mostró una elevada proporción de mujeres y una menor proporción de uso de dicho fármaco en el grupo de FEVI mejorada, aunque ambos factores no fueron significativos en el análisis multivariante. En cuanto a dichos predictores, merece mención especial el menor tiempo de evolución de la enfermedad, por ser a priori el único factor modificable por el propio clínico. Por último, cabe destacar que la mejoría de la FEVI se produce en nuestra serie independientemente de la dosis alcanzada de SV, lo cual aboga por el beneficio de SV también en dosis bajas.
Esto cobra especial relevancia, ya que los pacientes que mejoraron la FEVI mostraron un claro beneficio en términos de mortalidad cardiovascular y de reingresos por insuficiencia cardiaca frente a los que no mostraron dicha respuesta, como se ha plasmado en otros estudios22,28. En cualquier caso, los pacientes con FEVI mejorada representan un grupo no exento de morbimortalidad y sobre el que se requiere mantener un seguimiento y continuar con el tratamiento. Su suspensión se asocia a un nuevo empeoramiento29 y además se sabe que a medio-largo plazo la trayectoria de la FEVI vuelve a descender en muchas etiologías24.
Por otro lado, llama la atención la presencia de un subgrupo numeroso de pacientes con insuficiencia cardiaca de larga evolución (>5 años del inicio) en los que se consideró que ya se había establecido un tratamiento médico óptimo, pero en los que la sustitución de IECA o ARA-II por SV condujo a una mejoría tanto de clase funcional como de FEVI, con hasta un 16% de pacientes que salieron del grupo de FEVI reducida, lo cual aboga por evitar la inercia farmacológica en estos pacientes. Es cierto, sin embargo, que el remodelado, aunque también presente en este subgrupo, era más frecuente en los pacientes con menor tiempo de evolución: más proporción de remodelado en pacientes con tiempo de evolución de 1-5 años y aún mayor en pacientes con menos de un año desde el diagnóstico.
Por último, hay que destacar la alta mortalidad del subgrupo de pacientes que suspendió el SV. Esto tiene 2lecturas: por un lado, aquellos que suspenden el fármaco pierden el beneficio pronóstico que este les confiere y, por otro lado, existen subgrupos concretos de pacientes con peor pronóstico (clase funcional más avanzada, insuficiencia renal, etc.) que precisamente tienen peor tolerancia al fármaco, lo cual influye en el resultado comentado. De hecho, en nuestra muestra el 42% de los que lo suspendieron estaban en clase iii/iv.
ConclusionesEste estudio de la vida real muestra el impacto de sustituir los IECA y ARA-II por SV en pacientes con ICFEr; su relevancia reside en el tamaño de la muestra, el prolongado tiempo de seguimiento y el simple hecho de ser de la vida real. En nuestra serie, la introducción precoz del SV parece asociarse a un mayor aumento del remodelado, pero también existe beneficio en pacientes con mayor cronología de insuficiencia cardiaca, lo cual es una aportación peculiar de nuestra serie y consideramos que tiene interés.
Por otro lado, hasta el 40% de las miocardiopatías dilatadas no isquémicas mejoraron la FEVI, lo que tiene importancia, dada la reciente reducción del grado de recomendación del implante de DAI en prevención primaria en este subgrupo, fruto de los resultados del DANISH30. Habría, por ello, que intentar avanzar en identificar a aquellos pacientes con menor riesgo arrítmico en los que el SV se convierte en una herramienta fundamental para mejorar la FEVI y salir del umbral del implante de dispositivos, al tiempo que se evita posponer su indicación en casos con alto riesgo arrítmico.
LimitacionesSe trata de un estudio unicéntrico y realizado exclusivamente con los pacientes que comenzaron tratamiento con SV; no se dispone de grupo control, lo que supone un perfil concreto de paciente analizado y puede implicar un sesgo de selección en la muestra. Además, durante el seguimiento se tomaron otras medidas terapéuticas, como el ajuste de la dosis del tratamiento médico de ICFEr, lo cual pudo influir en la mejoría de la FEVI observada en el estudio.
Por otro lado, se trata de un estudio de la vida real y no disponemos de herramientas como cuestionarios de calidad de vida o pruebas de capacidad funcional, que hubieran aportado información adicional.
- •
El SV ha demostrado reducir la mortalidad cardiovascular y los ingresos por IC en pacientes con ICFEr, con un perfil de seguridad demostrado, por lo que actualmente se recomienda en pacientes con ICFEr que persisten sintomáticos a pesar del tratamiento médico óptimo.
- •
Nuestro estudio representa una de las cohortes con mayor seguimiento de nuestro país del uso del SV en la vida real.
- •
Al excluirse a pacientes naive, con insuficiencia cardiaca aguda o primera aparición de esta, nuestro estudio revela el beneficio en la vida real que podría suponer el recambio del IECA/ARA-II por SV en el paciente ambulatorio con ICFEr.
- •
El uso de SV en pacientes con insuficiencia cardiaca crónica parece asociarse a una mejoría en la clase funcional y en la FEVI, incluso en pacientes con tiempo largo de evolución de la enfermedad.
Todos los autores participaron activamente en el estudio, realizando la recogida de datos y el seguimiento de los pacientes. C. Palacios, A. Grande y G. Barón-Esquivias analizaron e interpretaron los datos, hicieron el análisis estadístico y redactaron el manuscrito. Todos los autores están de acuerdo con los resultados y el manuscrito final.
FinanciaciónEste estudio no recibió ninguna subvención específica de agencias de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesNo existen conflictos de intereses.