La coexistencia de estenosis aórtica (EA) y enfermedad renal crónica (ERC) se asocia a mayor mortalidad. Nuestro objetivo fue evaluar la evolución de la EA grave después del recambio valvular aórtico (RVA) frente al tratamiento conservador (TtC) según el estadio de la función renal.
MétodosSe incluyeron 452 pacientes consecutivos ≥18 años de edad diagnosticados de EA grave (área valvular aórtica <1cm2 (indexada <0,6 cm2/m2) o gradiente medio transvalvular ≥40mmHg) desde abril de 2009 a septiembre de 2019, con valores de creatinina sérica en situación hemodinámica estable disponibles 2 meses antes o después del ecocardiograma. El objetivo principal fue la mortalidad global y el secundario la mortalidad cardiovascular.
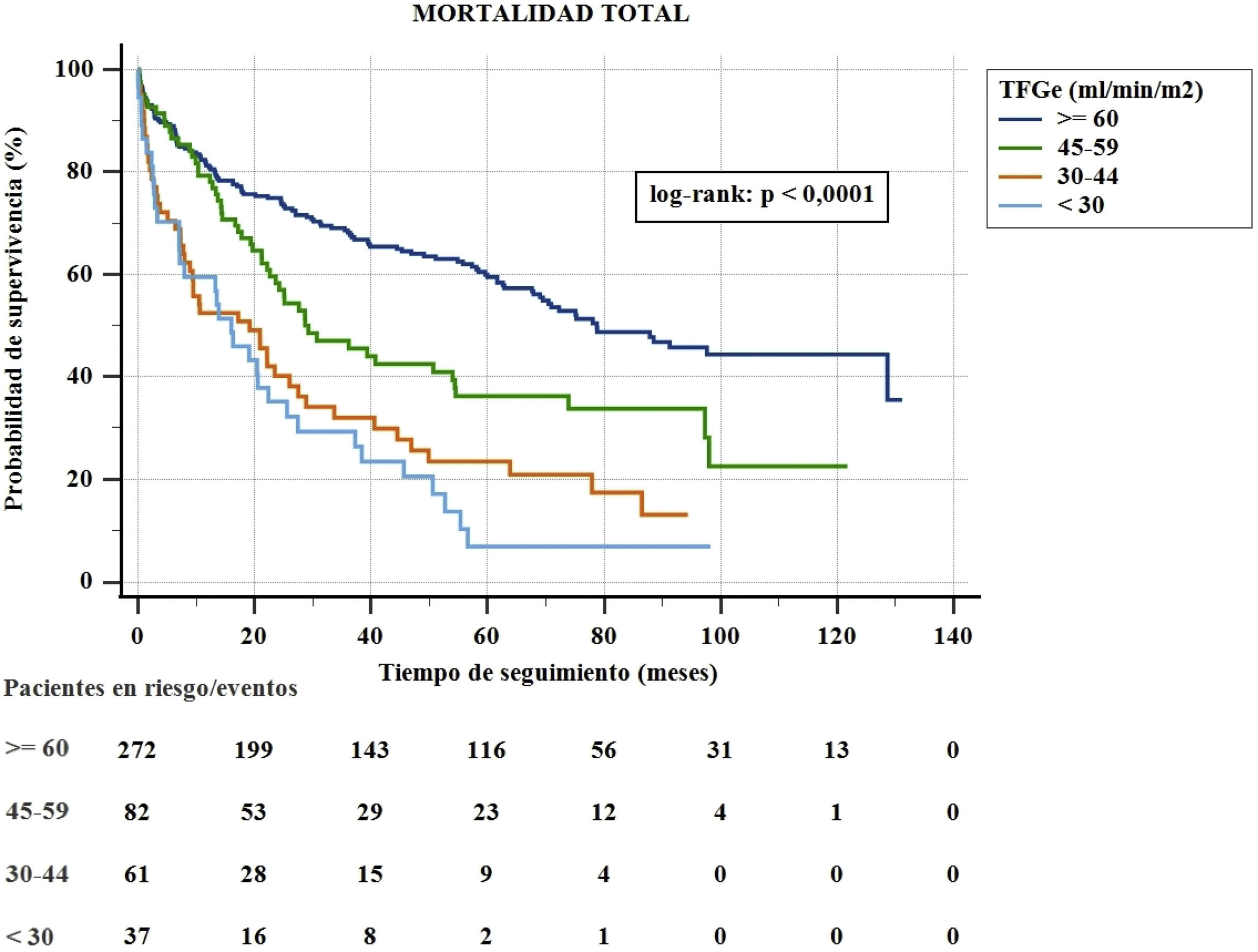
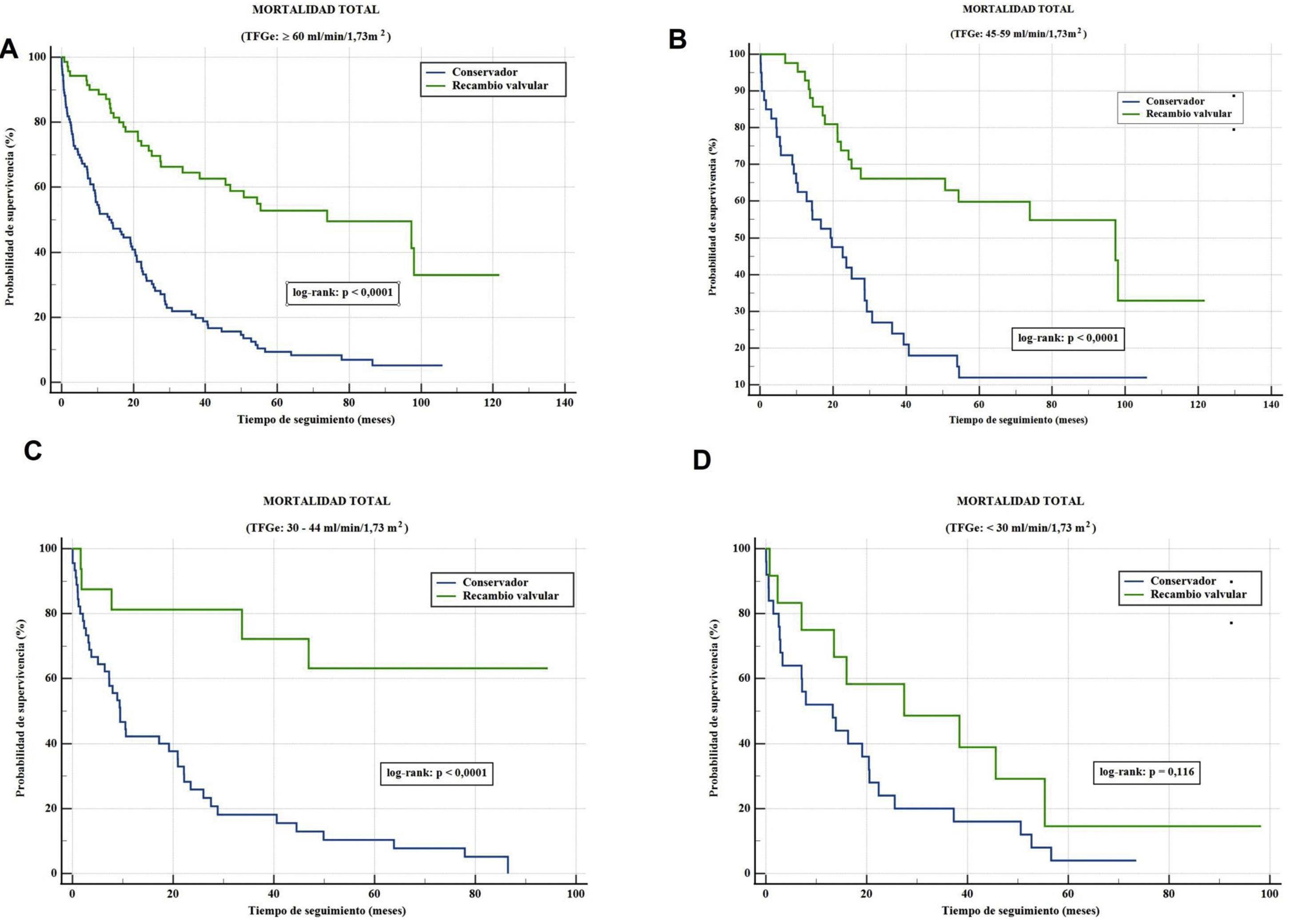
ResultadosLa mediana de supervivencia fue de 52,7 (IC95%, 40,7-64,7) meses (78,7; IC95%, 60,2-97,3) en los pacientes con función renal normal; 28,7 (IC95%, 15,1-42,2) con ERC ligera; 19,2 (IC95%, 5,8-32,5) con ERC moderada y 16,0 (IC95%, 9,0-23,0) con ERC grave (log-rank, p<0,0001). La supervivencia tras el RVA fue mayor que con TtC en pacientes con función renal normal, ERC ligera y ERC moderada (todos log rank, p<0,0001). No hubo diferencia en aquellos con ERC grave (log-rank, p=0,12).
ConclusionesEn pacientes con EA grave el deterioro de la función renal se asoció con un aumento de la mortalidad global y cardiovascular. Aunque los pacientes con ERC tienen mayor mortalidad después del RVA, este se asoció con mayor supervivencia respecto al TtC en la ERC leve y moderada.
The coexistence of aortic stenosis (AS) and chronic kidney disease (CKD) has been associated with increased mortality. Our objective was to compare the evolution of severe AS after aortic valve replacement (AVR) or conservative management according to stage of renal function.
MethodsBetween April 2009 and September 2019, we consecutively recruited 452 patients aged ≥18 years and diagnosed with severe AS [aortic valve area < 1cm2 and/or mean transvalvular gradient ≥40 mmHg)], and for whom serum creatinine values were available for the 2 months before or after an echocardiogram. The main endpoint was overall mortality, and the secondary endpoint was cardiovascular mortality.
ResultsMedian survival was 52.7 (95%CI, 40.7-64.7) months (78.7; 95%CI, 60.2-97.3) months in patients with normal renal function; 28.7 (95%CI, 15.1-42.2) months in patients with mild CKD; 19.2 (95%CI, 5.8-32.5) months in patients with moderate CKD, and 16.0 (95%CI, 9.0-23.0) months in those with severe CKD (log-rank test, P < .0001)]. Survival after AVR was higher than that achieved with conservative treatment in patients without renal failure and mild or moderate CKD (all log-rank tests, P < .0001), while no difference was detected in those with severe CKD (log-rank test, P = .12).
ConclusionsIn patients with severe AS the deterioration of renal function is associated with an increase in global and cardiovascular mortality. Although patients with CKD experience higher mortality after AVR, they also experience higher survival rates than those receiving conservative treatment for mild and moderate CKD.
La estenosis aórtica (EA) es la valvulopatía más común en los países desarrollados, y afecta especialmente a la población mayor1. La EA sintomática conlleva mal pronóstico sin recambio valvular aórtico (RVA)2. El RVA como tratamiento de la EA grave reduce la mortalidad respecto al tratamiento conservador (TtC)3,4.
La enfermedad renal crónica (ERC) es un factor asociado a mayor tasa de progresión de la EA5,6. Aunque con el RVA se consigue una mayor supervivencia7,8, la ERC conlleva un aumento de la mortalidad tras el RVA quirúrgico (RVAq) o transcatéter (RVAt)9-11, que puede contribuir a que se limite su indicación en este grupo de pacientes12–15.
A pesar del alto riesgo de la EA concomitante con ERC, no existen recomendaciones específicas sobre el manejo de estos pacientes16–21. Poco se sabe sobre la repercusión pronóstica de los diferentes estadios de la ERC en pacientes con EA grave.
En este estudio, nuestro objetivo fue evaluar la evolución de la EA grave según la función renal, y el efecto del RVA en relación con el TtC según el estadio de la ERC.
MétodosPoblación de estudioLa población del estudio se reclutó retrospectivamente a partir de pacientes ≥18 años atendidos entre abril de 2009 y septiembre de 2019, diagnosticados en nuestra institución de EA valvular grave (área valvular aórtica [AVA] 1cm2 o indexada <0,6cm2/m2, o gradiente medio transvalvular ≥40mmHg)16 con indicación de RVA según las guías clínicas vigentes en el momento, y cuyos valores de creatinina sérica obtenidos en condiciones hemodinámicas estables estuvieron disponibles durante 2 meses antes o después del ecocardiograma. La tasa de filtración glomerular estimada (TFGe) se determinó mediante la ecuación de colaboración en epidemiología de la enfermedad renal crónica (CKD-EPI), basada en los valores de creatinina sérica12. La población de estudio se dividió en 4 grupos según la TFGe: normal, TFGe≥60ml/min/1,73m2; ERC leve, TFGe de 45 a 59ml/min/1,73m2; ERC moderada, TFGe de 30 a 44ml/min/1,73m2, y ERC grave, TFGe<30 ml/min/1,73m2.
Los criterios de exclusión fueron: a) estenosis subvalvular y supravalvular; b) intervención valvular previa; c) cardiopatía congénita (excepto válvula bicúspide), y d) pacientes con indicación de RVA en lista de espera.
Los datos demográficos y las características clínicas se extrajeron de las historias clínicas electrónicas. Los pacientes se consideraron sintomáticos si presentaban angina, disnea, síncope o insuficiencia cardiaca congestiva, que el médico evaluador atribuyó secundaria a EA. La cardiopatía isquémica se definió como infarto de miocardio previo, injerto de derivación de arteria coronaria o intervención coronaria percutánea.
El estudio fue aprobado por un comité de ética independiente y realizado de acuerdo con las políticas institucionales, los requisitos legales nacionales y los principios revisados de la Declaración de Helsinki.
EcocardiografíaLos datos ecocardiográficos se obtuvieron utilizando 2 equipos de ultrasonido Vivid E9 y Vivid E95 (GE Healthcare Medical Systems, Noruega). La velocidad del flujo aórtico se obtuvo con un doppler de onda continua en múltiples posiciones del transductor. Los gradientes transvalvulares se calcularon utilizando la fórmula de Bernoulli modificada y el AVA utilizando la ecuación de continuidad. Se promediaron 3 mediciones consecutivas para pacientes en ritmo sinusal o 5 para pacientes en fibrilación auricular. La fracción de eyección del ventrículo izquierdo (FEVI) se calculó mediante el método de Simpson. La masa y dimensiones del ventrículo izquierdo (VI), tamaño de aurícula izquierda y presión sistólica arterial pulmonar se calcularon según las guías de práctica clínica22,23.
SeguimientoLos pacientes fueron seguidos hasta el 30 de junio de 2021. La fecha de inclusión en el estudio fue la fecha del ecocardiograma inicial que mostró EA grave. Dada la naturaleza retrospectiva del estudio, se renunció al consentimiento informado. Las decisiones sobre la derivación para RVA fueron tomadas por el equipo de cardiología, incluidos cardiólogos y cirujanos, con base en las pautas de práctica vigentes y el riesgo operatorio. El criterio de valoración principal fue la mortalidad por todas las causas debido a la influencia recíproca que ejercen la EA y la ERC en el pronóstico de ambas entidades, así como en otras enfermedades concomitantes. El criterio de valoración secundario fue la mortalidad cardiovascular. La mortalidad perioperatoria se definió como la muerte que se produjo dentro de los 30 días posteriores al RVA, o durante la hospitalización si el paciente estuvo hospitalizado por un periodo más prolongado. La fecha de la muerte y la naturaleza de la muerte se determinaron a partir de la revisión de las historias clínicas electrónicas. El análisis de supervivencia continuó hasta el último día de seguimiento o la fecha de muerte. El estado vital de los pacientes no obtenidos de las historias clínicas electrónicas se consultó a través de las bases de datos nacionales de defunción.
Análisis estadísticoLas variables continuas se expresan como medias (±2DE) o medianas (rango intercuartílico), y las categóricas como porcentajes. Los distintos grupos se compararon mediante análisis de varianza (ANOVA), realizando análisis post hoc para discernir las diferencias entre pares de medias con la corrección de Bonferroni o de Games-Howell si las varianzas eran distintas. Se examinó la importancia de las diferencias entre el grupo de referencia y los demás si eran significativas entre grupos. Las variables continuas se compararon utilizando la t de Student o el test U de Mann-Whitney. Se utilizó el estadístico χ2 de Pearson o la prueba exacta de Fisher para examinar la asociación entre las variables categóricas iniciales y las de grupos.
Se realizó un análisis univariante de las variables incluidas mediante las curvas de supervivencia acumulada de Kaplan-Meier, estimándose su significación con el test de rangos logarítmicos. El análisis multivariado se realizó usando el modelo de regresión múltiple de riesgos proporcionales de Cox, incluyendo las variables independientes seleccionadas previamente mediante el análisis univariante con nivel de significación p<0,1, así como las variables consideradas clínicamente relevantes (edad, FEVI, sexo y RVA). Se utilizó en método de inclusión por pasos, ajustando el modelo final con el estadístico de razón de verosimilitudes. Todas las pruebas fueron bilaterales, con un nivel de significación p<0,05. Los análisis estadísticos se realizaron utilizando el software SPSS® versión 20.014 (MedCalc Software Ltd, Bélgica; 2021).
ResultadosCaracterísticas basalesInicialmente se incluyó a 548 pacientes diagnosticados de EA grave. Se excluyó a 48 pacientes asintomáticos con FEVI conservada, 5 por no disponer de analítica, 15 por reunir criterios de exclusión y 28 por seguimiento incompleto. La población de estudio consistió en 452 pacientes (221 varones [48,9%]), edad media 77,9±9,44 años y TFGe media 63,8±22,2ml/min/1,73m2. La mediana de la TFGe fue 67 (IQ 46,7-81,3) ml/min/1,73m2. La función renal fue normal en 272 pacientes (60,2%) y 180 pacientes (39,8%) tenían ERC: 82 (18,1%) ERC leve (TFGe 45-59ml/min/1,73m2), 61 (13,5%) ERC moderada (TFGe 30-44ml/min/1,73m2) y 37 (8,2%) ERC grave (TFGe <30ml/min/1,73m2). Entre los pacientes con ERC grave, 2 estaban en diálisis de mantenimiento.
La media de seguimiento global fue de 42,4 meses (±35,6). Las características de la población se presentan en la tabla 1.
Características basales de la población de estudio según estadio de enfermedad renal crónica
| No ERC (n=272) | ERC ligera (n=82) | ERC moderada (n=61) | ERC grave (n=37) | Valor de p | |
|---|---|---|---|---|---|
| Edad | 75,3±10,2 | 81,1±6,4a | 83,2±6,2a | 82,3±6,4a | 0,0001 |
| Sexo, mujeres | 130 (47,8) | 52 (56,1) | 36 (59,0) | 19 (51,4) | 0,30 |
| Hipertensión | 179 (65,8) | 72 (87,8)a | 52 (85,2)b | 30 (81,1)b | 0,0001 |
| Diabetes mellitus | 99 (36,4) | 32 (39,0) | 28 (45,9) | 19 (51,4) | 0,21 |
| EPOC | 64 (23,6) | 23 (28,0) | 20 (32,8) | 9 (24,3) | 0,55 |
| FA | 67 (24,8) | 37 (45,1)a | 26 (42,6)b | 10 (27,8) | 0,01 |
| Valvulopatía mitral | 45 (16,6) | 21 (25,6) | 17 (24,3) | 9 (24,3) | 0,10 |
| Hemoglobina (g/dl) | 12,6±1,1 | 12,3±1,8 | 11,5±1,7a | 11,2±1,9a | 0,001 |
| Enfermedad coronaria | 30 (11,1) | 14 (17,1) | 16 (22,2)b | 8 (22,2)c | 0,01 |
| Índice de Charlson | 5,2±2,0 | 7,0±2,4a | 8,2±1,8a | 8,5±2,0a | 0,0001 |
| EuroSCORE II | 2,6±1,9 | 4,4±4,0a | 6,2±3,0a | 7,0±5,0a | 0,0001 |
| Síntomas | 249 (91,5) | 75 (91,4) | 57 (93,4) | 35 (94,6) | 0,20 |
| Disnea | 214 (78,6) | 63 (76,8) | 52 (85,2) | 29 (78,3) | 0,57 |
| Area valvular aórtica (cm2) | 0,78±0,1 | 0,75±0,1 | 0,80±0,1 | 0,75±0,1 | 0,53 |
| Gradiente medio (mmHg) | 46,6±10,4 | 44,7±10,8 | 44,7±7,7 | 54,1±9,4 | 0,50 |
| FEVI | 58,2±11,2 | 54,8±12,0c | 56,4±10,7c | 55,2±13,9 | 0,05 |
| Presión sistólica arterial pulmonar | 45,6±13,3 | 51,4±14,7b | 53,8±14,7c | 52,6±14,4c | 0,001 |
| Mortalidad global | 122 (44,8) | 52 (63,4)b | 47 (77,0)a | 33 (89,1)a | 0,0001 |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo.
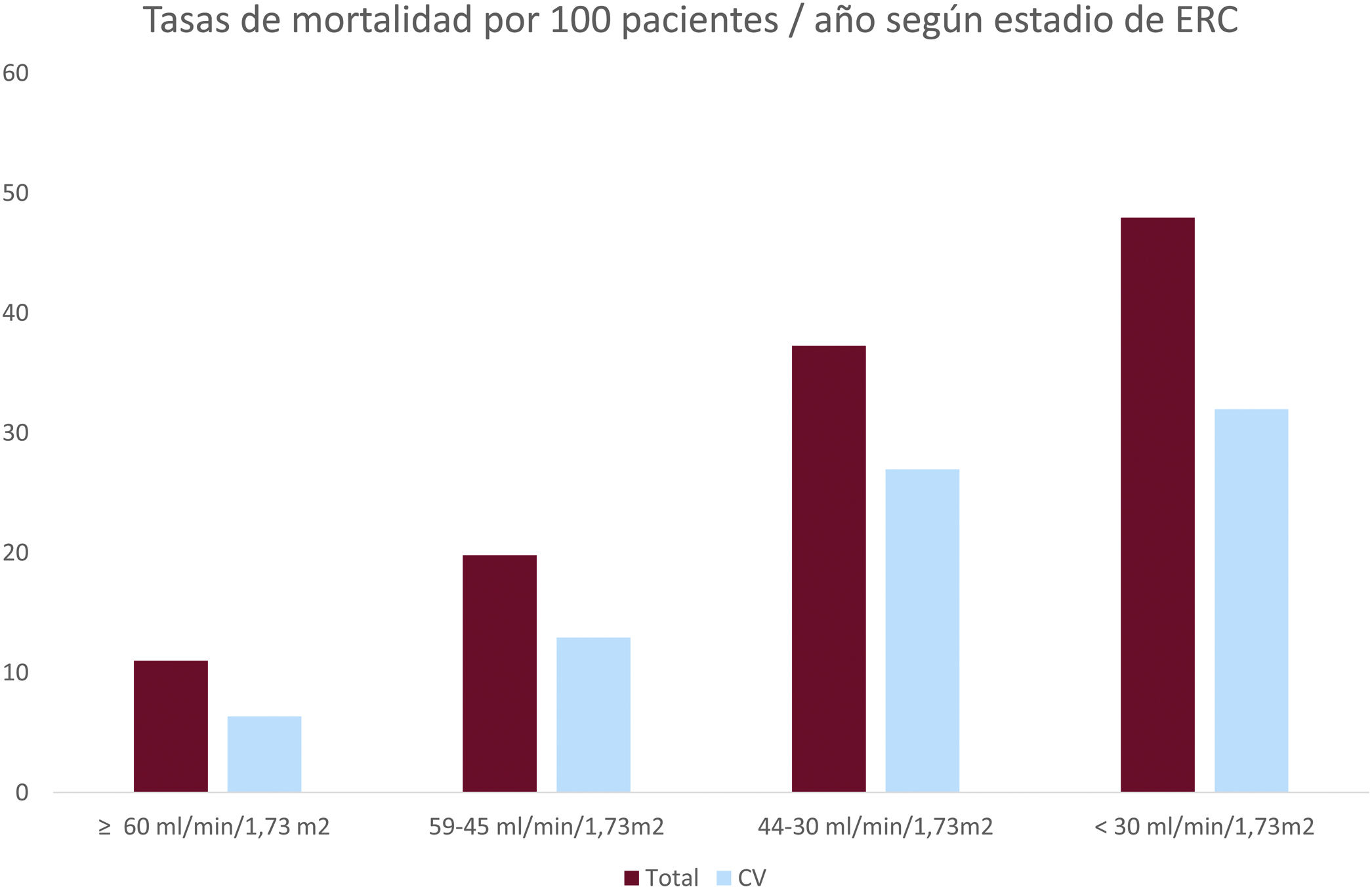
Durante el seguimiento se registraron 255 muertes (16,2/100 pacientes/año), 163 de las cuales fueron de origen cardiovascular (10,3/100 pacientes/año). La mediana de supervivencia global fue 52,7 (IC95%, 40,7-64,7) meses: 78,7 (IC95%, 60,2-97,3) para pacientes sin ERC, 28,7 (IC95%, 15,1-42,2) para pacientes con ERC leve, 19,2 (IC95%, 5,8-32,5) para pacientes con ERC moderada y 16 (IC95%, 9,0-23,0) para pacientes con ERC grave (test de log-rank p<0,0001) (fig. 1).
La mortalidad global y cardiovascular aumentó a medida que disminuyó la TFGe considerada como variable categórica (tabla 1). La mortalidad cardiovascular representa alrededor de 2/3 de la mortalidad general (fig. 2). El análisis univariante de los factores relacionados con la mortalidad total en la población global se muestra en la tabla 2. En el análisis multivariante, la supervivencia se asoció de forma independiente con RVA (HR = 4,65; IC95%, 3,42-6,31; p<0,0001), mayor FEVI (HR = 0,98; IC95%, 0,97-0,99; p<0,01), dislipemia (HR = 1,58; IC95%, 1,23-2,05; p<0,0001) y menor índice de Charlson (HR = 1,18; IC95%, 1,12-1,25; p<0,0001).
Análisis univariante con el método de Kaplan-Meier de los factores relacionados con la mortalidad total
| Global - | FGR≥60ml/min/1,73m2 | FGR<60 ml/min/1,73m2 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| N | 452 | 272 | 180 | ||||||
| N | Fallecimiento | Test de log-rank | N | Fallecimiento | Test de log-rank | N | Fallecimiento | Test de log-rank | |
| Valor de p | Valor de p | Valor de p | |||||||
| Sexo | |||||||||
| Varón | 221 | 121 (54,7) | 0,61 | 142 | 68 (47,8) | 0,42 | 79 | 53 (67,0) | 0,50 |
| Mujer | 231 | 133 (57,5) | 130 | 54 (41,5) | 101 | 79 (78,2) | |||
| Edad | |||||||||
| ≥75 años | 322 | 210 (65,2) | 0,0001 | 169 | 93 (55,0) | 0,0001 | 153 | 117 (76,4) | 0,09 |
| <75 años | 130 | 44(33,8) | 103 | 29 (28,1) | 27 | 15 (55,5) | |||
| HTA | |||||||||
| Sí | 333 | 189 (56,7) | 0,80 | 179 | 76 (42,4) | 0,15 | 154 | 112 (72,7) | 0,71 |
| No | 119 | 65 (54,6) | 93 | 46 (49,4) | 26 | 19 (73,0) | |||
| DM | |||||||||
| Sí | 178 | 110 (61,7) | 0,02 | 99 | 49 (49,5) | 0,18 | 79 | 61 (77,2) | 0,30 |
| No | 274 | 144 (52,5) | 173 | 73 (42,2) | 101 | 71 (70,3) | |||
| Dislipemia | |||||||||
| Sí | 235 | 111 (47,2) | 0,0001 | 142 | 51 (35,9) | 0,001 | 93 | 60 (64,5) | 0,06 |
| No | 217 | 143 (65,8) | 130 | 71 (54,6) | 87 | 72 (82,7) | |||
| Índice de Charlson | |||||||||
| >5 | 339 | 224 (66,0) | 0,0001 | 171 | 27 (15,7) | 0,0001 | 168 | 129 (76,7) | 0,005 |
| ≤5 | 113 | 30 (26,5) | 101 | 95 (94,0) | 12 | 3 (25,0) | |||
| FEVI | |||||||||
| ≤50% | 80 | 56 (70,0) | 0,002 | 42 | 26 (61,9) | 0,03 | 38 | 30 (78,9) | 0,06 |
| >50% | 369 | 195 (52,8) | 229 | 95 (41,4) | 140 | 100 (71,4) | |||
| EPOC | |||||||||
| Sí | 116 | 77 (66,3) | 0,0001 | 64 | 36 (56,2) | 0,002 | 52 | 41 (78,8) | 0,27 |
| No | 335 | 176 (52,5) | 207 | 85 (41,0) | 128 | 91 (71,1) | |||
| Valvulopatía mitral | |||||||||
| Sí | 92 | 68 (73,9) | 0,0001 | 45 | 28 (62,2) | 0,02 | 47 | 40 (85,1) | 0,21 |
| No | 359 | 185 (51,5) | 226 | 93 (41,1) | 133 | 92 (71,1) | |||
| Cardiopatía isquémica | |||||||||
| Sí | 68 | 44 (64,7) | 0,13 | 30 | 16 (53,3) | 0,50 | 38 | 28 (73,6) | 0,90 |
| No | 382 | 208 (54,4) | 241 | 105 (43,5) | 141 | 103 (73,0) | |||
| FA | |||||||||
| Sí | 140 | 94 (67,1) | 0,0001 | 67 | 39 (58,2) | 0,01 | 73 | 55 (75,3) | 0,15 |
| No | 309 | 157 (50,8) | 203 | 81 (39,9) | 106 | 76 (71,7) | |||
| RVA | |||||||||
| Sí | 233 | 72 (30,9) | 0,0001 | 171 | 43 (25,1) | 0,0001 | 62 | 29 (46,7) | 0,0001 |
| No | 219 | 182 (83,1) | 101 | 79 (78,2) | 118 | 103 (87,2) | |||
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; FGR: filtrado glomerular renal; HTA: hipertensión arterial; RVA: recambio valvular aórtico.
Los datos expresan n (%) o media±desviación estándar.
Durante el seguimiento, 171 pacientes con función renal normal recibieron RVA (15,3/100 pacientes/año), 135 recibieron RVAq (12,0/100 pacientes/año) y 36 recibieron RVAt (3,2/100 pacientes/año) y 45 de estos recibieron cirugía combinada coronaria o valvular (4,0/100 pacientes/año).
Las características basales y ecocardiográficas de la población sin ERC según el tratamiento (RVA frente a TtC) se presentan en las tablas 3 y 4, respectivamente.
Características de la población de estudio según estadio y tratamiento de la enfermedad renal crónica
| N=452 | TFGe≥60ml/min/1,73m2(n 272) | TFGe 59-45ml(n 82) | TFGe 44-30ml(n 61) | TFGe<30ml(n 37) | ||||
|---|---|---|---|---|---|---|---|---|
| Conservador(n 101)(37,1) | RVA(n 171)(62,9) | Conservador(n 45)(54,8) | RVA(n 37)(45,2) | Conservador(n 46)(75,4) | RVA(n 15)(24,6) | Conservador(n 27)(73) | RVA(n 10)(27) | |
| Edad | 81,1±8,5 | 71,9±9,5a | 84,2±5,9 | 77,6±5,1a | 84,8±5,5 | 78,7±5,8a | 83,8±6,1 | 76,2±4,0a |
| Índice de Charlson | 6,1±2 | 4,7±1,8a | 7,5±2,6 | 6,4±2,0c | 8,4±2,0 | 8,0±1,4 | 9,1±1,7 | 7,3±2,3c |
| EuroSCORE II | 2,9±1,8 | 2,5±2,0c | 5,4±5,1 | 3,1±1,6a | 6,3±3,1 | 5,8±2,7 | 6,4±3,8 | 7,7±7,5 |
| Sexo, mujer | 51 (50,5) | 79 (46,2) | 29 (64,4) | 17 (45,9) | 29 (63) | 7 (46,7) | 14 52) | 5 (50) |
| Diabetes | 42 (41,6) | 57 (33,3) | 21 (46,7) | 11 (29,7) | 19 (41,3) | 9 (60) | 16 (59,2) | 3 (30) |
| Hipertensión | 63 (62,4) | 116 (67,8) | 38 (84,4) | 34 (91,9) | 38 (82,6) | 14 (93,3) | 23 (85,1) | 7 (70) |
| EPOC | 32 (30,5) | 32 (19,3)c | 15 (32,6) | 8 (22,2) | 15 (32,6) | 5 (33,3) | 7 (25,9) | 2 (20) |
| FA | 33 (31,7) | 34 (20,5)c | 22 (47,8) | 15 (41,7) | 19 (41,3) | 7 (46,6) | 8 (29,6) | 2 (20) |
| Valvulopatía mitral | 23 (21,9) | 22 (13,3) | 15 (32,6) | 6 (16,7) | 14 (30,4) | 3 (20) | 7 (25,9) | 2 (20) |
| Enfermedad coronaria | 11 (11,0) | 19 (11,1) | 8 (17,8) | 6 (16,2) | 10 (21,7) | 6 (40) | 6 (23,1) | 2 (20) |
| Síntomas | 83 (83,0) | 166 (97,1)a | 41 (91,1) | 34 (94,4) | 42 (91,3) | 15 (100) | 25 (92,6) | 10 (100) |
| Disnea | 76 (71,7) | 138 (83,1)c | 36 (78,3) | 27 (75,0) | 40 (87,0) | 12 (80,0) | 21 (77,7) | 8 (80) |
| Diuréticos | 56 (56,0) | 84 (51,2) | 36 (80,0) | 28 (77,8) | 37 (80,4) | 14 (93,3) | 18 (66,6) | 6 (60) |
| IECA/ARA II/ARNI | 48 (47,5) | 85 (49,7) | 27 (60,0) | 13 (35,1)b | 22 (47,8) | 5 (33,3) | 10 (37,0) | 4 (40) |
| Betabloqueantes | 29 (28,7 | 67 (39,1) | 17 (37,7) | 14 (37,8) | 18 (39,1) | 11 (73,3)b | 8 (29,6) | 4 (40) |
| Antag. Ca++ | 20 (19,8) | 36 (21,0) | 8 (17,7) | 10 (27,0) | 7 (15,2) | 6 (40,0)b | 3 (11,1) | 2 (20) |
| ACO | 29 (28,7) | 69 (40,3) | 24 (53,3) | 18 (48,6) | 21 (45,6) | 7 (46,6) | 8 (29,6) | 5 (20) |
| AAG | 38 (37,6) | 52 (30,4) | 17 (37,7) | 15 (40,5) | 19 (41,3) | 5 (33,3) | 12 (44,4) | 7 (7)b |
| RVA | 171 (62,9) | 37 (45,1) | 15 (24,6) | 10 (27) | ||||
| RVAt | 36 (21,1) | 9 (24,3) | 5 (33,3) | 3 (30) | ||||
| RVAq | 135 (79,9) | 28 (75,7) | 10 (66,6) | 7 (70) | ||||
| Prótesis biológica | 101 (59,1) | 26 (70,3) | 10 (66,6) | 7 (70) | ||||
| Prótesis mecánica | 34 (19,9) | 2 (5,5) | 0 | 0 | ||||
AAG: antiagregación; ACO: anticoagulación oral; Antag. Ca++; antagonistas del calcio; ARA-II: antagonistas del receptor de la angiotensina II; ARNI: inhibidores de la neprilisina y del receptor de la angiotensina; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IECA: inhibidores de la enzima de conversión de la angiotensina; RVA: recambio valvular aórtico; RVAt: RVA recambio valvular aórtico transcatéter; RVAq: recambio valvular aórtico quirúrgico; TFGe: tasa de filtrado glomerular estimada.
Características ecocardiográficas de la población de estudio según estadio y tratamiento de la enfermedad renal crónica
| N=452 | TFGe≥60ml/min/1,73m2(n=272) | TFGe 59-45ml(n=82) | TFGe 44-30ml(n=61) | TFGe<30ml(n=37) | ||||
|---|---|---|---|---|---|---|---|---|
| Conservador(n=101)(37,1) | RVA(n=171)(62,9) | Conservador(n=45)(55,9) | RVA(n=37)(45,1) | Conservador(n=46)(75,4) | RVA(n=15)(24,6) | Conservador(n=27)(73) | RVA(n=10)(27) | |
| AI (mm) | 47,1±18,1 | 49,8±24,3 | 57,2±19,4 | 51,5±19,8 | 55,8±19,5 | 46,7±11,4 | 44,9±1,4 | 46,7±12,4 |
| VId (mm) | 46,3±6,8 | 47,5±6,9 | 47,1±6,8 | 48,2±6,1 | 46,7±7,1 | 45,7±8,4 | 47,4±7,0 | 50,9±9,4 |
| MasaVI (g) | 248±78 | 256±77 | 239±79 | 239±58 | 239±69 | 266±75 | 241±57 | 277,8±65,8 |
| Gr Medio (mmHg) | 47,8±12,7 | 50,5±12,9 | 45,9±11,8 | 47,9±12,3 | 46,4±8,9 | 47,4±12, | 45,5±9,0 | 49,3±15,2 |
| AVA (cm2) | 0,72±0,2 | 0,69±0,2 | 0,66±0,1 | 0,67±0,1 | 0,76±0,1 | 0,69±0,1 | 0,66±0,1 | 0,69±0,1 |
| FEVI | 58,3±11,9 | 58,1±10,8 | 55,3±12,0 | 54,4±12,0 | 56,0±11,5 | 56,3±8,4 | 55,8±12,8 | 54,6±1,8 |
| TAPSE (mm) | 20,2±3,6 | 21,4±3,2 | 20,6±4,5 | 19,2±3,2 | 19,4±3,6 | 21,1±5,7 | 20,9±3,2 | 20,4±4,0 |
| PsAP (mmHg) | 50,1±14,0 | 42,8±12,1a | 55,8±16,1 | 46,8±11,6a | 54,3±19,4 | 51,9±8,5 | 55,5±14,1 | 42,5±10,8a |
AI: aurícula izquierda; AVA: área valvular aórtica; FEVI: fracción de eyección del ventrículo izquierdo; Gr medio: gradiente medio; PsAP: presión sistólica de la arteria pulmonar; TAPSE: excursión sistólica del anillo tricúspide; TFGe: tasa de filtración glomerular estimada; VId: ventrículo izquierdo en diástole.
Once pacientes (11/171: 6,4%) fallecieron durante el periodo perioperatorio. Después de una mediana de seguimiento de 45,6 (17,7-74,9) meses, la mortalidad global y cardiovascular fueron 6,2/100 pacientes/año y 2,2/100 pacientes/año, respectivamente después del RVA, y 43,8/100 pacientes/año y 32,1/100 pacientes/año, respectivamente con el TtC (todos p<0,001). La tasa de supervivencia tras RVA fue mayor que con TtC (test de log-rank, p <0,001) (fig. 3A).
Mediante análisis multivariable, la supervivencia se asoció de forma independiente con RVA (HR = 6,18; IC95%, 4,0-9,5; p<0,0001), mayor FEVI (HR = 0,98; IC95%, 0,97-0,99; p<0,05), dislipemia (HR = 1,77; IC95%, 1,22-2,58; p<0,01), y menor índice de Charlson (HR = 1,17; IC95%, 1,07-1,29; p<0,001).
Impacto del tratamiento en pacientes con enfermedad renal crónicaDurante el seguimiento, 62 pacientes (13,5/100 pacientes/año) con ERC recibieron RVA: 37 (14,1/100 pacientes/año) con ERC leve (28 RVAq [10,6/100 pacientes/año] y 9 RVAt [3,4 /100 pacientes/año]); 15 (11,9 /100 pacientes/año) con ERC moderada (10 RVAq [7,9/100 pacientes/año] y 5 RVAt [4,0/100 pacientes/año]) y 10 (14,5/100 pacientes/año) con ERC grave (7 RVAq [10,2/100 pacientes/año] y 3 RVAt [4,4/100 pacientes/año]). La cirugía combinada coronaria o valvular se realizó en 15/62 pacientes (3,3/100 pacientes/año). Las características basales y ecocardiográficas de la población según el tratamiento y estadio de ERC aparecen en las tablas 3 y 4, respectivamente.
Ocho pacientes (8/61:13,1%) fallecieron durante el periodo perioperatorio: 3 (4,9%) tenían ERC leve, 3 (4,9%) ERC moderada y 2 (3,3%) ERC grave.
Una mediana de seguimiento de 21,2 (7,2-49,9) meses reveló lo siguiente: a) En pacientes con ERC leve, la mortalidad global y cardiovascular por RVA fueron 9,5 y 3,6/100 pacientes/año, respectivamente, y 19,8 y 12,6/100 pacientes/año en el TtC (todos p <0,001), respectivamente. b) En el grupo de ERC moderada, la mortalidad global y cardiovascular por RVA fueron 9 y 5,4/100 pacientes/año, respectivamente, y 59,6 y 44/100 pacientes/año en el TtC (todos p <0,001), respectivamente. c) En los pacientes con ERC grave, la mortalidad global y cardiovascular por RVA fueron 27,5 y 13,8/100 pacientes/año, respectivamente, y 62,9 y 45,3/100 pacientes/año en el TtC (todos p=ns). La tasa de supervivencia después de RVA fue mayor que el TtC en pacientes con ERC leve y moderada (ambos, test de log-rank; p<0,0001), mientras que no se detectaron diferencias en el grupo de ERC grave (test de log-rank; p=0,12) (figs. 3B-D).
Mediante análisis multivariable, en pacientes con ERC la supervivencia se asoció de forma independiente con RVA (HR = 3,24; IC95%, 2,1-4,98; p<0,0001) y menor índice de Charlson (HR = 1,16; IC95%, 1,08-1,25; p<0,0001). Al analizar la supervivencia según el grado de ERC, esta se asoció con RVA (HR = 3,4; IC95%, 1,8-6,2; p<0,0001) y menor índice de Charlson (HR = 1,25; IC95%, 1,12-1,39; p<0,0001) en pacientes con ERC leve; y en pacientes con ERC moderada con el RVA (HR = 5,7 IC95%, 2,2-14,7; p<0.0001) y la FEVI (HR = 0,97; IC95%, 0,95-0,99; p<0,05). En pacientes con ERC grave la supervivencia se asoció con la hipertensión arterial, pero en cambio no se observó relación con el RVA.
DiscusiónEste análisis de pacientes con EA grave observados en la práctica clínica habitual muestra que: a) la ERC tuvo un impacto considerable en el pronóstico. En pacientes con EA y ERC, la disfunción renal se asoció con mayor riesgo de mortalidad cardiovascular y por cualquier causa; y b) el RVA se asoció con mejor supervivencia durante el seguimiento de los pacientes con función renal normal, ERC leve y ERC moderada.
Como ya se ha descrito en series previas5–7, los factores de riesgo cardiovascular como la edad, la hipertensión arterial, la diabetes mellitus, la presencia de fibrilación auricular, los antecedentes de ictus y la enfermedad coronaria fueron más frecuentes entre los pacientes con ERC. La presencia de ERC en pacientes con EA se asocia a una mayor mortalidad si se compara con pacientes sin ERC20–25, a lo que contribuye la mayor prevalencia de estos factores de riesgo cardiovasculares. En nuestra cohorte, los pacientes con ERC sufrieron mayor mortalidad cardiovascular, y por cualquier causa que aquellos con función renal normal (fig. 1), y esta mortalidad aumentó en los estadios más avanzados de ERC (fig. 2).
La EA sintomática tiene mal pronóstico si no se realiza RVA, y los pacientes tienen más probabilidades de morir por eventos cardiovasculares25. En nuestro estudio, después de un seguimiento medio global de 42,4 meses (±35,6), solo sobrevivieron el 16,9% de los pacientes con EA grave en ausencia de RVA, y la mortalidad cardiovascular representó el 73,6% de la tasa global de mortalidad. Según las directrices actuales, el RVA es una indicación de clase I para la EA sintomática grave17. Sin embargo, el beneficio potencial del RVA en pacientes con ERC aún no está claro, y a algunos pacientes se les niega el RVA debido a ERC. En el estudio de Bohbot et al.5, el RVA se realizó con mucha menos frecuencia en pacientes con ERC moderada o grave. En el estudio de Patel et al.7, en la mitad de los pacientes con EA grave sintomática y ERC no se realizó RVA. En nuestra población, el RVA se realizó con mucha menos frecuencia en pacientes con ERC; así, el 65,6% de pacientes con EA grave y ERC no recibieron RVA (55,9% de los pacientes con ERC leve y aproximadamente el 75% de pacientes con ERC moderada o grave).
Por otra parte, la ERC se asocia con mayor mortalidad y malos resultados después del RVA7–12. En un estudio de más de 400.000 cirugías valvulares incluidas en la base de datos de la Sociedad de Cirugía Torácica, la ERC fue un factor de riesgo importante para la mortalidad operatoria27. De manera similar, otros estudios encontraron que la ERC es un factor de riesgo independiente de malos resultados entre los pacientes sometidos a RVAt por EA9,22,26,28. En nuestra serie, el 74,9% de los pacientes con función renal normal que recibieron RVA sobrevivieron al seguimiento, porcentaje que descendió al 53,2% entre los que tenían ERC. Factores como la presencia de enfermedad pulmonar obstructiva crónica, fibrilación auricular y valvulopatía mitral se han relacionado con mayor mortalidad tras RVAt en pacientes con ERC29,30. En nuestra serie, fue el índice de Charlson el factor que se asoció de forma independiente con la mortalidad en la ERC, probablemente porque el RVA fue el factor más fuertemente asociado con la supervivencia en esta población.
El umbral del estadio de ERC más allá del cual el RVA no muestra reducción de la mortalidad no está claro. Bohbot et al.5 informaron que el RVA se asoció con una reducción considerable de la mortalidad global y cardiovascular a los 5 años en todas las etapas de la ERC. Sin embargo, otros estudios9,22,31–33 sobre el resultado del RVA han destacado un marcado aumento en el riesgo de mortalidad entre los pacientes en estadios 3b a 5 de ERC (TFGe<45ml). Nuestros resultados sugieren que el RVA no tiene ningún impacto en el pronóstico de los pacientes con TFGe por debajo de 30ml/min/1,73m2. El RVA se relacionó con una reducción de la muerte global y cardiovascular en estadios leves y moderados de ERC de nuestra serie, pero no en aquellos con ERC grave (figs. 3A-D). En la figura 1 se aprecia la baja supervivencia en los primeros 3 años de seguimiento del grupo con ERC moderada, similar a la del grupo con ERC más grave. Ello se produce porque en el grupo con ERC moderada aproximadamente el 75% de los pacientes pertenecían al grupo de TtC, la misma proporción que en el grupo con ERC más grave. Sin embargo, al observar la supervivencia según el tipo de tratamiento aplicado, las curvas se separan en el grupo con ERC moderada por el efecto beneficioso del RVA (fig. 3C), lo cual no ocurre en el grupo con ERC más grave (fig. 3D).
Estos hallazgos sugieren que, cuando el riesgo operatorio no es prohibitivo, el RVA no está contraindicado en pacientes con ERC leve o moderada, y debe considerarse con precaución (atendiendo fundamentalmente a su calidad de vida) en aquellos con ERC grave.
La insuficiencia renal es un factor determinante de la supervivencia a medio plazo en pacientes sometidos a RVA. El diagnóstico y el tratamiento de la EA en pacientes con ERC, en particular aquellos con ERC grave, requieren aportaciones colaborativas multidisciplinarias. Nuestros hallazgos respaldan la necesidad de estudios adicionales, incluidos ensayos clínicos en pacientes con ERC grave, para aclarar los beneficios de los procedimientos de RVA.
LimitacionesEste fue un estudio observacional de un solo centro, lo que limita cualquier interpretación causal, realizado a lo largo de una década en época reciente. Durante la misma han ido cambiando algunas pautas de práctica clínica y aumentando las indicaciones de RVAt con el paso de los años, con indicaciones de tratamiento conservador que actualmente irían dirigidas a RVAt.
No se incorporan los valores de péptidos natriuréticos ni troponina I, aunque realmente el valor de estos parámetros analíticos se limita a pacientes asintomáticos, los cuales tuvieron muy escasa representación en los pacientes intervenidos (tabla 3). La utilización de parámetros de laboratorio en pacientes sintomáticos, no fueron determinantes en la decisión final acerca del tratamiento a elegir.
No disponemos de las dosis de diuréticos ni del resto de fármacos administrados. De cualquier forma, pacientes con EA grave que debutan con cualquiera de los síntomas atribuibles a la enfermedad fueron considerados sintomáticos y dirigidos a tratamiento intervencionista si no había contraindicación. No existen recomendaciones sobre tratamiento farmacológico como condición previa a la indicación de tratamiento intervencionista, de modo que el tratamiento farmacológico concomitante estuvo dirigido a las comorbilidades, angina (fundamentalmente betabloqueantes), o insuficiencia cardiaca (fundamentalmente diuréticos y betabloqueantes en función de tolerancia).
La presencia de fragilidad u otras comorbilidades potencialmente mortales no incluidas en el índice de comorbilidad de Charlson y el EuroSCORE II podría haber influido en las decisiones sobre la realización o no de RVA en nuestra población. El tamaño de la muestra no nos permite establecer diferencias entre RVAt y RVAq. Se necesitan más estudios para evaluar el impacto de RVA en otros subconjuntos de pacientes con EA y ERC.
ConclusionesLa ERC en pacientes con EA grave se asocia con peores resultados clínicos. El deterioro de la función renal manifestado por la reducción de la TFGe se asocia con un aumento de la mortalidad cardiovascular y por todas las causas. Los pacientes con ERC sufren una mayor mortalidad después del RVA en comparación con aquellos sin ERC. Sin embargo, el RVA se asocia de forma independiente con mejor supervivencia en pacientes con ERC leve y moderada respecto al TtC.
Los autores asumen la responsabilidad de todos los aspectos de la realización del trabajo y la ausencia de sesgos en los datos presentados.
FinanciaciónEsta investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autoresTodos los autores han hecho contribuciones sustanciales en lo referente a: a) concepción y el diseño del estudio, adquisición, análisis e interpretación de los datos; b) redactar el artículo o revisarlo críticamente, c) aprobación de la versión final. Cada uno de los autores ha leído y está de acuerdo con el contenido del manuscrito.
Conflicto de interesesTodos los autores declaran no tener conflictos de interés.
- •
En pacientes con EA grave, la ERC empeora el pronóstico, y se asocia a una mayor mortalidad, tanto si se opta por TtC como tras un RVA.
- •
Los resultados de nuestro estudio muestran que el RVA se relacionó con una reducción de la mortalidad frente al TtC en la ERC leve y moderada, pero no mejoró la supervivencia en la ERC grave.
Abreviaturas: EA: estenosis aórtica; ERC: enfermedad renal crónica; RVA: recambio valvular aórtico; TtC: tratamiento conservador; TFGe: tasa de filtrado glomerular estimado; FEVI: fracción de eyección del ventrículo izquierdo.