La fibrilación auricular (FA) es la arritmia sostenida más frecuente en nuestro medio. La FA multiplica por cinco el riesgo de ictus, por tres el riesgo de insuficiencia cardiaca y además duplica la tasa de mortalidad1, independientemente de otros predictores conocidos de mortalidad. La FA no diagnosticada es común, especialmente en personas mayores y pacientes con insuficiencia cardiaca, y presenta riesgos similares a la FA sintomática2. Las guías de práctica clínica3 recomiendan la realización de programas de cribado, pero reconocen la falta estudios que indiquen cómo realizarlo de la forma más óptima. Además, recientemente se está incorporando un voluminoso número de dispositivos de nueva tecnología, basados en aplicaciones, teléfonos y relojes digitales en su mayoría, que permiten efectuar este cribado a nivel domiciliario. Las guías hacen hincapié en que se deben utilizar con precaución, puesto que muchos carecen de validación clínica (fig. 1).
El objetivo de nuestro estudio fue comparar tres sistemas de detección de FA con el electrocardiograma (ECG) de superficie para valorar su precisión en el diagnóstico de ritmo sinusal (RS) y de arritmia por FA. Se diseñó un estudio unicéntrico prospectivo observacional en el que incluyeron tres dispositivos a estudio:
- -
Sistema 1 AliveCor Kardia (Kardia): gracias a su monitor cardiaco mediante sensores y su aplicación Kardia permiten la detección de los impulsos y los convierten en ultrasonidos que detectan el micrófono del móvil, ofreciendo un formato similar al de un ECG convencional de una derivación.
- -
Sistema 2 Cardiio-Heart Rate Monitor (Cardiio): se trata de una aplicación que valora la frecuencia cardiaca a través de la cámara del teléfono y la luz absorbida al colocar el dedo sobre la cámara. Con cada latido, el flujo sanguíneo aumenta, causando mayor absorción de luz. Mediante un algoritmo, basado en la regularidad de los latidos, la aplicación nos indica el diagnóstico más probable.
- -
Sistema 3 WatchBP (BP): es un tensiómetro con esfingomanómetro bilateral y algoritmo de detección de FA basado en la regularidad del pulso. Si dos de cada tres mediciones detectan la fibrilación auricular, se muestra el icono Afib.
El estudio se valoró y aceptó por el comité ético de nuestro hospital.
Se seleccionaron para el estudio los pacientes con FA o aleteo auricular con indicación clínica de cardioversión eléctrica programada (CVE) que firmaron el consentimiento informado para participar en el estudio. Los pacientes se sometieron a los tres dispositivos previamente a la CVE y, posteriormente, a la misma si se conseguía paso a RS. En el caso de Kardia y Cardiio se ponía a disposición de los pacientes un teléfono móvil del hospital con las aplicaciones ya instaladas y se les indicaba como debían utilizarlo, explicando la colocación de la yema del dedo sobre la cámara en caso de Cardiio y la sujeción y posición de los dedos sobre el sensor, en el caso de Kardia. En ambos casos, era el paciente el que realizaba la medición tras dicha explicación. Para el dispositivo BP, era el propio médico quien colocaba los brazaletes del esfingomanómetro en ambos brazos del paciente y ponía en funcionamiento el dispositivo. Por tanto, el médico responsable del estudio siempre estaba presente durante la utilización de los tres dispositivos. En estos últimos, se permitía un número máximo de tres intentos. Si tras estos, el resultado era no interpretable o erróneo, se etiquetaba como tal. Se valoró el porcentaje de resultado no interpretable arrojado por cada dispositivo, su capacidad de acierto en los casos de resultado interpretable y sus valores de sensibilidad, especificidad y valores predictivos. También, se recogió el número de intentos necesarios en los casos en que el resultado sí fue interpretable. Se realizó la prueba de McNemar para las variables cualitativas de los datos nominales emparejados para comparar posibles diferencias en los resultados de los tres dispositivos estudiados.
Se incluyeron 50 pacientes, de los que un 78% fueron varones, con una edad media de 64±10 años. La arritmia que motivó la CVE fue FA en el 92% de los pacientes y aleteo en el 8%. BP preCVE dio resultado no interpretable en el 41,7%, porcentaje significativamente mayor que el de Kardia preCVE (20,5%, p = 0,041) y que el de Cardiio preCVE (13,8%, p = 0,013). En RS, los porcentajes de resultado no interpretable fueron 33,3% para BP, 17,7% para Kardia y 9,5% para Cardiio, con diferencia estadísticamente significativa únicamente entre BP y Cardiio (33,3 frente a 9,5%; p = 0,039). Si se tiene en cuenta únicamente los pacientes en los que el resultado sí fue interpretable, la comparación de la capacidad de acierto de los datos emparejados de los tres dispositivos preCVE (Kardia 97,4%, Cardiio 88% y BP 85,7%) y de los tres dispositivos postCVE (Kardia 89,3%, Cardiio 100%, BP 90,9%) no mostraron diferencias estadísticamente significativas. Previamente a la CVE, no hubo diferencias estadísticamente significativas en el número medio de intentos necesarios para el diagnóstico, que en el caso de Kardia fue 1,45, para Cardiio 1,3 y para BP 1,9. En RS, tampoco se encontraron diferencias estadísticamente significativas entre los tres métodos: 1,29 para Kardia, 1,36 para Cardiio y 1,7 para BP.
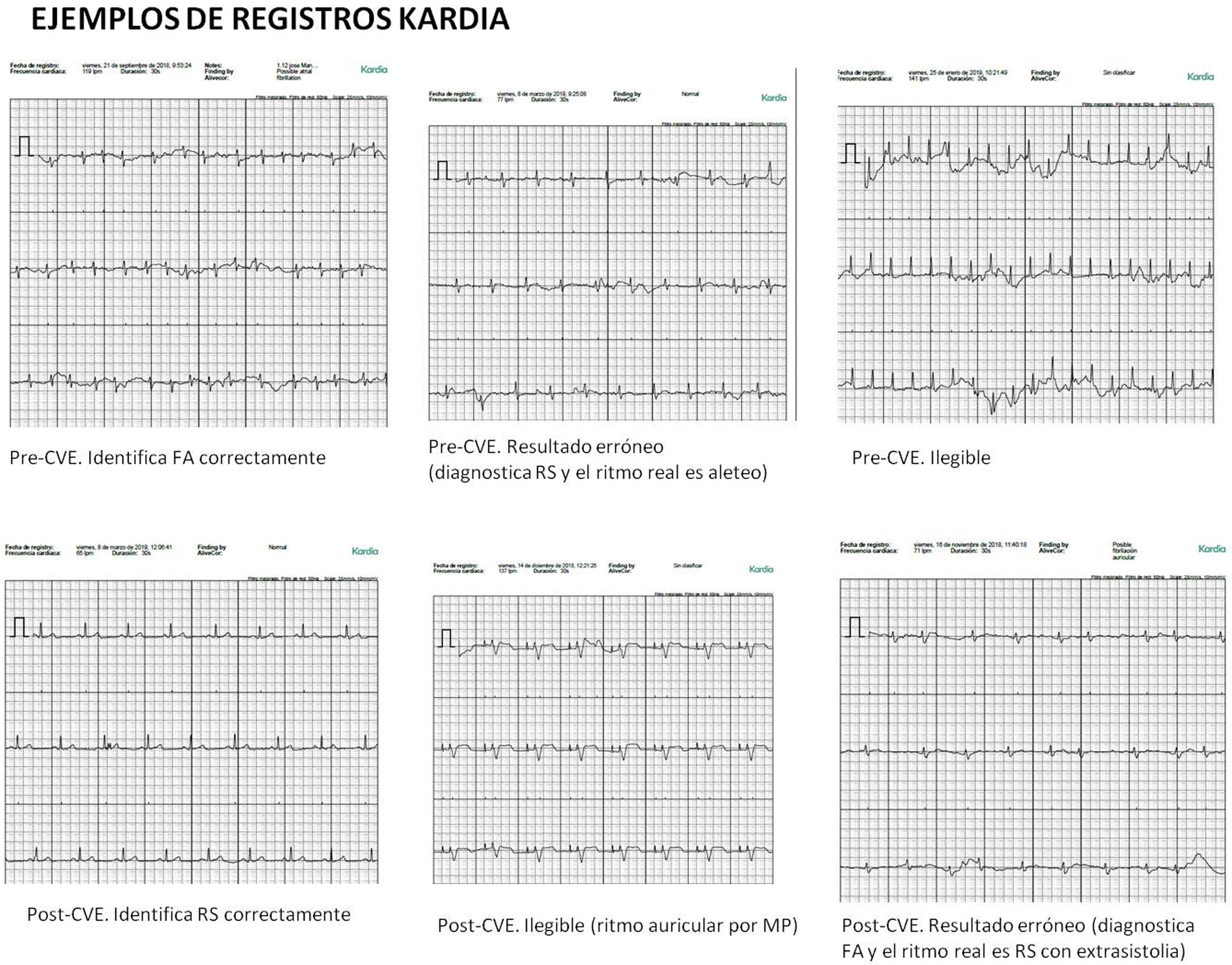
Algunos de los factores que influyeron en la falta de acierto de los dispositivos fueron: presencia de marcapasos cardiaco que dificultó la interpretación del ritmo cardiaco tanto en FA como en RS, presencia de aleteo auricular, que por su ocasional regularidad dificultó el diagnóstico de la arritmia y presencia de extrasistolia frecuente, que impidió el diagnóstico adecuado de algunos casos de RS (imagen 1). La sensibilidad (S), especificidad (E) y valores predictivos (VP) de cada dispositivo se recogen en la tabla 1.
Atendiendo a los resultados de nuestro trabajo, y en línea con publicaciones previas que han estudiado los sistemas Kardia4 y BP5, se puede concluir que el diagnóstico de FA y RS es posible con dispositivos tecnológicos portátiles accesibles para los pacientes en su domicilio. De cara a la elección de un determinado dispositivo de los tres estudiados, BP Watch muestra mayor porcentaje de resultados no interpretables, aunque permite la toma simultánea de presión arterial por lo que puede resultar útil a los pacientes debido a estas dos funcionalidades. Kardia aporta el beneficio de generar un ECG de una derivación, por lo que el diagnóstico realizado en el domicilio puede ser confirmado o descartado por un facultativo si la calidad del registro es aceptable. Cardiio presenta la ventaja de no requerir más herramientas que el teléfono móvil, por lo que puede resultar muy práctico a los pacientes. La S, E y VP son superiores al 80% para todos los dispositivos, sin diferencias estadísticamente significativas en la capacidad de acierto de los dispositivos.
Estos dispositivos podrían ser utilizados en el cribado de FA, tanto en pacientes asintomáticos que, por sus características como edad, comorbilidad cardiaca o antecedente de accidente cerebrovascular tengan mayor probabilidad de presentar un evento arrítmico y en los que, en consecuencia, el cribado pudiera resultar más rentable. También podrían ser de utilidad en pacientes con sospecha clínica de arritmia por síntomas de palpitaciones, pero en los que no haya sido posible documentar la arritmia.
Como limitaciones de nuestro estudio, se debe destacar el pequeño tamaño muestral, lo que, sumado al hecho de analizar únicamente los datos emparejados, podría suponer que la potencia estadística no fuera suficiente para encontrar diferencias entre los distintos métodos de cribado. Debemos destacar además que, pese a que los dispositivos fueron en su mayoría utilizados por los pacientes, su uso siempre se realizó en presencia de un facultativo, por lo que no se puede descartar que su empleo exclusivo por parte de los pacientes pudiera derivar en un mayor porcentaje de resultados no interpretables.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Contribución de los autoresDiseño del proyecto: J. Cosín Sales, J. Ruvira Durante. Recogida de datos: A. Andrés Lahuerta, J.A. Moro López, A. Saurí. Análisis de datos: A. Andrés Lahuerta, M. Grima López. Elaboración de la carta científica: A. Andrés Lahuerta. Corrección de la carta científica: J. Cosín Sales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.