La imagen cardiovascular es fundamental para el diagnóstico y el tratamiento de las diferentes cardiopatías. Ha habido múltiples publicaciones a lo largo del presente año, por lo que es difícil seleccionar las que representan los avances más relevantes. Hemos realizado una pequeña selección de aquello que consideramos más destacado en cada uno de los campos de la imagen cardiovascular, englobando las enfermedades más relevantes.
Cardiovascular imaging is essential for the diagnosis and treatment of different heart diseases. There have been multiple publications throughout this year, making it difficult to select those that represent the most relevant advances. We have made a small selection of what we consider to be the most outstanding in each of the cardiovascular imaging fields, encompassing the most relevant pathologies.
Entre las guías publicadas destacan las referidas a la utilización del ecocardiograma transesofágico (ETE) en la toma de decisiones en cirugía cardiaca1 y la guía sobre ecocardiografía de esfuerzo en cardiopatía isquémica2. En la primera hay una detallada descripción del uso del ETE en la valoración antes y después del procedimiento, con una excelente iconografía1. En la guía de eco de esfuerzo se detallan los diferentes tipos de estrés y los protocolos que utilizar en cada uno de ellos tanto para la realización como para la interpretación de las pruebas2.
En relación con la ecocardiografía de esfuerzo, Daubert et al. demuestran en más de 15.000 pacientes, con un seguimiento de 7 años, el impacto pronóstico del electrocardiograma (ECG). Los pacientes con ECG positivo/ecocardiograma (ECO) negativo tienen peor pronóstico que aquellos con ECG y ECO negativos. El grupo de más riesgo sigue siendo ECG y ECO positivos3.
En la última publicación del estudio EACVI NORRE se muestran los rangos de referencia normales de deformación o strain para las tres capas del espesor del miocardio, con una mayor amplitud de deformación en el subendocardio que en el subepicardio con referencias a la edad y el sexo4.
La aurícula izquierda ha centrado múltiples trabajos publicados en 2020. Thomas et al.5 sintetizan lo publicado apoyando el papel de la deformación auricular y los volúmenes auriculares mínimo y fásico como biomarcadores para evaluar la función diastólica del ventrículo izquierdo, el riesgo de fibrilación auricular y la insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo conservada. Los autores sugieren no utilizar dimensiones lineales de la aurícula izquierda por no estar relacionadas con el tamaño real de la misma. Los volúmenes de la aurícula izquierda obtenidos por imágenes bidimensional o tridimensional son fácilmente calculables y, aunque los obtenidos tridimensionalmente son más precisos, son los calculados en bidimensional los que han demostrado tener un valor pronóstico. Los parámetros de función auricular calculados mediante la evaluación fásica de los volúmenes son fiables tridimensionalmente, aunque el efecto de la edad en las funciones fásicas es controvertido. La velocidad máxima del anillo mitral en la diástole tardía (a’) se puede usar como marcador de la función contráctil de la aurícula izquierda. Además, el tiempo para alcanzar el pico de velocidad a’ desde el inicio de la onda P se ha utilizado como una medida del tiempo total de conducción auricular y ha demostrado ser un predictor de fibrilación auricular y de su recurrencia. El strain reservorio auricular permite evaluar la función auricular izquierda, es altamente reproducible, tiene valor pronóstico y ha demostrado su valor diagnóstico en la insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo conservada, aunque los valores de referencia son dependientes del fabricante5.
La inteligencia artificial es un foco de investigación creciente. Recientemente se ha evaluado un algoritmo basado en redes neuronales que proporciona una detección de anomalías de la contractilidad segmentaria ventricular en pacientes con enfermedad coronaria. Sus resultados son similares a los de ecocardiografistas experimentados y mejores que los residentes en formación. Aunque puede no ser necesaria para expertos, podría ser útil como herramienta de formación6.
La pandemia causada por coronavirus 2 (SARS-CoV2) ha cambiado el trabajo en los laboratorios de imagen. Se han publicado múltiples recomendaciones sobre cómo actuar en relación con las diferentes técnicas de imagen cardiovascular seleccionando la que mayor rentabilidad diagnóstica proporcione y menor riesgo presente en cada momento7. La imagen multimodal ha cobrado un papel clave en el manejo diario de estos pacientes8.
Avances en el intervencionismo estructural percutáneoEn 2019 se publicaron 2 interesantes documentos de consenso9,10 sobre aspectos formativos de imagen en intervencionismo, que vislumbraron la necesidad de una formación específica y complementaria con ecocardiografía y tomografía computarizada cardiaca (cardio-TC). La formación específica incluye un conocimiento extenso de la anatomía ecocardiográfica con la capacidad de trabajar en vistas no estándares y el uso apropiado de la imagen tridimensional. También son importantes aspectos no relacionados con la imagen, como el conocimiento de los diferentes dispositivos y procedimientos y la capacidad de trabajo en grupo. Las habilidades técnicas en ETE implican una mayor manipulación de la sonda, sobre todo en procedimientos largos o con mala ventana ecocardiográfica. El trabajo de Freitas-Ferraz et al.11 muestra una incidencia de complicaciones globales de ETE durante un procedimiento del 0,9% en el grupo definido como de bajo riesgo (principalmente implantes percutáneos de válvulas aórticas [TAVI]) frente al 6,1% de complicaciones en el grupo de alto riesgo (MitraClip, cierre de orejuela izquierda o de fuga paravalvular) con una odds ratio de 1,13 por cada 10 minutos de procedimiento.
En cuanto a la imagen en los diferentes procedimientos, el mayor volumen de publicaciones ha sido sobre TAVI. Destaca la publicación del seguimiento a cinco años del TAVI en la población de riesgo intermedio12 donde no se observan diferencias entre cirugía y TAVI transfemoral respecto a mortalidad e ictus. Destaca también el trabajo de seguimiento a tres años de Dauerman et al.13 centrado en la durabilidad de la prótesis CoreValve (Medtronic, Estados Unidos) en los procedimientos de valve-in-valve. La disfunción protésica en el seguimiento fue por estenosis en el 56% de los casos, insuficiencia aórtica en el 22% y doble lesión en el 21,7%. A los tres años de seguimiento, la prótesis CoreValve® mantuvo estabilidad en los parámetros hemodinámicos con una tasa de disfunción valvular del 2,7% y de reintervención del 4,4%, con un 93% de los pacientes en clase funcional I-II de la New York Heart Association. La publicación de Mangier et al.14 evalúa las prótesis SAPIEN 3® (Edwards Lifesciences, Estados Unidos) y Evolut-R PRO® (Medtronic) sobre la válvula aórtica bicúspide a un año de seguimiento, con unos resultados similares en cuanto a éxito de implante y tasa de marcapasos, aunque con mayor rotura del anillo (1,7 frente a 0%) en el grupo SAPIEN 3® y mayor fuga paravalvular moderada a grave (9,3 frente a 0%) en el grupo Evolut PRO®. Sobre la planificación del TAVI en bicúspides, es interesante el planteamiento que hace el grupo de Milán15 para la elección del dispositivo en función del perímetro valvular aórtico en lugar del perímetro en el anillo aórtico. En relación con la reparación transcatéter de la válvula mitral, destaca la publicación de marcadores ecocardiográficos pronósticos en la reparación borde con borde con MitraClip® a partir del sumatorio de áreas de la vena contracta tridimensional tras el implante16, donde un valor mayor de 0,27 cm2 identifica a los pacientes con peor respuesta clínica a 30 días. Con respecto a las prótesis percutáneas valvular mitral y tricuspídea, se ha publicado una interesante revisión17 sobre parámetros técnicos de adquisición de la cardio-TC. En cuanto a la planificación de la prótesis mitral percutánea, dos publicaciones de este año pretenden predecir mejor el riesgo de obstrucción al tracto de salida del ventrículo izquierdo18 y asientan una valoración de la calcificación anular para evitar la embolización protésica19.
En el campo de la oclusión percutánea de la orejuela izquierda, destaca la publicación de una actualización de un consenso de expertos20 donde detallan el papel de la imagen. La imagen antes del procedimiento se debería realizar para el cribado de trombos y para valorar la posibilidad del cierre percutáneo. El procedimiento se debería guiar con ETE o ecocardiografía intracardiaca. Ambas técnicas han mostrado unos resultados similares en cuanto a éxito de implante, pero mayor tiempo de procedimiento y mayor uso de contraste en los implantes con ecocardiografía intracardiaca. Tras el implante se debería realizar un seguimiento para el cribado de trombosis de dispositivo. Korsholm et al.21 han publicado un rendimiento similar entre el ETE y la cardioTC para el diagnóstico de trombosis clínicamente relevantes en el seguimiento (> 3 mm).
Avances en resonancia magnética cardiacaLa resonancia magnética cardiaca (RMC) confirma su valor pronóstico tanto en el campo de la cardiopatía isquémica como en el de las miocardiopatías. Kwong et al. muestran cómo la ausencia de realce tardío de gadolinio o isquemia en la RMC de estrés de pacientes con dolor torácico estable se asocia a una baja tasa de eventos y de necesidad de pruebas adicionales22. En una serie de más de 300 pacientes con diagnóstico de MINOCA (infarto y coronarias sin lesiones obstructivas) con seguimiento superior a tres años, el principal determinante pronóstico es el diagnóstico de miocardiopatía en la RMC y la presentación con elevación del segmento ST en el electrocardiograma23.
En relación con nuevas secuencias y herramientas de cuantificación, se debe destacar el papel del strain global longitudinal evaluado mediante RMC de rastreo de marcas (feature-tracking). Esta técnica se muestra superior a la fracción de eyección del ventrículo izquierdo y a la extensión y gravedad del infarto como predictor pronóstico del síndrome coronario agudo con elevación del ST24. Destaca también el trabajo de Treibel et al., en el que evaluaron la utilidad pronóstica del valor del T1 y el volumen del espacio extracelular en 1.700 pacientes (excluyendo amiloidosis y miocardiopatía hipertrófica). El volumen del espacio extracelular fue el parámetro que se asoció significativamente con el desarrollo de eventos a cinco años, frente al resto de parámetros marcadores de fibrosis25.
Avances en tomografía computarizada cardiacaEn el terreno de la cardiopatía isquémica, los subestudios del CONFIRM26 y del CAPIRE27 muestran la importancia de identificar la extensión de la ateroesclerosis para establecer la evolución clínica de los pacientes. En el estudio SCOT-HEART, la presencia de placas no calcificadas de baja atenuación predice la aparición de infarto agudo de miocardio en cardiopatía isquémica estable28.
Diferentes trabajos muestran la posibilidad y utilidad de detectar la reserva fraccional de flujo mediante TC en los servicios de urgencias29 y en el seguimiento a un año con menor necesidad de revascularización, muerte cardiovascular e infarto en pacientes con reserva fraccional de flujo mediante TC negativa30. Además, el estudio de perfusión miocárdica con cardio-TC cobra relevancia en los estudios de estrés miocárdico y realce tardío31.
Entre las publicaciones relacionadas con el intervencionismo, destacan las publicaciones ya mencionadas previamente en relación con protocolos de adquisición en el intervencionismo mitral y tricuspídeo17. Para la planificación del implante de TAVI se están evaluando protocolos de baja radiación32 y equipos de tercera generación de doble fuente y pitch ultraelevado33.
En cuanto a los avances tecnológicos, la gran mayoría de los artículos se relacionan con la evolución de modelos de aprendizaje automático (machine learning) que incluyen la cuantificación del calcio coronario34,35, de la reserva fraccional de flujo mediante TC36 y de la caracterización de la placa de ateroesclerosis37. Para descartar amiloidosis concomitante38 es muy prometedora la posibilidad de determinar el volumen extracelular mediante cardio-TC en aquellos pacientes subsidiarios de TAVI.
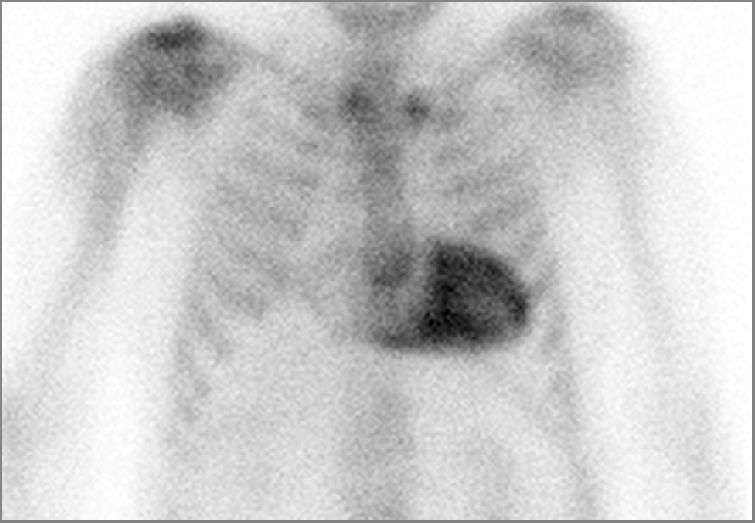
Cardiología nuclearSe han publicado las recomendaciones del consenso de expertos para el uso de la imagen multimodal en amiloidosis cardiaca, un artículo de bases y estandarización39 y otro de criterios diagnósticos y uso apropiado39,40, donde se describen todas las técnicas de imagen cardiaca: ECO, RMC, TC y cardionuclear, y donde se definen la importancia de la gammagrafía cardiaca con derivados fosfonados marcados con 99mTc para el diagnóstico de la amiloidosis cardiaca de tipo transtirretina (fig. 1), con una sensibilidad y especificidad de casi el 100%. También definen el uso de los radiofármacos para la tomografía por emisión de positrones (PET) selectivos de amiloide cerebral, 11C-PIB, 18F-Florbetapir y 18F-Florbetaben, en su indicación a nivel cardiaco para estudiar la amiloidosis cardiaca de cadenas ligeras. Además, se comenta cómo evaluar la disautonomía simpática cardiaca con 123I-MIBG, con valor pronóstico en la amiloidosis cardiaca, y menciona que el flujo sanguíneo miocárdico absoluto y la reserva de flujo coronario se reducen sustancialmente en estos pacientes.
En el campo de la endocarditis infecciosa, el metanálisis de Mahmood et al.41 define la PET/TC como una herramienta de diagnóstico complementaria muy útil en los casos complejos, especialmente endocarditis de válvula protésica. También permite detectar focos extracardiacos clínicamente relevantes, embolias, malignidad y otras fuentes de inflamación que inciden en la conducta terapéutica. Murphy et al.42, comparan la guía de la Sociedad Europea de Cardiología y la de la American Heart Association y muestran las diferencias de uso e indicaciones entre ambas; las guías europeas son las que tienen un mayor uso de la PET/TC. El uso pronóstico de la PET/TC se muestra en el artículo de Diemberger et al.43 en el que los pacientes con dispositivos intracardiacos implantados infectados se benefician en supervivencia y morbilidad del uso de esta técnica para la toma de decisiones clínicas.
Avances en cardio-oncologíaEn muchos centros hay un interés creciente en cardio-oncología, limitado debido a la falta de recursos44. La disfunción miocárdica por cardiotóxicos empeora el pronóstico total de los pacientes a medio y largo plazo45. Estratificar el riesgo de cardiotoxicidad durante todo el proceso del cáncer46 y optimizar el consumo de recursos son clave para potenciar estrategias de prevención47. La imagen cardiaca juega un papel fundamental como herramienta diagnóstica y pronóstica48,49. En numerosas publicaciones, incluidas las guías ESMO50, el strain total longitudinal se consolida como una herramienta clave en la prevención de eventos51,52. Pero no todos los pacientes necesitan un estudio completo, ya que estructurar el seguimiento con ECO dirigidos permite priorizar recursos53. Así mismo, la pandemia de COVID-19 ha permitido reevaluar las indicaciones electivas, preferentes y urgentes de las técnicas de imagen que deberemos implementar para consolidar una estructura estable de cardio-oncología54.
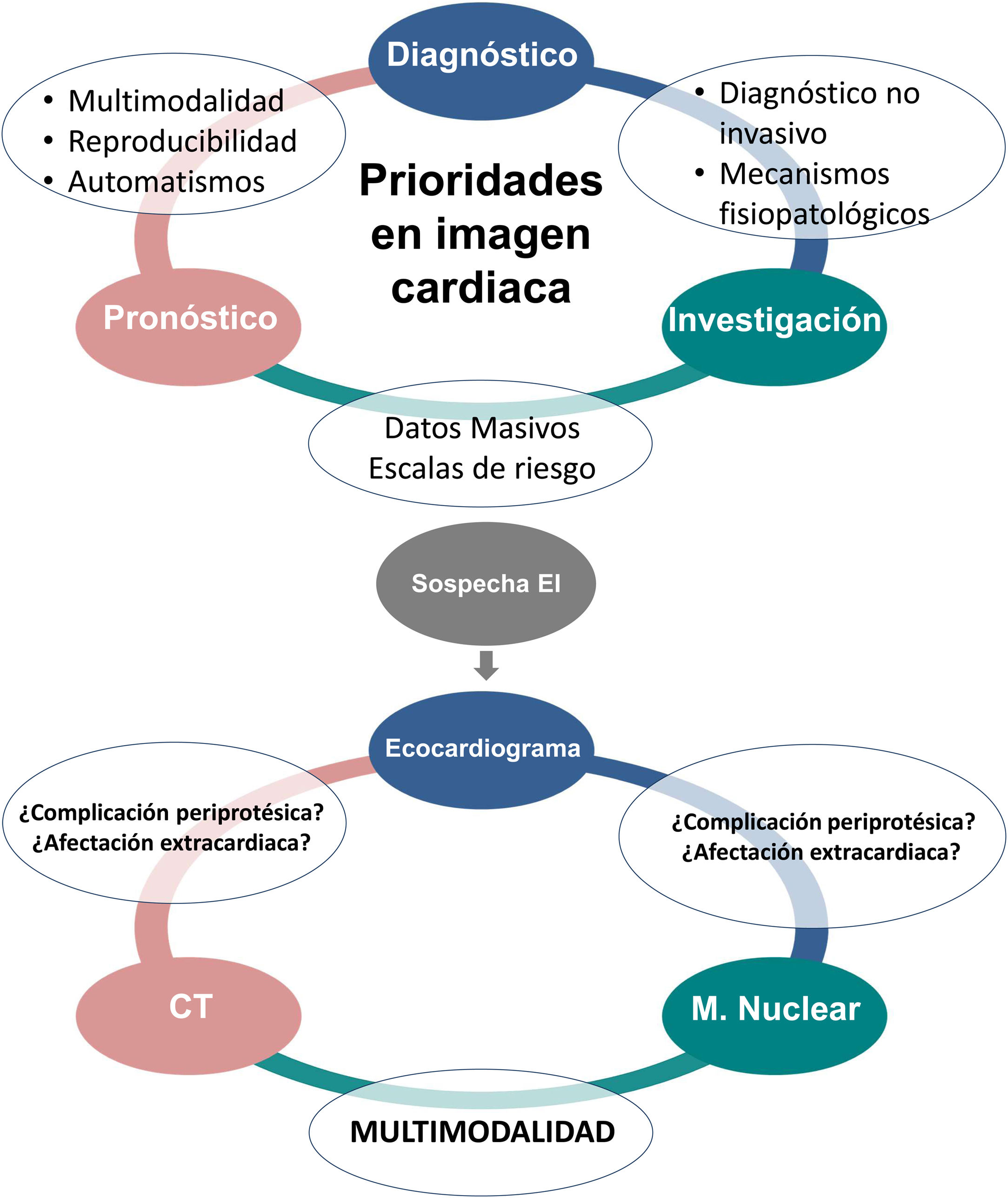
ConclusionesSe confirma una tendencia general al uso de la imagen multimodal con un aumento en el desarrollo de automatismos que permitan una mayor reproducibilidad en las técnicas de imagen cardiovascular. Además, la investigación con datos masivos (big data) contribuye a mejoras en el diagnóstico no invasivo, a un mejor conocimiento de la fisiopatología de la enfermedad y a la obtención de puntuaciones de riesgo que ayuden a mejorar nuestra capacidad de establecer un pronóstico en las diferentes cardiopatías estudiadas (fig. 2).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.