La fibrilación auricular (FA) es la arritmia sostenida más prevalente, incrementa el riesgo de morbimortalidad cardiovascular y conlleva un riesgo 5 veces mayor de ictus. En los pacientes con enfermedad renal crónica (ERC) y requerimiento de terapia de reemplazo renal (TRR) la FA es más común y grave. En esta población tanto el riesgo de FA como el de tromboembolia sistémica relacionada con ella aumentan de forma sustancial. Sin embargo, la prevalencia de FA en pacientes con ERC con requerimiento de TRR y los factores de riesgo asociados no han sido bien estudiados1. El objetivo de este estudio fue evaluar la prevalencia de FA, de factores ecocardiográficos y clínicos asociados al desarrollo de FA en pacientes con ERC con TRR.
El trabajo es un estudio observacional de corte transversal. Los criterios de inclusión fueron pacientes de sexo masculino y femenino con ERC en estadio 5 y mayores de 50 años con un año o más en TRR y los criterios de exclusión fueron tener FA valvular. El tamaño muestral se calculó con una proporción esperada del 15% del evento, un tamaño poblacional de 287 pacientes, un nivel de confianza del 95%, un efecto de diseño de 1 y una precisión de 0,5. El total de la muestra fue de 117 pacientes. El análisis estadístico se realizó a través de estadística descriptiva e inferencial con la prueba U de Mann Whitney, prueba de χ2 y test exacto de Fisher. Se tuvo en cuenta un α de 0,05 y se utilizó Jamovi versión 2.2 para el análisis de la información. El estudio fu aprobado por el Comité Ético de Investigación de la Fundación Universitaria de Ciencias de la Salud y el Medical Governence LatAm de Fresenuis Medical Care. Se requirió la firma de consentimiento informado de los pacientes que participaron en el estudio.
Se realizó ecocardiograma a toda la población incluida y se consideraron factores ecocardiográficos asociados para FA: a) fracción de eyección del ventrículo izquierdo reducida <52% en varones y <54% en mujeres; b) disfunción diastólica del ventrículo izquierdo definida como: onda éseptal <7cm/s, onda élateral <10, relación E/e’ >14, velocidad pico de insuficiencia tricúspide >2,8 m/s; c) crecimiento de aurícula izquierda (CAI) definido como volumen indexado >34ml/m2 o diámetro anteroposterior en modo M mayor de 45mm; d) crecimiento de la aurícula derecha (CAD): volumen indexado definido como mayor de 27ml/m2 en mujeres y mayor de 32ml/m2 en varones. Los pacientes que presentaban al menos uno de estos factores ecocardiográficos se llevaron a una segunda fase, con monitorización electrocardiográfica con Holter de 48 h en búsqueda activa de FA.
Se incluyó a 117 pacientes y se identificó a 77 con factores ecocardiográficos asociados para FA, de los cuales 65 pacientes (55%) se monitorizaron con Holter de 48 h en búsqueda de FA. Durante la realización del estudio se perdió a 12 pacientes que presentaron factores ecocardiográficos asociados para FA y que no se pudieron monitorizar con Holter (4 por muerte y 8 por transferencia a otros centros de diálisis).
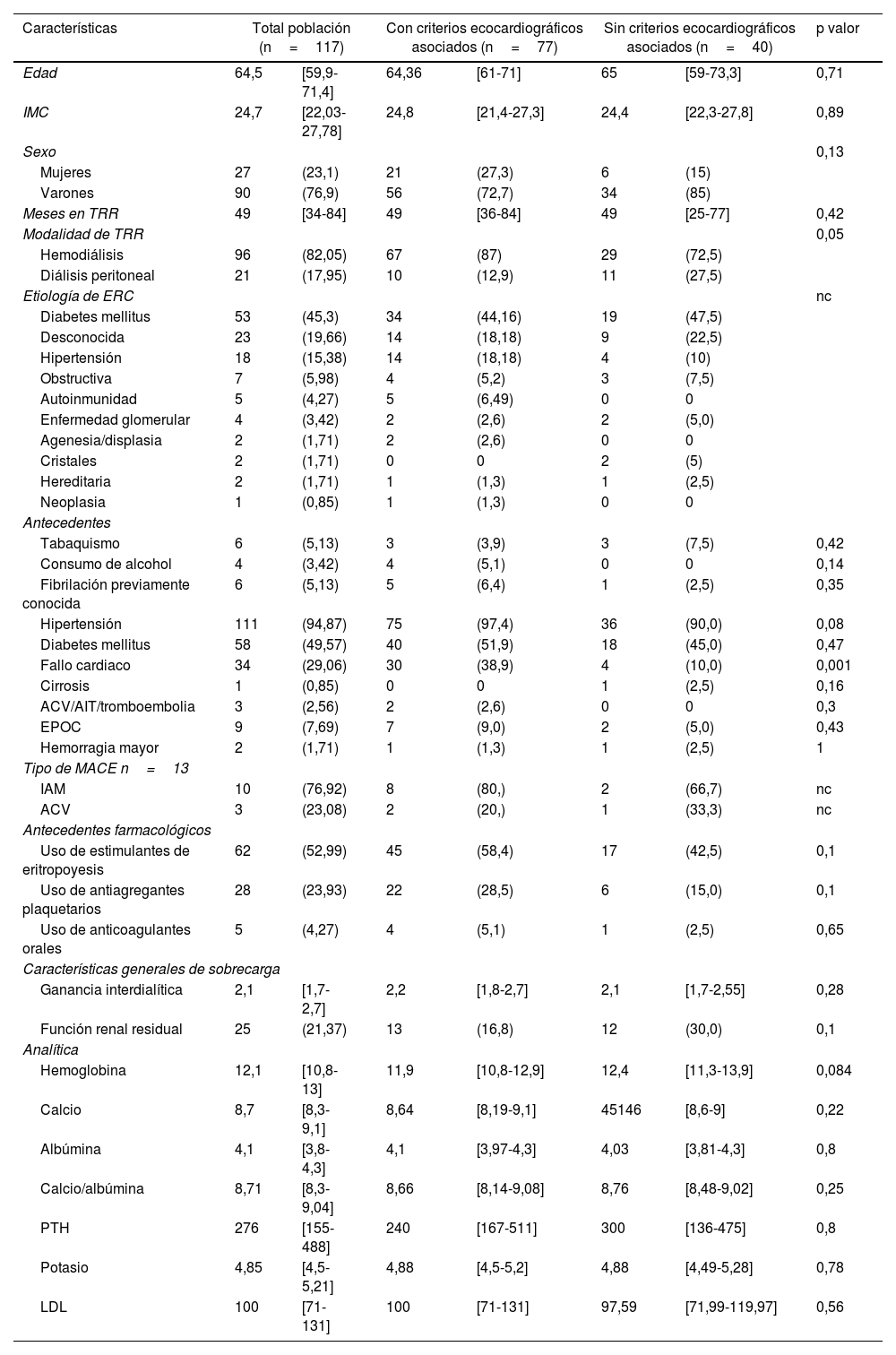
La mediana de edad de la población fue de 64,5 años, con un rango intercuartílico (RIQ: 59,9-71,4); el 76,9% de esta población eran varones. La representación por modalidad de terapia de soporte renal fue el 82% en hemodiálisis y el 18% en diálisis peritoneal. Las comorbilidades más frecuentes fueron la hipertensión en 111 pacientes (95%), la diabetes mellitus en 58 pacientes (50%) y el fallo cardiaco en 34 pacientes (29%). En la tabla 1 se describen las características demográficas, clínicas y etiología de la ERC discriminando por factores ecocardiográficos asociados para FA.
Características demográficas y clínicas de la población general según factores de riesgo ecocardiográficos para presentación de fibrilación auricular no valvular
| Características | Total población (n=117) | Con criterios ecocardiográficos asociados (n=77) | Sin criterios ecocardiográficos asociados (n=40) | p valor | |||
|---|---|---|---|---|---|---|---|
| Edad | 64,5 | [59,9-71,4] | 64,36 | [61-71] | 65 | [59-73,3] | 0,71 |
| IMC | 24,7 | [22,03-27,78] | 24,8 | [21,4-27,3] | 24,4 | [22,3-27,8] | 0,89 |
| Sexo | 0,13 | ||||||
| Mujeres | 27 | (23,1) | 21 | (27,3) | 6 | (15) | |
| Varones | 90 | (76,9) | 56 | (72,7) | 34 | (85) | |
| Meses en TRR | 49 | [34-84] | 49 | [36-84] | 49 | [25-77] | 0,42 |
| Modalidad de TRR | 0,05 | ||||||
| Hemodiálisis | 96 | (82,05) | 67 | (87) | 29 | (72,5) | |
| Diálisis peritoneal | 21 | (17,95) | 10 | (12,9) | 11 | (27,5) | |
| Etiología de ERC | nc | ||||||
| Diabetes mellitus | 53 | (45,3) | 34 | (44,16) | 19 | (47,5) | |
| Desconocida | 23 | (19,66) | 14 | (18,18) | 9 | (22,5) | |
| Hipertensión | 18 | (15,38) | 14 | (18,18) | 4 | (10) | |
| Obstructiva | 7 | (5,98) | 4 | (5,2) | 3 | (7,5) | |
| Autoinmunidad | 5 | (4,27) | 5 | (6,49) | 0 | 0 | |
| Enfermedad glomerular | 4 | (3,42) | 2 | (2,6) | 2 | (5,0) | |
| Agenesia/displasia | 2 | (1,71) | 2 | (2,6) | 0 | 0 | |
| Cristales | 2 | (1,71) | 0 | 0 | 2 | (5) | |
| Hereditaria | 2 | (1,71) | 1 | (1,3) | 1 | (2,5) | |
| Neoplasia | 1 | (0,85) | 1 | (1,3) | 0 | 0 | |
| Antecedentes | |||||||
| Tabaquismo | 6 | (5,13) | 3 | (3,9) | 3 | (7,5) | 0,42 |
| Consumo de alcohol | 4 | (3,42) | 4 | (5,1) | 0 | 0 | 0,14 |
| Fibrilación previamente conocida | 6 | (5,13) | 5 | (6,4) | 1 | (2,5) | 0,35 |
| Hipertensión | 111 | (94,87) | 75 | (97,4) | 36 | (90,0) | 0,08 |
| Diabetes mellitus | 58 | (49,57) | 40 | (51,9) | 18 | (45,0) | 0,47 |
| Fallo cardiaco | 34 | (29,06) | 30 | (38,9) | 4 | (10,0) | 0,001 |
| Cirrosis | 1 | (0,85) | 0 | 0 | 1 | (2,5) | 0,16 |
| ACV/AIT/tromboembolia | 3 | (2,56) | 2 | (2,6) | 0 | 0 | 0,3 |
| EPOC | 9 | (7,69) | 7 | (9,0) | 2 | (5,0) | 0,43 |
| Hemorragia mayor | 2 | (1,71) | 1 | (1,3) | 1 | (2,5) | 1 |
| Tipo de MACE n=13 | |||||||
| IAM | 10 | (76,92) | 8 | (80,) | 2 | (66,7) | nc |
| ACV | 3 | (23,08) | 2 | (20,) | 1 | (33,3) | nc |
| Antecedentes farmacológicos | |||||||
| Uso de estimulantes de eritropoyesis | 62 | (52,99) | 45 | (58,4) | 17 | (42,5) | 0,1 |
| Uso de antiagregantes plaquetarios | 28 | (23,93) | 22 | (28,5) | 6 | (15,0) | 0,1 |
| Uso de anticoagulantes orales | 5 | (4,27) | 4 | (5,1) | 1 | (2,5) | 0,65 |
| Características generales de sobrecarga | |||||||
| Ganancia interdialítica | 2,1 | [1,7-2,7] | 2,2 | [1,8-2,7] | 2,1 | [1,7-2,55] | 0,28 |
| Función renal residual | 25 | (21,37) | 13 | (16,8) | 12 | (30,0) | 0,1 |
| Analítica | |||||||
| Hemoglobina | 12,1 | [10,8-13] | 11,9 | [10,8-12,9] | 12,4 | [11,3-13,9] | 0,084 |
| Calcio | 8,7 | [8,3-9,1] | 8,64 | [8,19-9,1] | 45146 | [8,6-9] | 0,22 |
| Albúmina | 4,1 | [3,8-4,3] | 4,1 | [3,97-4,3] | 4,03 | [3,81-4,3] | 0,8 |
| Calcio/albúmina | 8,71 | [8,3-9,04] | 8,66 | [8,14-9,08] | 8,76 | [8,48-9,02] | 0,25 |
| PTH | 276 | [155-488] | 240 | [167-511] | 300 | [136-475] | 0,8 |
| Potasio | 4,85 | [4,5-5,21] | 4,88 | [4,5-5,2] | 4,88 | [4,49-5,28] | 0,78 |
| LDL | 100 | [71-131] | 100 | [71-131] | 97,59 | [71,99-119,97] | 0,56 |
Los datos expresan n (%) o mediana [rango intercuartílico].
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; EPO: estimulantes de eritropoyesis; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IAM: infarto agudo de miocardio; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; MACE: eventos adversos cardiovasculares mayores; NC: no calculado; PTH: paratohormona; RIQ: rango intercuartílico; TEV: tromboembolia venosa; TRR: terapia de remplazo renal.
p<0,005.
La proporción general de los hallazgos ecocardiográficos en la población de ERC con requerimiento de TRR fue: CAI en 57,2%; CAD en 36,7%, disfunción diastólica en 18% y fracción de eyección del ventrículo izquierdo reducida en el 16,24%. No se encontraron valvulopatías graves. La prevalencia general de FA en pacientes con ERC terminal fue de 8,5% y la prevalencia específica en los pacientes con factores ecocardiográficos para FA fue de 12,3%.
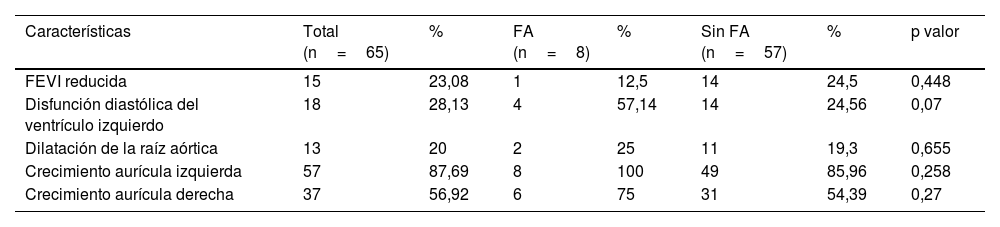
Se encontró una asociación entre el antecedente de fallo cardiaco y los hallazgos ecocardiográficos asociados para FA (p=0,001) (tabla 1). En la tabla 2 se describen las características ecocardiográficas de la población monitorizada con Holter.
Características ecocardiográficas de la población llevada a monitoreo Holter con fibrilación auricular valvular y sin ella
| Características | Total (n=65) | % | FA (n=8) | % | Sin FA (n=57) | % | p valor |
|---|---|---|---|---|---|---|---|
| FEVI reducida | 15 | 23,08 | 1 | 12,5 | 14 | 24,5 | 0,448 |
| Disfunción diastólica del ventrículo izquierdo | 18 | 28,13 | 4 | 57,14 | 14 | 24,56 | 0,07 |
| Dilatación de la raíz aórtica | 13 | 20 | 2 | 25 | 11 | 19,3 | 0,655 |
| Crecimiento aurícula izquierda | 57 | 87,69 | 8 | 100 | 49 | 85,96 | 0,258 |
| Crecimiento aurícula derecha | 37 | 56,92 | 6 | 75 | 31 | 54,39 | 0,27 |
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo.
La prevalencia de FA en los pacientes con Holter fue de 12,3%. Además de la FA, se encontraron otros hallazgos, como taquicardia auricular sostenida en 6,15%, bloqueo auriculoventricular de primer grado en 3,07%, síndrome de bradicardia-taquicardia en el 1,52%, taquicardia supraventricular en 1,54% y taquicardia ventricular en el 1,54%.
Todos los casos prevalentes y de novo de FA estaban en hemodiálisis (p=0,05). El consumo de alcohol (p=0,038) y el fallo cardiaco (p=0,047) fueron mayores en el grupo de FA (p=0,013).
El riesgo de eventos tromboembólicos medido por escalas no mostró diferencias entre los grupos. El riesgo hemorrágico, valorado con escala HAS-BLED y Ravera, fue mayor en el grupo FA que en el no FA (p<0,0001).
Se presenta un estudio de corte transversal que describe la prevalencia de FA en población en TRR. El tiempo de monitorización con Holter influye en los resultados, ya que los pacientes con paroxismos menos frecuentes pueden requerir monitorización de mayor duración que los pacientes con paroxismos diarios, como demostró Wachter en pacientes de urgencias con accidente cerebrovascular (ACV) o accidente isquémico transitorio, a quienes se les realizó Holter de 24, 48 h y 7 días, documentando FA paroxística en el 4,8, 6,4 y 12,5%, respectivamente2. La prevalencia de FA varía dependiendo de la sensibilidad del método diagnóstico utilizado, como demuestran estudios en los que, a través de un monitor cardiaco implantable durante 6 meses encuentran una prevalencia de FA en el 35% de los pacientes. En nuestro estudio la prevalencia en pacientes con factores ecocardiográficos para FA que se monitorizaron con Holter de 48 h fue de 12,3%3. La prevalencia de FA en pacientes con factores ecocardiográficos para FA que se monitorizaron con Holter de 48 h fue del 12,3%.
Entre los factores de riesgo asociados para FA incidente en pacientes con ERC en TRR se encuentran la hipertensión arterial, la insuficiencia cardiaca y la enfermedad arterial coronaria. Además, la edad se considera un factor de riesgo independiente: ser mayor de 75 años se más asocia a riesgo de FA en diálisis y tener entre los 55 y los 65 años se asocia a una prevalencia del 7,5%1. Se encontró una mediana de edad en el grupo de FA de 66 años. El fallo cardiaco, así como el consumo previo de alcohol, fueron más frecuentes entre los pacientes del grupo FA que en el de no FA.
En cuanto al tipo de terapia, se ha encontrado un mayor riesgo de desarrollar una nueva FA en la modalidad de hemodiálisis: se asocia a volúmenes de ultrafiltrado >2 litros y presión sistólicas-diastólicas bajas posterior a diálisis, lo que indica que los cambios de volumen/electrólitos rápidos podrían generar una respuesta catecolaminérgica que promueve un estado inflamatorio y cambios mecánicos asociados a hemodiálisis4. En nuestro estudio, el 100% de los pacientes con diagnóstico de FA estaban en hemodiálisis.
Con respecto a los factores ecocardiográficos asociados para FA, los más frecuentes fueron el CAI y el CAD, sin embargo, no se encontraron diferencias significativas entre los grupos. A pesar de los resultados variables, el CAI se asocia con FA en todos los estudios4,5.
El CAI y la regurgitación mitral moderada/grave fueron más prevalentes en el grupo FA que en el no FA en un estudio retrospectivo con registros médicos de ecocardiograma en hemodiálisis y diálisis peritoneal4.
El riesgo de enfermedad cardiovascular es 5 veces mayor en pacientes con ERC. Hasta 1 de cada 7 pacientes presenta una hemorragia mayor que requiere hospitalización y el riesgo de hemorragia intracerebral es 10 veces mayor en TRR. La alteración plaquetaria y la malnutrición en esta población son factores que incrementan el riesgo de hemorragia1. Las escalas de riesgo HAS-BLED, HEMORR2HAGES o ATRIA se aplican en esta población a pesar de no estar validadas, pero subestiman el riesgo6. En nuestro estudio, el 25% de los pacientes del grupo de FA tenían antecedente de ACV y el 1,7% de pacientes tenían antecedente de hemorragia, además de que los pacientes con FA tienen mayor riesgo de hemorragia al ser evaluados por HAS-BLED y Ravera.
La prevalencia general de FA en pacientes con ERC terminal fue del 8,5% y la prevalencia específica de FA en los pacientes con factores ecocardiográficos asociados para FA y que se monitorizaron con Holter fue del 12,3%. El fallo cardiaco y el consumo de alcohol parecen ser factores asociados. Los hallazgos ecocardiográficos más frecuentes fueron el CAI y CAD, y las escalas de riesgo hemorrágicas tuvieron mayores puntuaciones en el grupo FA.
Todos los datos generados o analizados durante este estudio se incluyen en este artículo publicado y sus archivos de información complementarios. Los conjuntos de datos generados o analizados durante el estudio actual no están disponibles públicamente para proteger la privacidad de los participantes del estudio; según solicitud razonable al autor de correspondencia, este podrá facilitarlos.
FinanciaciónDivisión de Investigación, Fundación Universitaria de Ciencias de la Salud.
Responsabilidades éticasEl estudio fue aprobado por el comité de ética institucional de la Fundación Universitaria de Ciencias de la Salud y el Medical Governance LatAm de Fresenius Medical Care clasificado como investigación con riesgo mínimo; se trata de un estudio transversal y los pacientes firmaron consentimiento informado para participar en el estudio. Se han tenido en cuenta las posibles variables de sexo y género y así se hace constar en el texto, de acuerdo con las directrices SAGER.
Declaración sobre el uso de inteligencia artificialNo se ha utilizado inteligencia artificial para el desarrollo de este artículo.
Contribución de los autoresR. Torres, E. Núñez, A. Montealegre y M. Reina investigaron la bibliografía médica y concibieron el estudio. E. Núñez, A. Montealegre y M. Reina participaron en el desarrollo del protocolo y obtención de la aprobación ética. E. Núñez, A. Montealegre y M. Reina participaron en la inclusión de pacientes. M. Reina participó en el análisis de datos. E. Núñez, A. Montealegre, M. Reina y O. Zabaleta escribieron el texto principal del manuscrito y diseñaron las tablas. Todos los autores revisaron y editaron el manuscrito y aprobaron la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.