La amiloidosis es una enfermedad poco frecuente. Los avances en la comprensión y diagnóstico de la enfermedad han aumentado su detección. Nuestro objetivo fue describir la evolución en la distribución de los subtipos de amiloidosis, las características clínicas y los métodos diagnósticos empleados en un Registro Institucional de Amiloidosis de Argentina a lo largo de 18 años.
MétodosSe incluyó a pacientes consecutivos con amiloidosis AL, ATTR wild type, ATTR variante y AA entre el 1 de enero de 2005 y el 31 de diciembre de 2022. Se analizó la evolución en la distribución de subtipos, características clínicas y modalidades diagnósticas en tres subperiodos: 2005-2010; 2011-2016 y 2017-2022.
ResultadosSe incluyó a 258 pacientes. La distribución de subtipos de amiloidosis varió a lo largo del periodo de estudio. La amiloidosis AL fue la más frecuente en los primeros subperiodos (85% y 63%, respectivamente), mientras que la amiloidosis ATTR wild type predominó en el último subperiodo (49%) (p<0,001). La edad en el momento del diagnóstico aumentó de 60 años [intervalo intercuartílico (IIC): 52-69] entre 2005-2010 a 76 años [IIC: 66-83] entre 2017 y 2022 (p<0,001). La insuficiencia cardiaca fue común en todos los subperiodos, con un incremento en el último. El antecedente de túnel carpiano se observó más en el último subperiodo.
ConclusionesEn este estudio observamos un incremento en la detección de casos de amiloidosis sistémica y ATTR wild type en particular. Además, se evidenció una transición hacia métodos diagnósticos no invasivos, como la gammagrafía DPD, que refleja avances tecnológicos en la detección de la enfermedad.
Amyloidosis is a rare disease. Advances in understanding and diagnosis have increased detection of the disease. Our objective was to describe the evolution in the distribution of amyloidosis subtypes, the clinical characteristics and diagnostic methods used in an Institutional Registry of Amyloidosis in Argentina over 18 years.
MethodsConsecutive patients with AL amyloidosis, ATTR wild type, ATTR variant, and AA between 1 January 2005 and 31 December 2022 were included. The evolution in the distribution of subtypes, clinical characteristics and diagnostic modalities was analyzed in three subperiods: 2005-2010; 2011-2016; 2017-2022.
ResultsA total of 258 patients were included. The distribution of amyloidosis subtypes varied throughout the study period. AL amyloidosis was the most frequent in the first subperiods (85% and 63% respectively), while ATTR wild type amyloidosis predominated in the last subperiod (49%) (P<.001). The age at diagnosis increased from 60 years [interquartile range (IIC): 52-69] between 2005-2010 to 76 years [IIC: 66-83] between 2017-2022 (P<.001). Heart failure was common in all subperiods, with an increase in the last one. The history of carpal tunnel was observed more in the last subperiod.
ConclusionsIn this study we observed an increase in the detection of cases of systemic amyloidosis and ATTR wild type in particular. In addition, a transition towards non-invasive diagnostic methods was evidenced, such as DPD scintigraphy, reflecting technological advances in disease detection.
La amiloidosis sistémica es un grupo de enfermedades poco frecuentes caracterizadas por el depósito extracelular de proteínas mal plegadas conocidas como fibrillas amiloides. Estas fibrillas se acumulan en diferentes órganos, lo que resulta en infiltración tisular y la subsiguiente disfunción celular1. Existen diferentes subtipos de amiloidosis, clasificados en función del tipo de proteína depositada en los tejidos, siendo la amiloidosis de cadenas ligeras de inmunoglobulinas (amiloidosis AL) el subtipo más común2. Sin embargo, se ha observado un incremento de la detección de la amiloidosis por depósito de transtirretina (amiloidosis ATTR) debido a los avances en el conocimiento de la enfermedad y el desarrollo de técnicas de diagnóstico no invasivas2,3.
El desarrollo de herramientas diagnósticas ha desempeñado un papel crucial en la mejora de la detección y tipificación de la amiloidosis. La ecocardiografía4–9 y la resonancia magnética cardiaca con gadolinio10,11 han desempeñado un papel importante en el diagnóstico de compromiso cardiaco en pacientes con amiloidosis sistémica. Sin embargo, el punto de inflexión lo marcó la introducción de la gammagrafía DPD, que ha demostrado ser una técnica eficaz y no invasiva para detectar la amiloidosis ATTR3,12.
Aunque se han realizado estudios sobre la evolución de los subtipos de amiloidosis, sus características y los métodos diagnósticos, es importante destacar que la mayoría de ellos se han llevado a cabo en países desarrollados con poblaciones y recursos de salud diferentes a los nuestros2,13,14. Además, a lo largo del tiempo ha habido avances y cambios significativos en estos aspectos12. Sin embargo, existe una falta de información contextualizada y específica para Latinoamérica. Por lo tanto, el presente estudio tiene como objetivo analizar la evolución en la distribución de los diferentes subtipos de amiloidosis, las características clínicas asociadas y los métodos diagnósticos empleados en un registro institucional de amiloidosis de Argentina.
MétodosDiseño y poblaciónSe realizó un estudio de cohortes retrospectivo que incluyó a todos los pacientes consecutivos con diagnóstico de amiloidosis del Registro Institucional de Amiloidosis del Hospital Italiano de Buenos Aires. El periodo de estudio abarcó desde el 1 de enero de 2005 al 31 de diciembre de 2022. Se incluyeron pacientes con los subtipos de amiloidosis AL, ATTR tanto en su forma natural o wild-type (amiloidosis ATTRwt) como en la variante (amiloidosis ATTRv) y por proteína sérica A (amiloidosis AA).
DefinicionesHasta diciembre de 2015, el diagnóstico de amiloidosis se basó en la confirmación histológica de depósito de amiloide en los tejidos mediante tinción de rojo Congo. Los subtipos de amiloidosis se clasificaron de acuerdo con criterios específicos (tabla 1 del material adicional). A partir de enero de 2016, la confirmación histológica continuó siendo un requisito en el algoritmo diagnóstico de la amiloidosis AL y AA, mientras que los subtipos ATTRwt o ATTRv se definieron mediante biopsia o gammagrafía DPD grado 2 o 3 de Perugini3.
Fuente de datosLos datos se obtuvieron del Registro Institucional de Amiloidosis. El registro es un estudio observacional y longitudinal que utiliza REDCap (Research Electronic Data Capture, Vanderbilt University, Estados Unidos) para el ingreso, almacenamiento y recuperación de datos. Para identificar posibles casos de amiloidosis, el registro utiliza dos estrategias de reclutamiento: a) las visitas médicas y b) un sistema de alerta automático mensual que identifica casos con sospecha de amiloidosis. En una segunda instancia, se revisan las historias clínicas electrónicas para confirmar el diagnóstico de amiloidosis y la caracterización de la proteína involucrada. Todos los pacientes incluidos en el registro son seguidos semestralmente mediante la revisión de su historia clínica electrónica por dos médicos con experiencia en amiloidosis, con el objetivo de evaluar la respuesta a los tratamientos y la evolución de la enfermedad.
Análisis estadísticoSe realizó un análisis descriptivo de la población de estudio. Las variables categóricas se presentaron como frecuencias absolutas y relativas, mientras que las variables continuas se expresaron como media±desviación estándar o mediana e intervalo intercuartílico [IIC], según su distribución.
Se dividió el periodo de estudio en 3 subperiodos. La elección de estos se basó en la introducción de métodos de diagnóstico, avances en el tratamiento y una mayor conciencia y comprensión de la enfermedad.
Se utilizó la prueba de χ2 para comparar las diferencias en la distribución de los subtipos de amiloidosis entre los diferentes subperiodos de estudio. Para comparar las características clínicas y de modalidades diagnósticas se utilizaron las pruebas de ANOVA o Kruskal-Wallis y χ2. Se consideró un valor de p<0,05 como estadísticamente significativo. El análisis se realizó utilizando el software Stata 13 (StataCorp, Estados Unidos).
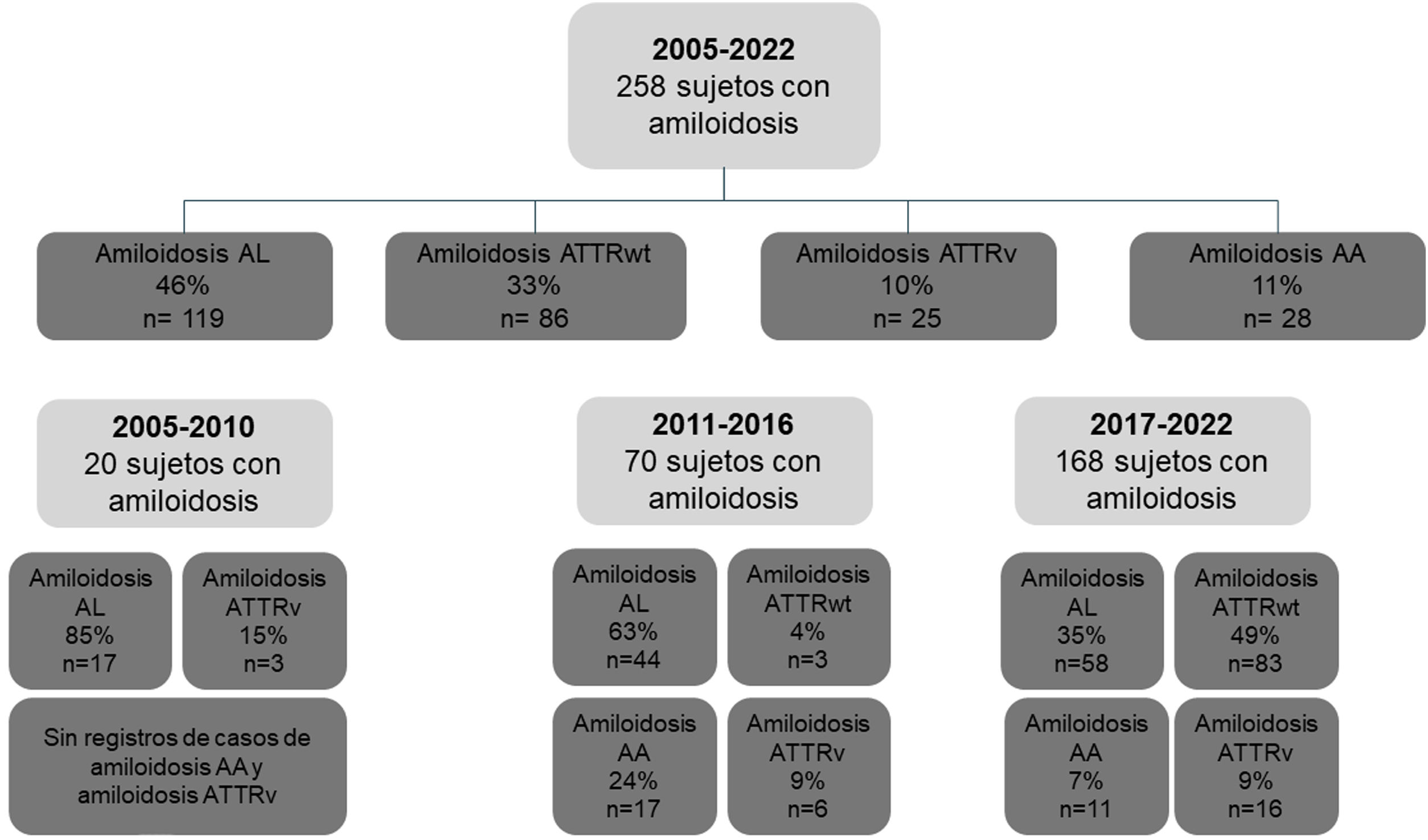
ResultadosPoblaciónDurante el periodo de estudio de 18 años, se incluyó a un total de 258 pacientes, de los cuales el 46% presentaba amiloidosis AL, el 33% amiloidosis ATTRwt, el 11% amiloidosis AA y el 10% amiloidosis ATTRv (fig. 1).
Evolución de la distribución de los subtipos de amiloidosis en el Registro Institucional de AmiloidosisEn cuanto al número de sujetos diagnosticados con amiloidosis sistémica, observamos un incremento sostenido en la frecuencia de detección de los casos totales, con 20 casos en 2005-2010, 70 en 2011-2016 y 168 casos en 2017-2022 (fig. 1). Respecto a la distribución por subtipos de amiloidosis a lo largo del periodo de estudio, observamos que la amiloidosis AL fue la más frecuente durante los dos primeros subperiodos (2005-2010 y 2011-2016), representando el 85% y 63% de los casos, respectivamente. Por el contrario, la amiloidosis ATTRwt predominó en el último subperiodo (2017-2022), representando el 49% de los casos (p<0,001) (fig. 1). Además, los casos de amiloidosis ATTRv se incrementaron a lo largo del tiempo (2005-2010: 3 casos; 2011-2016: 6 casos; 2017-2022: 16 casos). Respecto a la amiloidosis AA, el mayor número de casos fue para el periodo 2011-2016, registrándose 17 casos en este subperiodo (fig. 1).
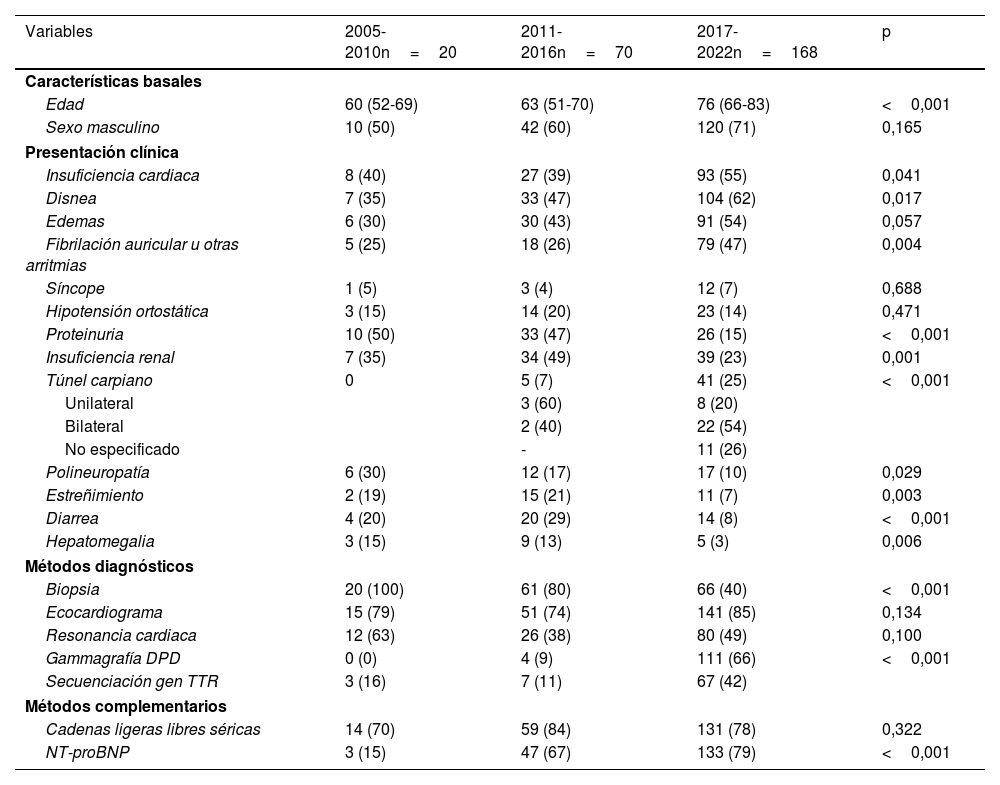
Características basales y modalidades diagnósticasLa tabla 1 muestra las características basales y presentación clínica en los 3 subperiodos de estudio. En cuanto a las características basales, se observó un aumento gradual en la mediana de edad, siendo de 60 años [52-69] entre el 2005-2010 y de 76 años [66-83] entre el 2017-2022 (p<0,001). Respecto al sexo, se observó una tendencia al predominio masculino en todos los subperiodos de estudio.
Características basales, de presentación clínica, métodos diagnósticos y complementarios en cada uno de los subperiodos de estudio
| Variables | 2005-2010n=20 | 2011-2016n=70 | 2017-2022n=168 | p |
|---|---|---|---|---|
| Características basales | ||||
| Edad | 60 (52-69) | 63 (51-70) | 76 (66-83) | <0,001 |
| Sexo masculino | 10 (50) | 42 (60) | 120 (71) | 0,165 |
| Presentación clínica | ||||
| Insuficiencia cardiaca | 8 (40) | 27 (39) | 93 (55) | 0,041 |
| Disnea | 7 (35) | 33 (47) | 104 (62) | 0,017 |
| Edemas | 6 (30) | 30 (43) | 91 (54) | 0,057 |
| Fibrilación auricular u otras arritmias | 5 (25) | 18 (26) | 79 (47) | 0,004 |
| Síncope | 1 (5) | 3 (4) | 12 (7) | 0,688 |
| Hipotensión ortostática | 3 (15) | 14 (20) | 23 (14) | 0,471 |
| Proteinuria | 10 (50) | 33 (47) | 26 (15) | <0,001 |
| Insuficiencia renal | 7 (35) | 34 (49) | 39 (23) | 0,001 |
| Túnel carpiano | 0 | 5 (7) | 41 (25) | <0,001 |
| Unilateral | 3 (60) | 8 (20) | ||
| Bilateral | 2 (40) | 22 (54) | ||
| No especificado | - | 11 (26) | ||
| Polineuropatía | 6 (30) | 12 (17) | 17 (10) | 0,029 |
| Estreñimiento | 2 (19) | 15 (21) | 11 (7) | 0,003 |
| Diarrea | 4 (20) | 20 (29) | 14 (8) | <0,001 |
| Hepatomegalia | 3 (15) | 9 (13) | 5 (3) | 0,006 |
| Métodos diagnósticos | ||||
| Biopsia | 20 (100) | 61 (80) | 66 (40) | <0,001 |
| Ecocardiograma | 15 (79) | 51 (74) | 141 (85) | 0,134 |
| Resonancia cardiaca | 12 (63) | 26 (38) | 80 (49) | 0,100 |
| Gammagrafía DPD | 0 (0) | 4 (9) | 111 (66) | <0,001 |
| Secuenciación gen TTR | 3 (16) | 7 (11) | 67 (42) | |
| Métodos complementarios | ||||
| Cadenas ligeras libres séricas | 14 (70) | 59 (84) | 131 (78) | 0,322 |
| NT-proBNP | 3 (15) | 47 (67) | 133 (79) | <0,001 |
NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B).
En relación con la presentación clínica, la insuficiencia cardiaca fue una de las manifestaciones más frecuentes en todos los subperiodos, mostrando un incremento significativo en el periodo 2017-2022 en comparación con los anteriores. Por otro lado, el compromiso renal, manifestado a través de la insuficiencia renal y la proteinuria, se observó con mayor frecuencia entre 2005 y 2016, mientras que en el periodo 2017-2022 menos de una cuarta parte de los pacientes presentaron estos síntomas. Adicionalmente, se encontró que el antecedente de túnel carpiano fue más frecuente en el último subperiodo, afectando al 25% de los pacientes, siendo bilateral en más de la mitad de los casos.
Respecto a los métodos de diagnóstico utilizados, entre el 2005-2022, la amiloidosis fue confirmada por métodos invasivos (biopsia de tejidos) en el 57% de los casos y por métodos no invasivos (gammagrafía DPD) en el 43%. Los órganos más frecuentemente biopsiados que confirmaron el diagnóstico fueron el riñón (47% de los casos), el aparato gastrointestinal (10%), la médula ósea (9%) y el corazón (8%). A su vez, la biopsia se utilizó como método de diagnóstico mayoritario en los subperiodos 2005-2010 y 2011-2016, mientras que la gammagrafía DPD se utilizó más frecuentemente en el subperiodo 2017-2022.
Respecto a los subtipos de amiloidosis, tanto para la amiloidosis AL como amiloidosis AA, la amiloidosis se diagnosticó con biopsia en el 100% de los sujetos, siendo el riñón el órgano más frecuentemente biopsiado en el 41% y el 79% de los casos, respectivamente. Por su parte, la amiloidosis ATTRwt fue diagnosticada en el 95% de los casos mediante gammagrafía DPD, y por biopsia endomiocárdica en los restantes. Finalmente, la ATTRv se diagnosticó por biopsia en 13 pacientes, de los cuales 7 fueron biopsias neurales, y 12 personas fueron diagnosticadas por gammagrafía DPD.
En cuanto a los métodos complementarios de diagnóstico, las cadenas ligeras libres séricas fueron solicitadas en todos los periodos con una frecuencia relativa similar, mientras que una mayor cantidad de sujetos tenían medición de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) en el último subperiodo de estudio.
DiscusiónEn este estudio, que abarcó un periodo de 18 años, evaluamos la evolución de los subtipos de amiloidosis, así como las características y los métodos diagnósticos utilizados en una población de pacientes con diagnóstico confirmado de amiloidosis en un registro institucional de amiloidosis.
En cuanto a la distribución de los subtipos de amiloidosis, observamos un cambio a lo largo del tiempo. Durante los primeros subperiodos de estudio (2005-2010 y 2011-2016), la amiloidosis AL fue el subtipo más frecuente, representando el 85% y el 63% de los casos, respectivamente. Sin embargo, en el último subperiodo (2017-2022), se registró un aumento significativo en la frecuencia de amiloidosis ATTRwt, que representó el 49% de los casos. Esto va en concordancia con lo que afirman distintos estudios que consideran que la amiloidosis ATTRwt no es infrecuente y se convertirá en la forma más comúnmente diagnosticada de amiloidosis15–17. Este cambio en la distribución de los subtipos de amiloidosis podría estar influido por mejoras en los métodos de detección y diagnóstico de los diferentes subtipos, así como por una mayor conciencia y conocimiento de la enfermedad.
Respecto a las características basales, observamos un aumento gradual en la edad en el momento del diagnóstico y una tendencia al predominio masculino en todos los subperiodos. Esto es similar a otros estudios18,19 y es consistente con el aumento de casos detectados de amiloidosis ATTRwt, subtipo que se caracteriza por su afectación a hombres mayores de 65 años.
En cuanto a la presentación clínica, observamos que la insuficiencia cardiaca fue una de las manifestaciones más comunes, similar a lo reportado por estudios previos20–22. Este hallazgo resalta la importancia del compromiso cardiaco como una forma frecuente de presentación en sujetos con amiloidosis. Además, cabe destacar que en el último subperiodo (2017-2022), se observó un aumento en la frecuencia de detección de la insuficiencia cardiaca. Esto podría estar relacionado con el cambio en la distribución de los subtipos de amiloidosis, específicamente el aumento significativo de la amiloidosis ATTRwt en dicho subperiodo. La amiloidosis ATTRwt se caracteriza por presentarse predominantemente con afectación cardiaca23,24, lo que podría explicar el incremento en la frecuencia de insuficiencia cardiaca observada en nuestra población.
Respecto a los métodos de diagnóstico, nuestros resultados mostraron una transición en la elección de las técnicas utilizadas a lo largo del tiempo. Inicialmente, la biopsia de tejidos fue el método de elección para confirmar el diagnóstico de amiloidosis. Sin embargo, en el último subperiodo se observó una transición hacia el uso de métodos no invasivos, como la gammagrafía DPD para el diagnóstico de la amiloidosis, similar a lo reportado por otros autores13. Este cambio refleja los avances en las técnicas de diagnóstico por imagen, principalmente la gammagrafía DPD, que ha demostrado ser una herramienta útil y no invasiva para la detección de la amiloidosis25.
En cuanto a los métodos complementarios de diagnóstico, nuestros resultados respaldan la importancia de las cadenas ligeras libres séricas en el diagnóstico y seguimiento de la amiloidosis26, ya que se observó una alta frecuencia de solicitud en todos los subperiodos de estudio. La medición de NT-proBNP también ha demostrado ser útil como marcador de estratificación pronóstica en pacientes con amiloidosis cardiaca25. En consonancia con esto, observamos un aumento en la medición de NT-proBNP en el último subperiodo, lo que, si bien es coincidente con una mayor disponibilidad del biomarcador, sugiere un mayor reconocimiento de su utilidad clínica en nuestra población.
LimitacionesEs importante destacar que este estudio tiene algunas limitaciones. En primer lugar, al ser un estudio retrospectivo basado en un registro institucional, existe la posibilidad de sesgos de selección y falta de generalización a otras poblaciones. El registro recluta pacientes en un hospital universitario de alta complejidad, que atiende a personas con seguro médico privado. Sin embargo, es un centro de referencia en la atención de personas con amiloidosis, con atención de pacientes de todo el país, lo que podría minimizar este sesgo. Segundo, puede existir un registro incompleto de datos clínicos que puede afectar a la interpretación de los resultados. Por otra parte, debido a que el criterio de tipificación de los subtipos de amiloidosis se basó en criterios clínicos y de estudios complementarios (tabla 1 del material adicional), es probable que haya habido superposición o errores diagnósticos por no contar con técnicas de mayor precisión, como la espectrometría de masas. Esto podría haber llevado a una posible sobreclasificación de algunos casos como amiloidosis AL en las etapas iniciales del estudio, afectando así a la precisión de nuestros resultados. Sin embargo, en el último subperiodo de estudio, la introducción de la gammagrafía DPD y la validación de algoritmos diagnósticos que la incluyen permitieron una caracterización más específica de la amiloidosis ATTRwt.
Si bien no se han seguido las directrices SAGER, se ha marcado en la discusión la variabilidad entre sexos.
A pesar de estas limitaciones, los hallazgos de este estudio contribuyen al conocimiento actual sobre la evolución de la amiloidosis y pueden tener implicaciones clínicas en el abordaje de la enfermedad.
ConclusionesEn conclusión, este estudio longitudinal de 18 años muestra una evolución en la distribución de los subtipos de amiloidosis, con un incremento en la detección de casos de amiloidosis sistémica en general y de la ATTRwt en particular. Estos resultados resaltan la importancia de la vigilancia y el seguimiento de la amiloidosis, así como la necesidad de mejorar los métodos de detección y diagnóstico de los diferentes subtipos. Además, pone en evidencia la transición hacia métodos de diagnóstico no invasivos, como la gammagrafía DPD, en lugar de la biopsia de tejidos, lo que refleja los avances tecnológicos en el campo, que facilitan la detección de la enfermedad. Estos hallazgos proporcionan información relevante para comprender mejor la amiloidosis y mejorar los enfoques de diagnóstico y tratamiento clínico.
- -
La amiloidosis es una enfermedad que se caracteriza por la acumulación de proteínas anormales en los tejidos, que afecta a diversos órganos y sistemas.
- -
Los avances en el conocimiento y los métodos diagnósticos han permitido una mayor detección de la enfermedad.
- -
La distribución de los subtipos de amiloidosis puede variar en diferentes periodos de tiempo.
- -
Este estudio presenta una descripción detallada de la evolución en la distribución de los subtipos de amiloidosis a lo largo de un periodo de 18 años.
- -
Se observa un aumento en la detección de casos de amiloidosis sistémica, especialmente del subtipo ATTRwt, lo cual brinda información relevante sobre la epidemiología de la enfermedad.
- -
Se destaca la transición hacia métodos de diagnóstico no invasivos, como la gammagrafía DPD, en lugar de la biopsia de tejidos, lo que representa un avance significativo en la práctica clínica.
El estudio no presentó ningún tipo de riesgo para el paciente. No requirió consentimiento informado por tratarse de datos retrospectivos, y toda información obtenida se manejó con la más estricta confidencialidad por los investigadores. El proyecto contó con la aprobación del comité de ética local (CEPI#6767). El manuscrito se ha presentado siguiendo las recomendaciones STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
FinanciaciónNinguna para declarar.
Declaración sobre el uso de inteligencia artificialDurante la preparación de este trabajo, los autores utilizaron ChatGPT para mejorar el lenguaje y la legibilidad en el proceso de escritura. Después de usar esta herramienta, los autores revisaron y editaron el contenido según fuera necesario y asumen toda la responsabilidad por el contenido de la publicación.
Contribución de los autoresConcepción: M. Carretero, M. E. Villanueva, D. Pérez de Arenaza, E. M. Nucifora, M. S. Sáez, P. B. Sorroche, E. B. Brulc, M. A. Aguirre, M. L. Posadas-Martínez. Diseño: M. Carretero, M. E. Villanueva, M. L. Posadas-Martínez; Recolección de datos: M. Carretero, M. E. Villanueva, M. S. Sáez, E. B. Brulc; M. A. Aguirre, M. L. Posadas-Martínez; Procesamiento de datos: M. Carretero, M. L. Posadas-Martínez; Interpretación: M. Carretero, M. E. Villanueva, D. Pérez de Arenaza, E. M. Nucifora, M. S. Sáez, P. B. Sorroche, E. B. Brulc, M. A. Aguirre, M. L. Posadas-Martínez; Búsqueda bibliográfica_ M. Carretero; Escritura: M. Carretero; M. E. Villanueva; M. A. Aguirre; M. L. Posadas-Martínez.; Aprobación final: M. Carretero, M. E. Villanueva, D. Pérez de Arenaza, E. M. Nucifora, M. S. Sáez, P. B. Sorroche, E. B. Brulc, M. A. Aguirre, M. L. Posadas-Martínez M. Carretero, E. Villanueva; D. Pérez de Arenaza; E. M. Nucifora; M. S. Sáez, P. B. Sorroche, E. B. Brulc, M. A. Aguirre, M. L. Posadas-Martínez
Conflicto de interesesNinguno para declarar.