Novedades en cardiología: visión del cardiólogo joven
More infoLa estimulación fisiológica es una modalidad de estimulación cardiaca que persigue el mantenimiento de la sincronía en la activación electromecánica ventricular a través de la estimulación directa del sistema específico de conducción, generalmente el haz de His o la rama izquierda del haz de His. Aunque técnicamente más compleja que la estimulación convencional del ventrículo derecho, la aparición de herramientas dedicadas ha favorecido su implementación en la práctica como alternativa más fisiológica a la estimulación convencional del ventrículo derecho y como estrategia de rescate cuando no es posible optar por la terapia de resincronización cardiaca convencional. Más recientemente, la creciente evidencia científica que la equipara a esta última la situaría como alternativa real en pacientes con insuficiencia cardiaca e indicación de resincronización. En esta revisión se repasan los fundamentos de las principales modalidades y la técnica de implante, la evidencia científica disponible y las perspectivas futuras.
Conduction system pacing is a cardiac pacing modality that seeks to maintain ventricular electromechanical activation synchrony through direct stimulation of the specific conduction system, generally the bundle of His or the left bundle branch. Although technically more complex than conventional right ventricular pacing, the advent of dedicated tools has favored its implementation in clinical practice as a more physiologic alternative to conventional right ventricular pacing and as a rescue strategy when conventional resynchronization therapy through biventricular pacing is not feasible. More recently, the growing scientific evidence that compares it to the latter would place it as a real alternative strategy in patients with heart failure and an indication for resynchronization. This text reviews the fundamentals of the main implant modalities and technique, the available scientific evidence, and future prospects.
Gracias a la creciente evidencia científica y al diseño y comercialización de nuevas herramientas que facilitan su implementación, la estimulación fisiológica (EF) ha crecido enormemente en popularidad, y se postula en la actualidad como una alternativa más fisiológica a la estimulación convencional y comparable en eficacia a la estimulación biventricular. Publicada en 2021, la guía europea vigente sobre estimulación y resincronización cardiaca1 reconoce su indicación en determinados escenarios clínicos, aunque la escasa evidencia científica disponible en el momento de su elaboración para alguna de sus modalidades explicaría lo limitado de sus recomendaciones. Más recientemente, la publicación de nuevos estudios y documentos de consenso avalan el auge de la técnica.
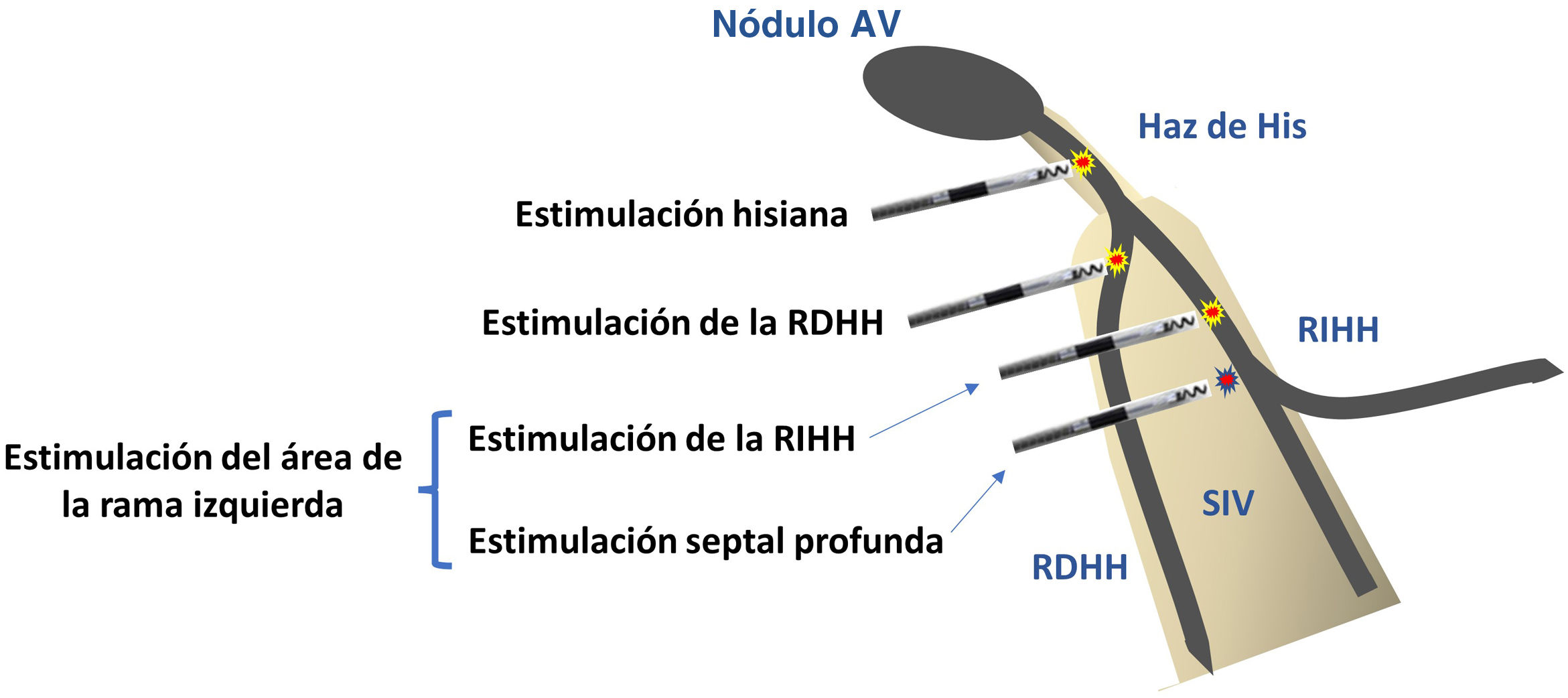
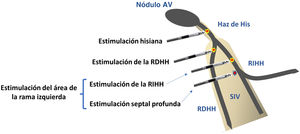
DefiniciónSe define como EF la activación directa del sistema específico de conducción mediante un estímulo de marcapasos, con el objetivo reproducir la activación electromecánica fisiológica ventricular. Se puede conseguir mediante la estimulación del haz de His (HH) o cualquiera de sus ramificaciones. Aunque recientemente se ha descrito la estimulación de rama derecha, en la actualidad las dos modalidades más extendidas son la estimulación del HH y la estimulación del área de rama izquierda del haz de His (RIHH)2 (fig. 1).
Modalidades de estimulación fisiológica y criterios electrocardiográficosEn el material adicional se ofrece una breve descripción de la anatomía del sistema específico de conducción.
Estimulación del haz de HisSe define como la captura de cualquier porción de la unión auriculoventricular que resulta en el máximo reclutamiento funcional de todas las fibras distales del sistema de conducción2. Hace más de 50 años se describieron los primeros intentos de estimular el HH3, pero no fue hasta 2000 cuando Deshmukh et al. demostraron la posibilidad de conseguir la captura permanente del mismo4.
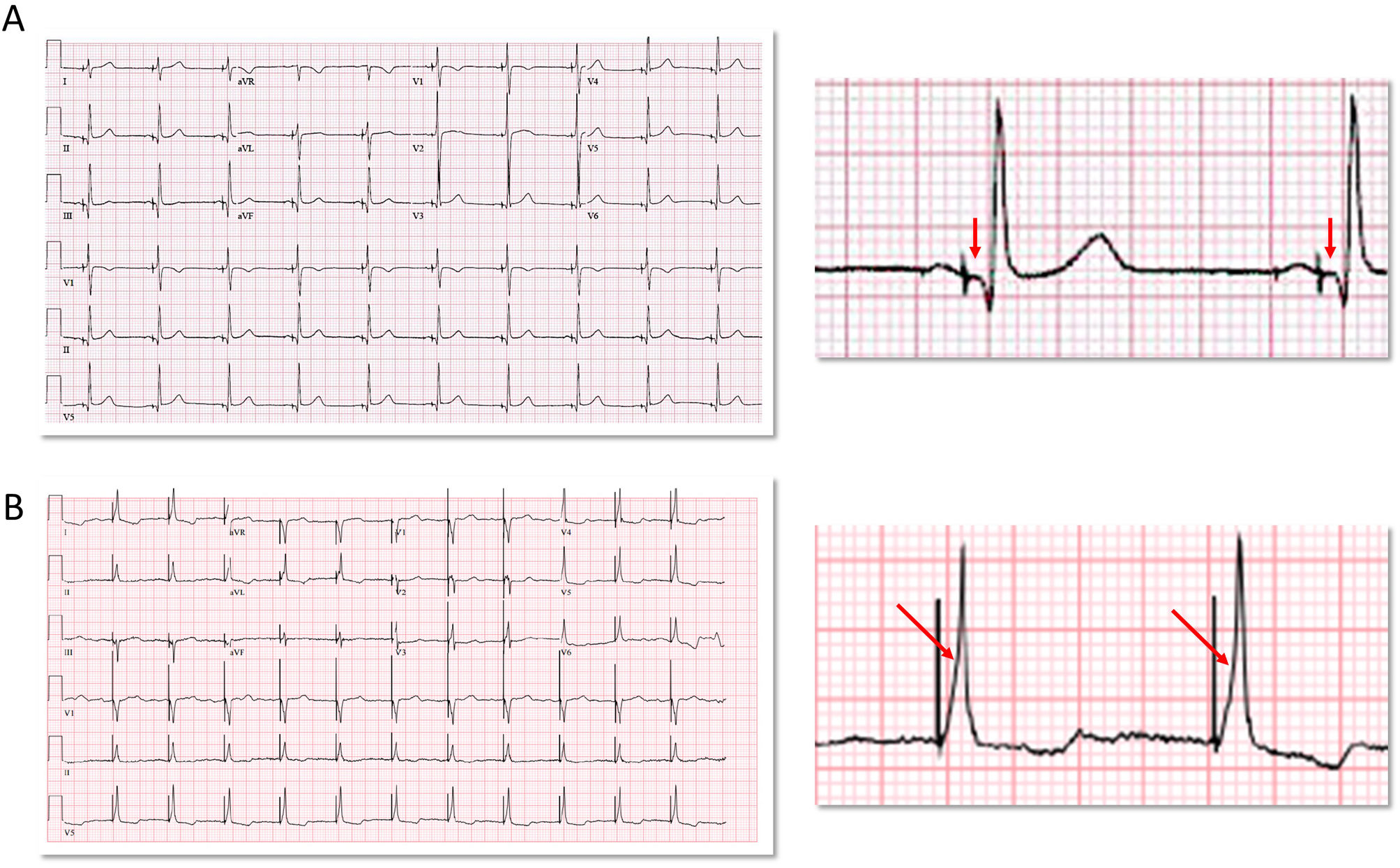
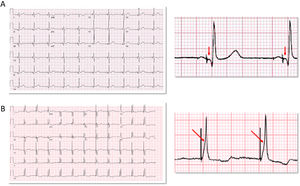
Puede ser selectiva (en la que únicamente se captura el sistema de conducción) o no selectiva, en la que hay captura simultánea del miocardio adyacente. En la captura selectiva, la activación ventricular se produce exclusivamente a través del sistema His-Purkinje, que es la que mejor reproduce la activación ventricular propia del paciente (fig. 2A). En la no selectiva existe captura simultánea de la porción anterosuperior del septo interventricular derecho y del HH (fig. 2B). La tabla 1 describe las características electrocardiográficas de las diferentes modalidades5.
Ejemplos de estimulación selectiva y no selectiva del haz de His en pacientes sin trastorno de la conducción ni bloqueo de rama. A: estimulación selectiva del haz de His. Existe intervalo isoeléctrico entre la espiga de estimulación y el QRS (flecha). B: estimulación no selectiva El QRS comienza inmediatamente después de la espiga (pseudodelta, flecha). La anchura del QRS estimulado es ligeramente superior a la del QRS nativo o con estimulación selectiva del haz de His.
Criterios de estimulación selectiva o no selectiva del haz de His
| Criterios de estimulación selectiva o no selectiva del HH | Estimulación selectiva del HH | Estimulación no selectiva del HH |
|---|---|---|
| Captura local | No captura directa del electrograma ventricular local (aparece como electrograma discreto tras la espiga de estimulación) | Captura directa del electrograma ventricular local por la espiga de estimulación |
| Intervalo isoeléctrico inicial | Existe intervalo isoeléctrico inicialEl intervalo isoeléctrico entre la espiga de estimulación (S) y el inicio del QRS estimulado (S-QRS) debe ser igual al intervalo entre la señal del HH y el inicio del QRS nativo (H-QRS) en el electrograma intracavitario | No existe intervalo isoeléctrico inicial. El inicio del QRS estimulado es inmediato a la espiga de estimulación, dando lugar a una imagen de pseudodelta en la porción inicial del QRS estimulado. El intervalo S-QRS es cercano a 0 y menor que el H-QRS |
| Anchura del QRS | Anchura y eje del QRS estimulado idéntico a la del QRS nativo | Anchura del QRS estimulado mayor que la del QRS nativo, aunque eje globalmente respetado |
| Umbral de captura | Habitualmente único (umbral de captura del HH), aunque a salidas muy altas podría capturarse el miocardio septal adyacente | Dos diferenciados (umbral de captura del HH y del miocardio septal). Con la disminución progresiva de la salida puede observarse ensanchamiento del QRS, al perder la fusión con la captura del HH, o estrechamiento, al perder la fusión con la captura del miocardio septal |
HH: haz de His.
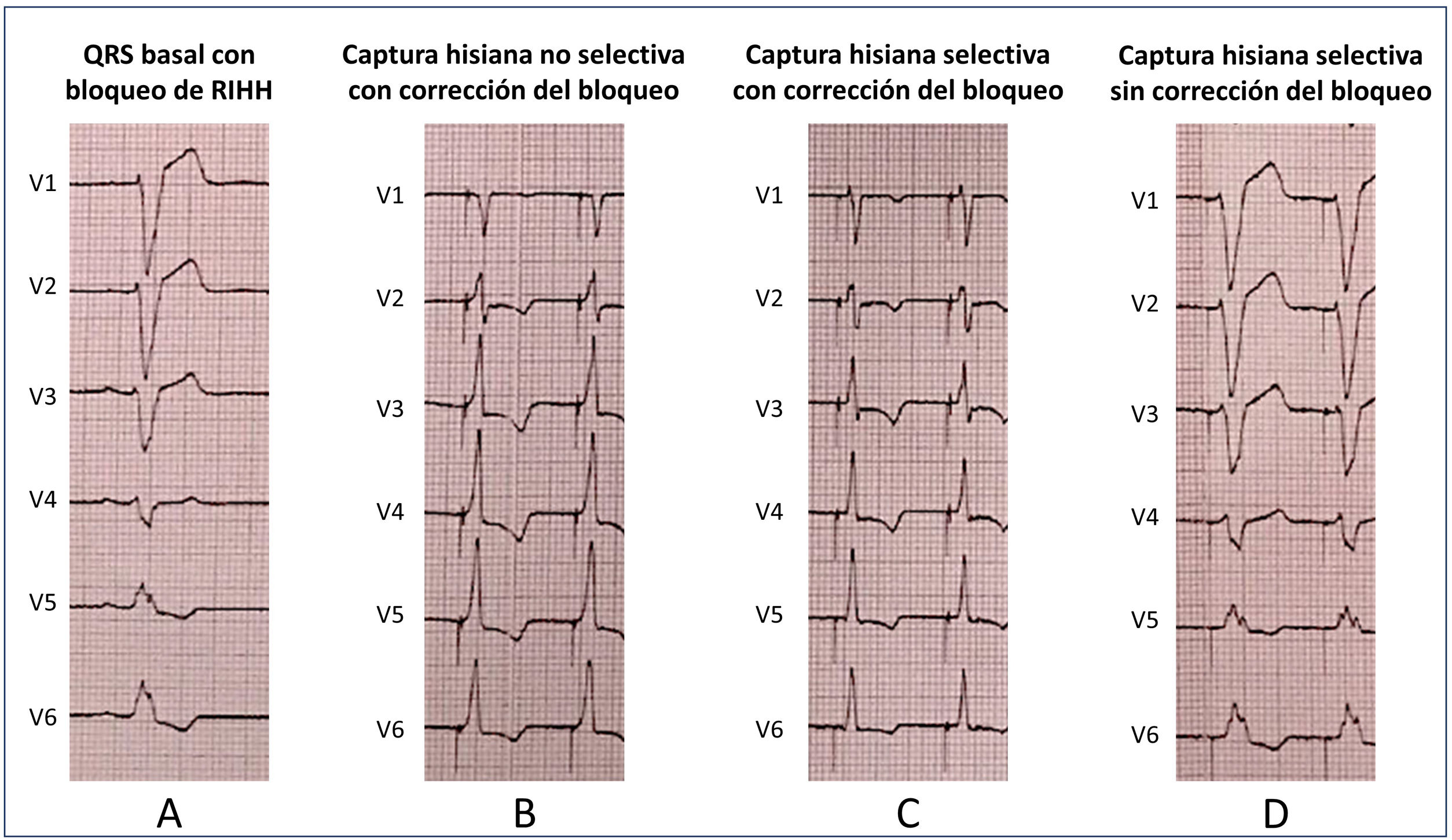
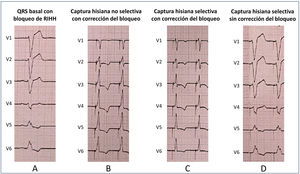
En pacientes con bloqueo auriculoventricular o de rama, en los que el intervalo His-ventrículo puede estar prolongado o incluso ausente, la morfología del QRS estimulado puede ser diferente a la del QRS basal, y en algunos casos es posible estrechar el QRS (corrección del bloqueo de rama). Existen varias teorías a este respecto, como la posibilidad de que la estimulación hisiana sea capaz de reclutar tejido fascicular latente, capturar una región distal al punto de bloqueo o ejercer de «electrodo virtual» (derivación del punto de bloqueo) con energías de estimulación altas. Desde un punto de vista electrocardiográfico, la captura hisiana puede dar lugar a 4 escenarios:
- -
Captura no selectiva con corrección del bloqueo de rama (fig. 3B): captura concomitante del sistema de conducción y el miocardio adyacente, pero con estrechamiento del QRS. Suele haber normalización del eje del QRS.
Figura 3.Distintos tipos de captura del haz de His (HH) obtenidos durante test de umbral con energía de salida decreciente en un caso con bloqueo de rama izquierda del HH (RIHH). A: QRS basal. B: captura no selectiva del HH con corrección del bloqueo. El QRS estimulado es más estrecho y se observa pseudodelta tras la espiga por la captura concomitante del miocardio adyacente. C: captura selectiva del HH con corrección del bloqueo. La anchura del QRS sigue siendo menor y aparece un intervalo isoeléctrico entre la espiga y el QRS (más visible en V5-V6). D: captura selectiva del HH sin corrección del bloqueo. Con la disminución progresiva de la energía, el número de fibras del tejido de conducción activadas es menor, no se logra la corrección del trastorno y el QRS estimulado es similar al basal. Se sigue observando un intervalo isoeléctrico entre la espiga y el QRS, ya que la captura sigue siendo exclusiva del tejido de conducción.
- -
Captura selectiva con corrección del bloqueo de rama (fig. 3C): captura exclusiva del sistema de conducción en la que se consigue estrechar el QRS.
- -
Captura no selectiva sin corrección del bloqueo de rama: captura del sistema de conducción sin estrechamiento del QRS. La anchura del QRS estimulado será similar a la del QRS basal y mostrará una pseudodelta por la captura concomitante del miocardio adyacente.
- -
Captura selectiva sin corrección del bloqueo de rama (fig. 3D): se captura de manera exclusiva el sistema de conducción sin la corrección del bloqueo de rama. El QRS estimulado tendrá la misma morfología y anchura que el basal.
Se define como la captura de la porción subendocárdica del lado izquierdo del septo interventricular, con o sin captura simultánea del sistema de conducción. Este modo de EF se describió en el año 20176, en un paciente con bloqueo de RIHH en el que la captura hisiana no fue capaz de estrechar el QRS y en cambio la estimulación del septo profundo 1cm inferior a la posición del HH dio lugar a un QRS estimulado estrecho que además era capaz de fusionarse con la activación intrínseca por la rama derecha.
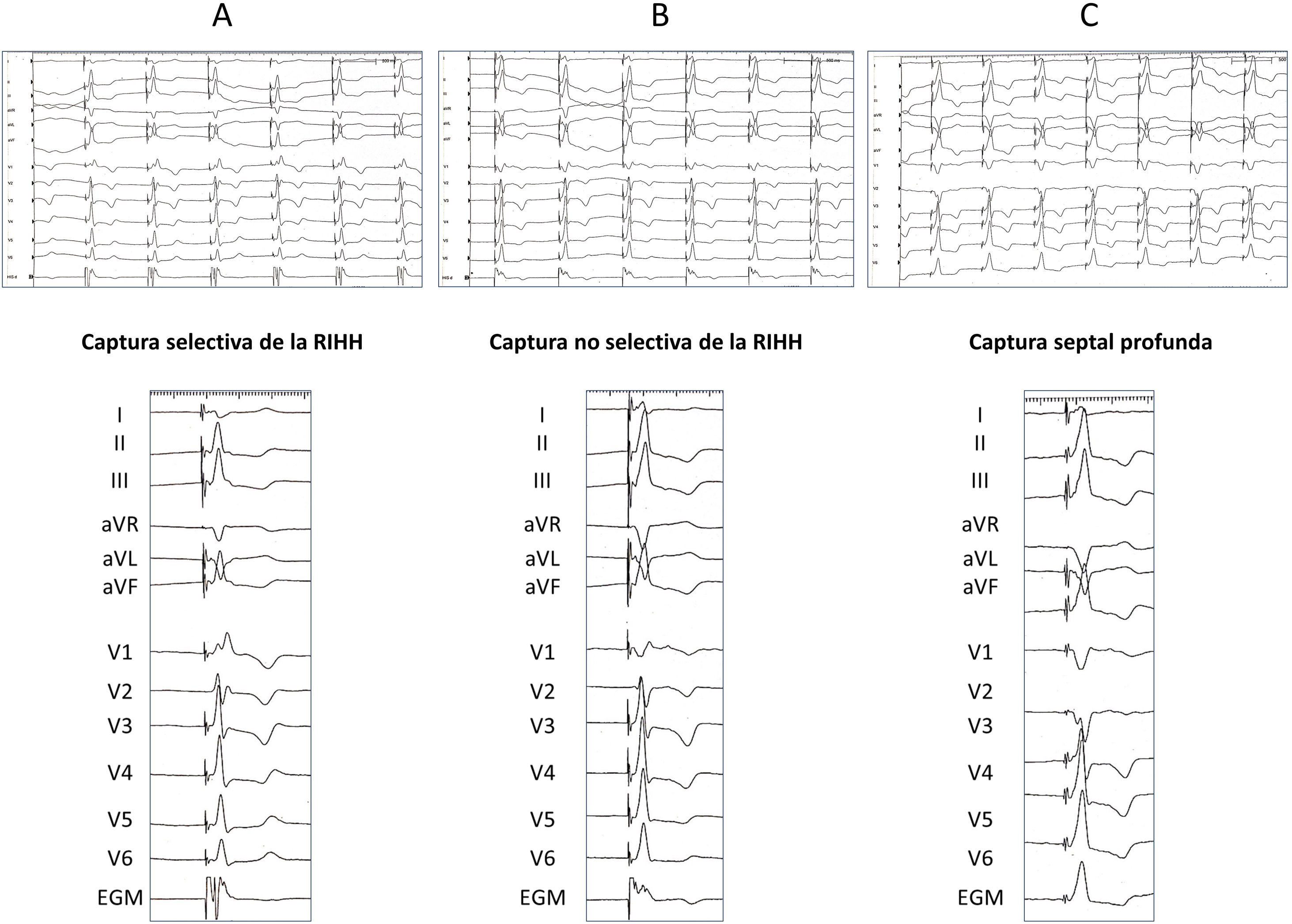
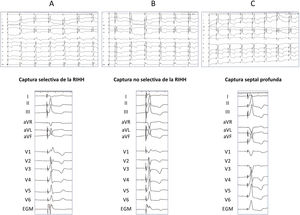
Este tipo de estimulación comprende la captura de la RIHH (que puede ser troncular o de alguno de sus fascículos, y selectiva o no selectiva) y la captura septal profunda. La tabla 2 describe las características electrocardiográficas de las diferentes modalidades de captura de la RIHH (fig. 4A y B).
Criterios de estimulación selectiva o no selectiva de la RIHH
| Criterios de estimulación selectiva o no selectiva de la RIHH | Estimulación selectiva de la RIHH | Estimulación no selectiva de la RIHH |
|---|---|---|
| Morfología del QRS | Patrón de trastorno de la conducción por la rama derecha con rSr’ en V1 (ya que la activación del ventrículo derecho se produce de manera retrógrada a través del sistema His-rama derecha) | Patrón de trastorno de la conducción por la rama derecha con qR en V1 (ya que la activación del ventrículo derecho se produce principalmente de manera transeptal, a través del miocardio del septo interventricular). |
| Eje eléctrico | Variable. Puede ser normal en casos de captura del tronco de la RIHH o del fascículo septal, izquierdo en casos de captura del fascículo posterior o inferior en casos de captura del fascículo anterior | También variables, como ocurría en la captura selectiva. Puede ser similar al basal en pacientes sin trastorno previo de la conducción o normalizarse en pacientes con bloqueo de rama previo |
| Intervalo isoeléctrico | Existe un intervalo isoeléctrico entre la espiga de estimulación y el inicio del QRS, aunque puede ser solo evidente con velocidad de registro>50mm/s | No existe intervalo isoeléctrico |
| Anchura del QRS estimulado | Anchura >120ms (ya que la activación del ventrículo derecho se produce de manera retrógrada a través del sistema His-rama derecha) | Generalmente <120ms (ya que la activación del ventrículo derecho por vía transeptal suele ser más rápida). En pacientes con QRS basal estrecho, el QRS estimulado suele ser ligeramente más ancho que el QRS nativo. En pacientes con bloqueo de rama, el QRS estimulado suele ser significativamente más estrecho |
RIHH: rama izquierda del haz de His.
Distintos tipos de captura de la rama izquierda del haz de His (RIHH), registros electrocardiográficos a 50mm/s. A: captura selectiva de RIHH. Se observa intervalo isoeléctrico entre la espiga y el QRS (menor que con estimulación hisiana). Además, en derivación V1 aparece un patrón de bloqueo de rama derecha con morfología rSr’. B: captura no selectiva de la RIHH. Se observa que el QRS comienza inmediatamente tras la espiga. Además, en derivación V1 el patrón de bloqueo de rama derecha presenta una morfología qR. C: captura septal profunda. Se observa anchura del QRS<120ms, aunque ligeramente más ancho que con captura de la RIHH. EGM: electrograma intracavitario.
La estimulación septal profunda se define como la captura de la porción izquierda del miocardio del septo interventricular sin demostración de captura de la RIHH. La morfología electrocardiográfica comparte características con la de RIHH (onda R terminal en V1 y eje normal en derivaciones precordiales) pero suele mostrar una anchura del QRS ligeramente superior a la captura no selectiva de la RIHH (fig. 4C)2.
Técnica de implanteAunque es técnicamente posible realizar una EF con el empleo de materiales convencionales, lo habitual es usar materiales dedicados y una serie de modificaciones en la técnica de implante.
Estimulación del haz de HisDesde el acceso vascular obtenido, se avanza una vaina hasta la aurícula derecha y se progresa el electrodo, que se conecta al programador en unipolar para el mapeo de la señal del HH (hisiograma) a nivel anteroseptal, prefiriendo las posiciones distales por ofrecer mejores parámetros de estimulación2. Las vainas se pueden preformar manualmente para implantes derechos o anatomías complejas. Si el hisiograma no es visible, se puede realizar topoestimulación a alta salida (5V a 1ms) en busca de latidos con QRS estrecho, y se han descrito series de casos realizadas bajo mapeo electroanatómico7.
Una vez definida el área de atornillado, se procede a la fijación del electrodo mediante rotación horaria directa. El número de giros es variable y dependerá de la resistencia del tejido al atornillado (debe ser ligera), de la morfología del hisiograma (debe objetivarse corriente de lesión y negativización del hisiograma) y de los parámetros de estimulación y sensado, con umbrales objetivo inferiores a 1,5V a 0,5ms y amplitud de onda R>2mV en bipolar. Para realizar las mediciones se recomienda retirar parcialmente la vaina, liberando el ánodo y permitiendo que el cable adquiera su apoyo final. La sensibilidad debe programarse con suficiente margen para evitar sobresensado auricular o hisiano, puesto que puede suponer la asistolia en pacientes dependientes.
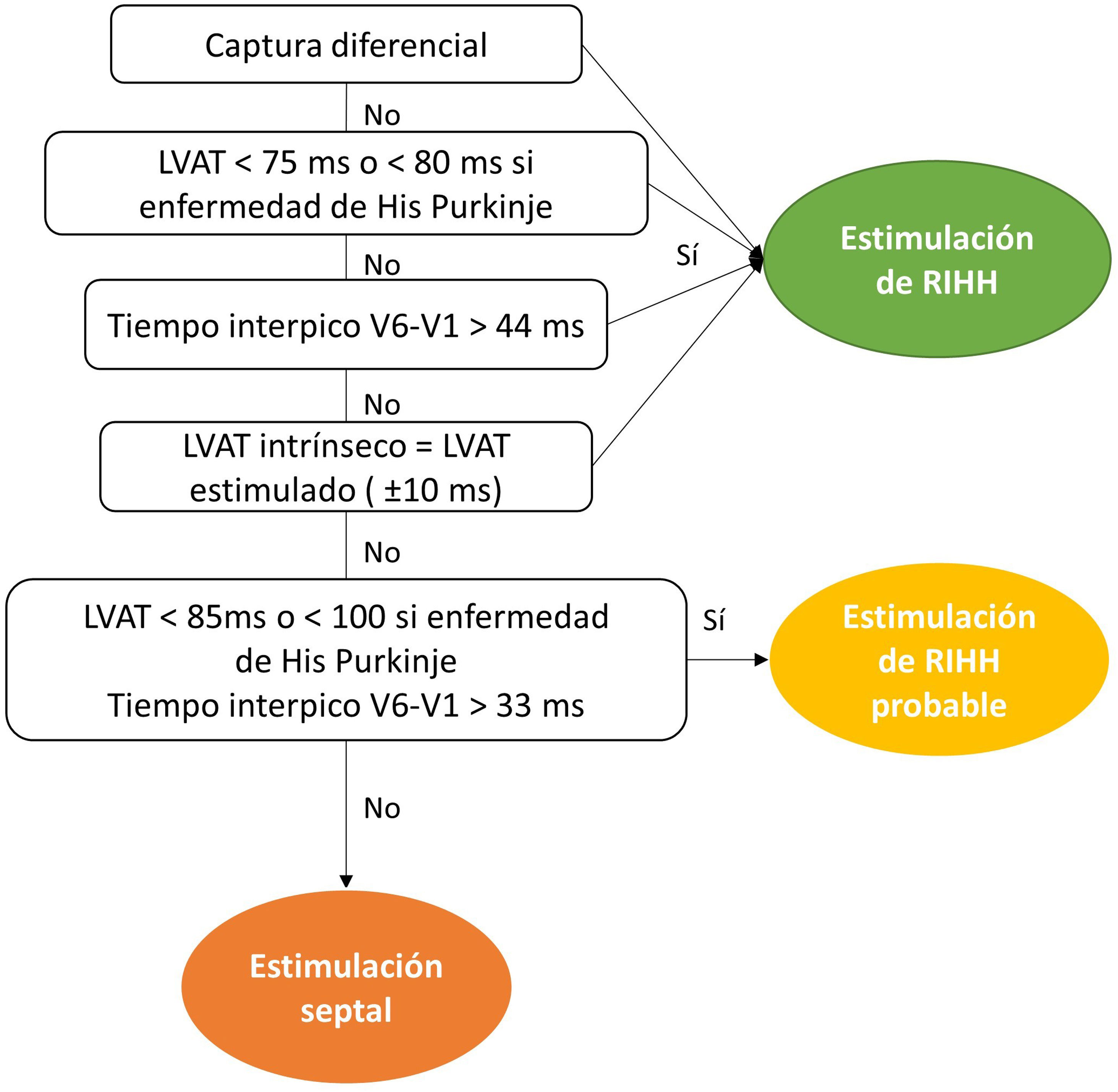
La validación de la captura hisiana se basa en la presencia de captura diferencial: transición desde estimulación no selectiva a selectiva (transición no selectiva-selectiva) o a miocárdica (no selectiva-miocárdica). En la no selectiva-selectiva, aparece espacio isoeléctrico tras la espiga, mientras que en no selectiva-miocárdica se objetiva un ensanchamiento del QRS. En los raros casos en los que se produzca solo captura selectiva, el intervalo espiga-ventrículo no debería ser más de 12 ms mayor que el intervalo His-ventrículo8. Por último, se procedería al pelado de la vaina. El apoyo del electrodo debería evitar tiranteces sin ser redundante, ya que ello favorece la dislocación.
De acuerdo con la guía vigente1, se aconseja el implante de un electrodo complementario de apoyo en el ápex del ventrículo derecho en pacientes dependientes de estimulación, con bloqueo infrahisiano, umbrales de estimulación elevados y en aquellos en los que se planee ablación del nódulo auriculoventricular, aunque la adherencia actual es baja (20% según encuestas europeas9), y se emplea sobre todo en este último escenario.
Estimulación del área de rama izquierda del haz de HisEn el caso de la RIHH, los materiales y la técnica son similares. Sin embargo, dado que el electrograma de la RIHH no es mapeable desde el lado derecho, la posición de atornillado se determina mediante marcadores subrogados. Inicialmente, la técnica se describió buscando el hisiograma y atornillando ligeramente distal y caudal6. En dicha posición, la topoestimulación suele tener una morfología Rs en cara inferior, con mayor R en DII respecto a DIII, que es el marcador de mayor sensibilidad para el éxito. La presencia de una incisura (notch) en el nadir de V1 con morfología de W, si bien sigue vigente, no aparece en hasta el 20% de implantes con éxito10. Muchos centros han abandonado el hisiograma como referencia y se basan en la anatomía fluoroscópica junto con topoestimulación. La inyección de contraste para asegurar una posición septal puede ser de ayuda. Al igual que en el HH, se ha descrito el uso de navegación electroanatómica.
Una vez determinada la posición, se procede a la penetración del electrodo transmitiendo el torque al cable. Es importante forzar ligeramente la posición de la vaina contra el septo con torque antihorario y una ligera tracción hacia adelante, buscando el máximo soporte. Se recomienda monitorizar la progresión en proyección oblicua anterior izquierda 30-40°. Las primeras revoluciones del cable deben ser rápidas y con presión hacia adelante para atravesar el endocardio.
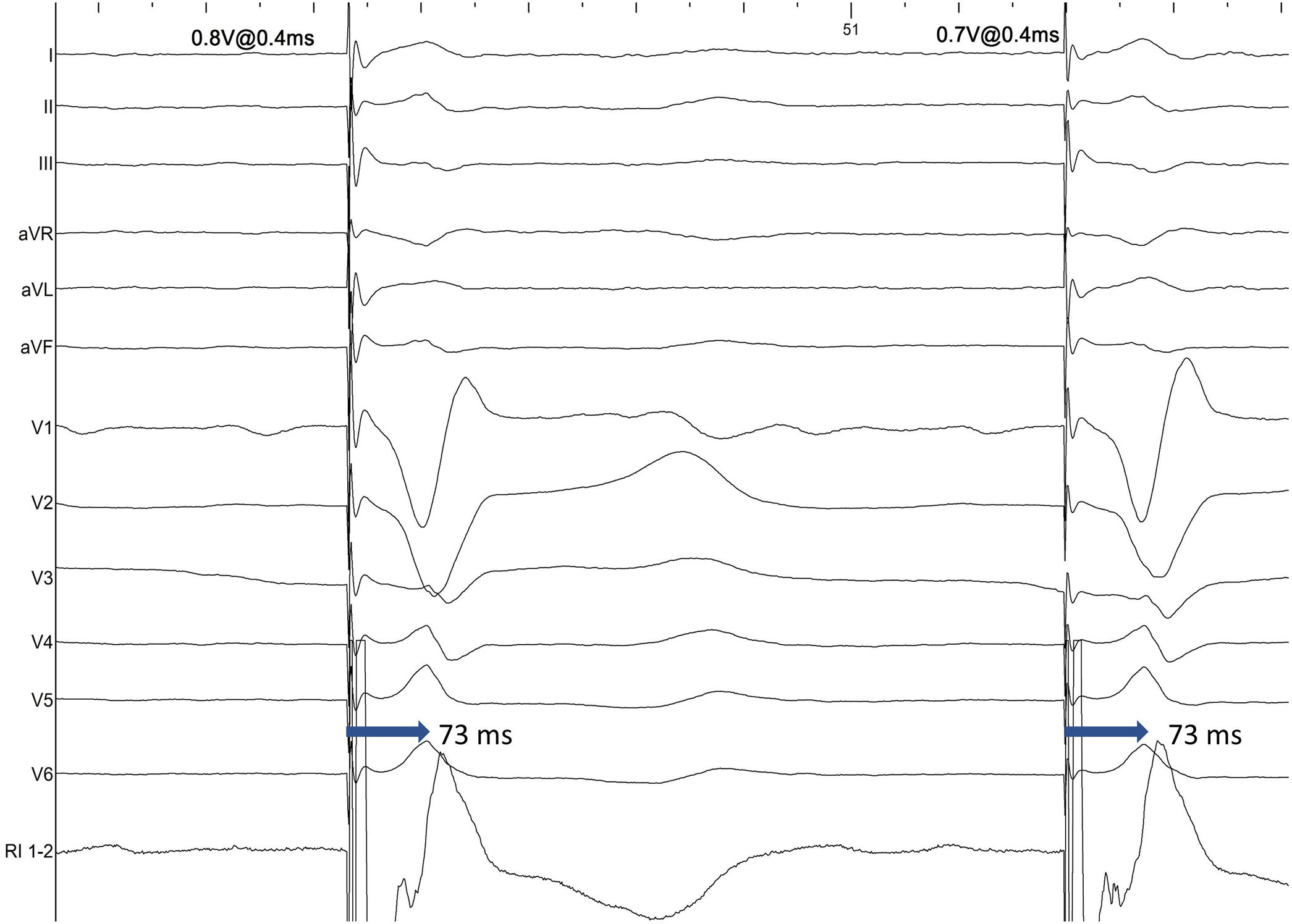
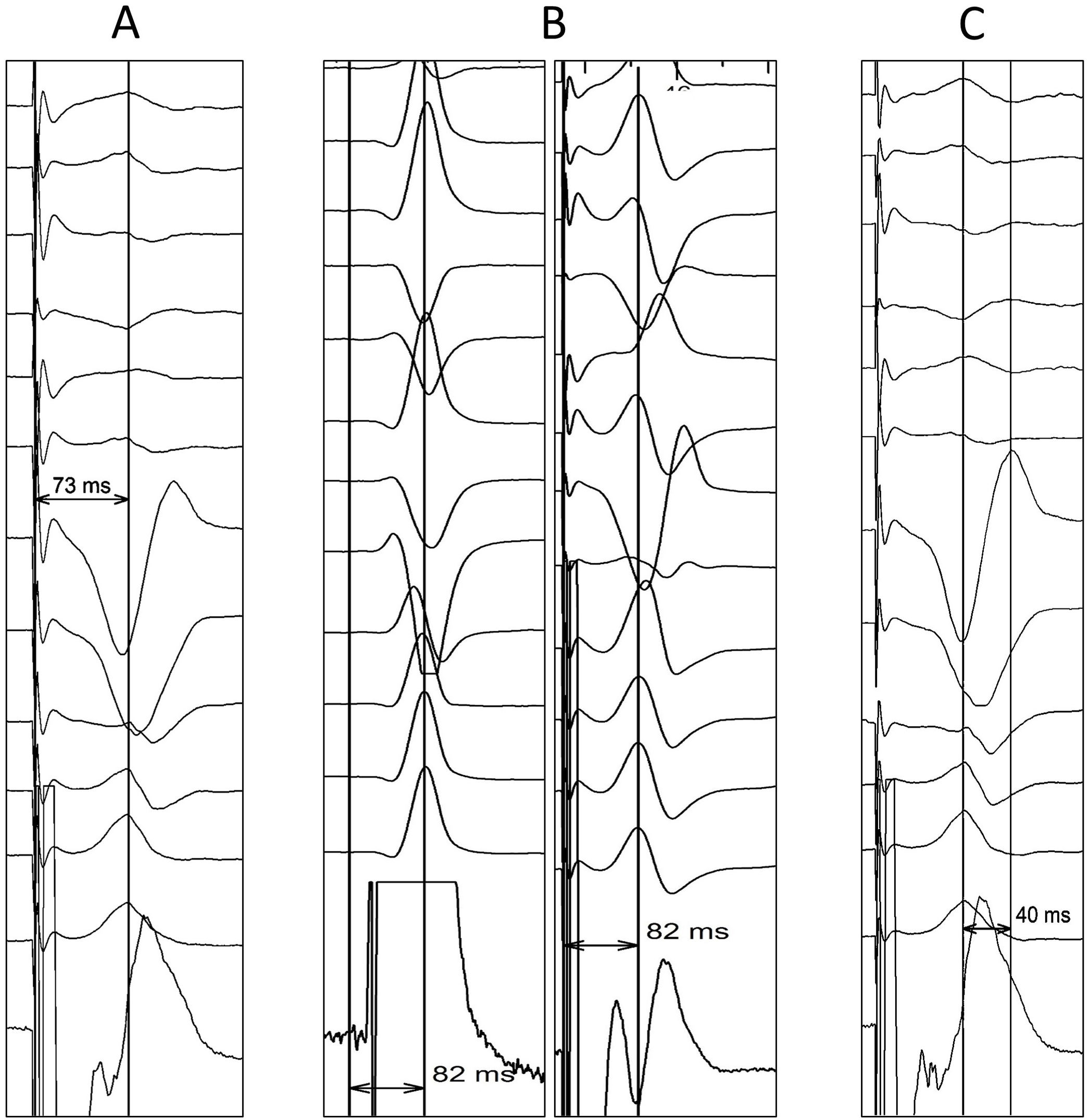
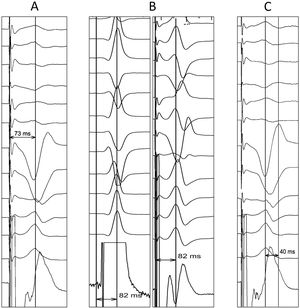
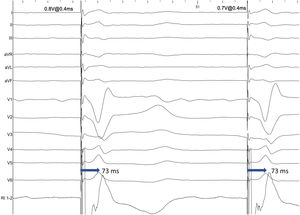
La validación de la captura de RIHH es más compleja que la hisiana, pues el potencial de RIHH solo fue observable en el 26,4% de los pacientes, según el registro MELOS8. El patrón oro es la presencia de captura diferencial (transición no selectiva-selectiva o no selectiva-miocárdica; fig. 5), comenzando desde energías altas (por ejemplo, 5V a 0,4-0,5ms) y en unipolar, ya que el umbral anódico añade un factor de confusión. Es más fácil de observar inmediatamente tras atornillar, puesto que los umbrales miocárdicos bajan rápidamente y la ventana diferencial pasa a ser muy estrecha. Si no se logra observar, es preferible recurrir a mediciones sobre puntos reproducibles del QRS. Por ello, un salto en el tiempo de activación del ventrículo izquierdo (LVAT) medido como el intervalo de tiempo entre la espiga de estimulación y el pico de la onda R en V6>15ms se admite como un marcador de captura diferencial. Pese a que la especificidad es del 100%, la sensibilidad descrita varía del 26,4-75,4%2, por lo que existen otros parámetros complementarios:
- •
LVAT: tiempos <75ms en pacientes con QRS basal estrecho o <80ms en pacientes con enfermedad His-Purkinje son altamente específicos de captura de RIHH (fig. 6A). Sin embargo la sensibilidad es relativamente baja (≈40%), y no está validado cuando el QRS en V6 carece de R dominante.
- •
LVAT nativo frente a estimulado (fig. 6B). En caso de captura de RIHH, el tiempo de conducción intrínseca desde el potencial de RIHH al pico de la onda R en V6 debería ser superponible al tiempo desde la espiga de estimulación al pico de la onda R en V6 (con margen de +10ms).
- •
Tiempo interpico V6-V1 (fig. 6C). Tiempos>44ms entre el pico de la onda R en V6 y el pico de la onda R’ en V1 son 100% específicos (se recomienda un punto de corte óptimo de 33ms). No está clara su aplicabilidad en pacientes con rS en V6.
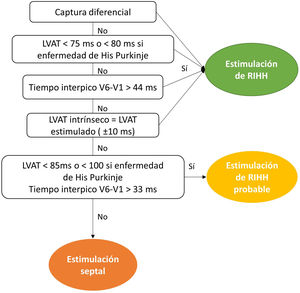
La figura 7 muestra un algoritmo similar al propuesto por la European Heart Rhythm Association para la validación de la captura de RIHH, empleando algunos de estos parámetros2.
Algoritmo de validación de captura de rama izquierda del haz de His propuesto por la European Heart Rhythm Association2.
Si no se han obtenido criterios de captura de RIHH, se debe seguir atornillando hasta comprobar una posición subendocárdica izquierda. Si pese a ello no se valida la posición, se procederá a recolocación. Los datos que indican cercanía al endocardio izquierdo son:
- •
Impedancia unipolar baja (en torno a 350Ohm para cables con estilete y 500 sin él). Continuar atornillando tiene riesgo de perforación a ventrículo izquierdo.
- •
Pérdida de corriente de lesión. Caídas bruscas o señales <3-5mV sugieren posiciones adyacentes al endocardio izquierdo.
Por último, se procedería a la retirada de la vaina. Dada la estabilidad de los parámetros de RIHH, no hay recomendaciones generales para cables de back-up, y la decisión depende de la experiencia del operador y del riesgo de asistolia.
Otras consideraciones técnicasAmbas técnicas utilizan tanto electrodos sin luz interna como electrodos con estilete. Estos últimos son más robustos, por lo que precisan de menor soporte de la vaina y permiten una fácil recolocación a posiciones convencionales. Sin embargo, la hélice extensible es más frágil y puede dañarse en los reposicionamientos. Las vainas más utilizadas son de curva fija, existiendo gran variedad de morfologías y longitudes, aunque existe también una vaina dedicada deflectable.
Respecto a los generadores, actualmente no existen dispositivos dedicados, empleándose los de marcapasos o resincronizadores convencionales. En pacientes candidatos a desfibrilador, existen 2 estrategias: el uso de un generador de desfibrilador-resincronizador, con conexión del electrodo de HH/RIHH al puerto dedicado al VI (IS-1), o el empleo de un desfibrilador con conexión DF1 (tipo «tridente»), con aislamiento de la conexión IS-1 del electrodo de desfibrilación y conexión en su lugar del electrodo del HH/RIHH, siendo esta segunda opción más barata y facilitando la programación del dispositivo. Para estrategias de estimulación híbrida, tipo terapia de resincronización cardiaca optimizada del haz de His/rama izquierda (conocida como HOT/LOT-CRT) en la que se emplean simultáneamente un electrodo de estimulación de HH/RIHH propio de la EF y un electrodo en seno coronario propio de la terapia de resincronización (TRC), solo se podrá optar a conexión DF4 en caso de que el paciente no precise cable auricular, en cuyo caso se conectará el cable de EF en dicho lugar.
Complicaciones y limitacionesLa principal limitación de la estimulación del HH es la estabilidad de sus parámetros: los umbrales aumentan en aproximadamente un 20% de pacientes y hasta un 11% requieren reintervención11. Sin embargo, la estimulación de RIHH tiene un perfil muy seguro, con parámetros estables en el tiempo.
Una de las complicaciones más frecuentes de la estimulación de RIHH es la perforación del septo interventricular, reportada hasta en el 14,1% de pacientes aunque menor en centros expertos2. Sin embargo, siempre y cuando se reconozca durante la intervención (por visualización directa fluoroscópica o parámetros indirectos, como la caída en la impedancia de estimulación en unipolar o disminución de la amplitud de la corriente de lesión) y se lleve a cabo una recolocación del cable, es excepcional que implique secuelas.
La tasa de macrodislocación de los cables de EF es comparable a los de ápex de VD, y habitualmente se relaciona con posiciones poco progresadas en el septo o a un apoyo insuficiente. Hasta un tercio de los pacientes pueden experimentar empeoramiento de la insuficiencia tricuspídea, más frecuente con electrodos en posición más basal. Se ha descrito daño coronario directo, aunque con escasas consecuencias.
Por último, hay 2 aspectos grises en la literatura: el comportamiento a largo plazo de los electrodos, especialmente en los puntos de cizalladura, y su extracción.
Evidencia científicaEstimulación fisiológica como alternativa a la terapia de resincronizaciónDada la gran evidencia del beneficio de la TRC en pacientes con insuficiencia cardiaca y fracción de eyección del ventrículo izquierdo (FEVI) reducida, la EF comenzó a utilizarse como estrategia de rescate en pacientes en los que el implante de un electrodo en seno coronario no resultaba factible (por anatomía desfavorable, malos umbrales o captura frénica) o en no-respondedores. Con el avance de la técnica, y dada su relativa facilidad, comenzó a expandirse su uso también como alternativa, sobre todo en escenarios con menor evidencia del beneficio de la TRC convencional (p.ej., en pacientes con necesidad de estimulación permanente y FEVI intermedia).
El ensayo His-SYNC12 fue el primer estudio aleatorizado en comparar la EF con la TRC convencional. En este estudio multicéntrico se aleatorizaron 41 pacientes con insuficiencia cardiaca e indicación de TRC por guías a recibir estimulación del HH o TRC convencional, con cross-over si el electrodo de HH no lograba un estrechamiento suficiente del QRS o el umbral de captura resultaba inaceptable, o si no se lograba el implante del electrodo de seno coronario o existía captura frénica, lo que ocurrió en el 48% y 26% de pacientes, respectivamente. En el análisis por intención de tratar, la estimulación del HH no demostró superioridad en términos de estrechamiento del QRS o mejoría de la FEVI a 6 meses, tampoco en hospitalización o muerte cardiovascular al año. Sin embargo, en el análisis por protocolo13, la estimulación del HH sí demostró un mayor estrechamiento del QRS (124±19ms en el grupo EF comparado con 162±24ms en el grupo TRC, p<0,001) y una tendencia a mayor respuesta ecocardiográfica (91% versus 54%, p=0,078). Por su parte, el estudio His-Alternative14 aleatorizó a 50 pacientes con insuficiencia cardiaca, FEVI ≤35% y bloqueo de RIHH a recibir estimulación del HH o TRC convencional, con cross-over de una a otra estrategia en caso de no lograr aceptables umbrales de captura del HH o imposibilidad para implantar el electrodo en seno coronario, lo que ocurrió en el 28% y 4%, respectivamente. En el análisis por intención de tratar, la mejoría en FEVI fue similar (16±7% con HH y 13±6% con TRC convencional), así como la mejoría en parámetros clínicos y físicos, aunque a expensas de mayores umbrales de captura a corto y medio plazo (1,8±1,2V con HH y 1,2±0,8V con TRC, p<0,01, en el implante y 2,3±1,4V con HH y 1,4±0,5 con TRC, p<0,01 a 6 meses), observándose una mayor FEVI a 6 meses y un menor volumen telesistólico con HH comparado con TRC convencional en el análisis por protocolo.
El estudio LBBP-RESYNC15 fue el primer estudio aleatorizado en emplear la estimulación de RIHH. Este estudio multicéntrico aleatorizó a 40 pacientes con miocardiopatía dilatada no isquémica, insuficiencia cardiaca, FEVI ≤40% y bloqueo de RIHH a recibir estimulación de RIHH o TRC convencional, con cross-over en caso de no lograr captura de RIHH, o si no se lograba implante en seno coronario, existía captura frénica o umbrales altos en dicha posición, lo que ocurrió en el 10% y 20%, respectivamente. La estimulación de RIHH resultó en una mayor mejoría de la FEVI a 6 meses (diferencia de 5,6% por intención de tratar y 7,5% por protocolo, ambas estadísticamente significativas), con similar beneficio en parámetros clínicos o de volúmenes ventriculares. El estudio español LEVET-AT16 aleatorizó a 70 pacientes con indicación de TRC por insuficiencia cardiaca, FEVI ≤35% y QRS ancho o por bloqueo auriculoventricular completo y disfunción ventricular a recibir EF (HH o RIHH) o TRC convencional. Se permitió el cross-over si no se cumplían criterios de EF o el umbral era inaceptablemente alto, o si no se lograba el implante en seno coronario, existía captura frénica o el umbral era elevado en esta posición, lo que ocurrió en el 22,8% y 5,7%, respectivamente. El estudio, potenciado para demostrar la no-inferioridad de la EF, encontró una disminución similar del LVAT y del volumen telesistólico del ventrículo, con una tasa similar de ingreso y mortalidad cardiovasculares a 6 meses.
Una reciente revisión sistemática que incluyó los resultados de estos ensayos clínicos y otros estudios observacionales que emplearon estimulación del HH y de RIHH encontró un incremento en la mejoría en la duración media del QRS de −20,3ms y de la FEVI del 5,2%, así como en parámetros de clase funcional, de la EF respecto a TRC convencional, sin diferencias entre modalidades de EF, aunque con significativamente menores umbrales de estimulación para la RIHH17.
Grandes estudios observacionales multicéntricos recientemente publicados comparando la estimulación de RIHH con la TRC convencional como primera línea en pacientes candidatos a esta última mostraron mayor reducción de la anchura del QRS e incremento de la FEVI18, así como una reducción en el end-point combinado de supervivencia libre de ingreso por insuficiencia cardiaca o mortalidad (20,8% vs. 28%; hazard ratio [HR] 1,495; intervalo de confianza del 95% [IC95%] 1,213-1,842; p<0,001)19.
Por su parte, el empleo de electrodos de EF en combinación con electrodos implantados en el seno coronario (HOT/LOT-CRT) ha demostrado superioridad frente a la terapia TRC convencional y a la estimulación del HH en términos de estrechamiento del QRS20 y de LVAT21, sin que existan estudios comparativos que hayan demostrado su superioridad clínica frente a ninguna de las otras terapias en solitario o que avalen su empleo a pesar de su mayor complejidad.
Estimulación fisiológica como alternativa a la estimulación convencionalEl implante de marcapasos es una terapia habitual en pacientes con fibrilación auricular y mal control farmacológico de la frecuencia cardiaca, especialmente en aquellos con insuficiencia cardiaca o disfunción ventricular por taquimiocardiopatía, bien con estimulación ventricular derecha o biventricular. Aunque no hay estudios aleatorizados que comparen la EF frente a la estrategia convencional, se ha observado que la estimulación del HH o RIHH frente a esta (ventricular derecha o biventricular) resultaría en mayor o similar estrechamiento del QRS y mejoría de la FEVI, con una disminución en la mortalidad y el ingreso por insuficiencia cardiaca (HR 0,61, IC95% 0,42-0,89, p<0,01) tras algo más de 2 años de seguimiento22.
En pacientes sin disfunción ventricular y con indicación de estimulación cardiaca por bradicardia o trastornos de la conducción auriculoventricular la evidencia científica es más escasa, con pocos ensayos clínicos que comparen la EF frente a la estimulación ventricular derecha convencional, la mayoría centrados en analizar la mejoría en parámetros electrocardiográficos o ecocardiográficos. Un metaanálisis que incluyó fundamentalmente estudios observacionales en pacientes que recibían estimulación cardiaca por motivos diversos (disfunción sinusal, trastornos de la conducción auriculoventricular o fibrilación auricular lenta) señala la eficacia y seguridad de la EF en este escenario, sobre todo de la estimulación de RIHH, con menor ensanchamiento del QRS y reducción de la FEVI, así como menor tasa de hospitalización por insuficiencia cardiaca (OR 0,18, IC95% 0,05-0,5), en los pacientes que recibieron EF. Sin embargo, la tasa de complicaciones relacionadas con el electrodo fue menor con la estimulación ventricular derecha convencional (OR 0,18, IC95% 0,03-0,7 comparado con estimulación del HH, OR 0,10, IC95% 0,01-0,83 comparado con RIHH)23.
Dos grandes ensayos clínicos aleatorizados que incluirán pacientes con FEVI preservada e indicación de implante de marcapasos con una proporción significativa esperable de estimulación (>40%) se encuentran en marcha, LEAP-Block (NCT04730921) y PROTECT-SYNC (NCT05585411). Tratarán de arrojar luz sobre la utilidad de la EF en población general con necesidad de estimulación.
Perspectivas futurasEl futuro de la EF pasa por continuar generando evidencia que permita hacer recomendaciones sobre su aplicación en distintos escenarios clínicos, que quede recogida en documentos de consenso y guías de práctica clínica y sea respaldada por las principales sociedades científicas. Hoy día, la práctica ausencia de éstas en multitud de escenarios condiciona una enorme heterogeneidad en su implementación (incluso dentro de un mismo centro).
Actualmente continuamos usando material no diseñado específicamente para su uso en EF, como sucede con los electrodos con estilete, y existen dudas acerca de su durabilidad a largo plazo. Los electrodos sin luz, diseñados inicialmente para estimular His, presentarían menor rigidez y por tanto una menor transmisión de los movimientos de torque, así como mayor riesgo de torsión dentro de la vaina y la imposibilidad para estimular al mismo tiempo que se penetra el septo. Aún no se han determinado las características del mejor electrodo para EF, que podría pasar por incorporar características de ambos diseños24. Además, la posibilidad de extraer un electrodo desde una posición septal profunda está bajo investigación.
Tampoco existen comercialmente disponibles generadores ni modos de programación dirigidos a EF, lo cual condiciona que la selección de parámetros resulte compleja, particularmente cuando el objetivo es la TRC25, y esté limitada por circunstancias como el ritmo de base del paciente (usándose en ocasiones el puerto auricular para electrodos posicionados en el ventrículo), la morfología del QRS y los umbrales de captura (condicionan la polaridad de estimulación), y obligando a desactivar la mayor parte de los algoritmos automáticos. La ausencia de generadores dedicados limita también su uso en DAI-CRT. Recientemente se ha publicado un estudio usando generadores bicamerales DF-1, con una excelente tasa de identificación y tratamiento de arritmias ventriculares26. Las características de los actuales electrodos de desfibrilación limitan su uso en EF (entre otros motivos por la posición auricular en la que quedaría la bobina), por lo que es un campo abierto al diseño de nuevos materiales.
Por último, se ha intentado aunar la EF y la estimulación sin cables. El dispositivo WiSE-CRT (EBR Systems, Sunnyvale, CA) permite, mediante el implante de un generador y transmisor extracardiacos y un electrodo intracardiaco de pequeño tamaño (9,1×2,6mm con un mecanismo de anclado de 3,6mm) la estimulación sin cables desde el subendocardio del ventrículo izquierdo. El electrodo se implanta habitualmente en la pared libre del ventrículo izquierdo, pero se ha descrito su implante en el septo interventricular izquierdo logrando una estimulación efectiva de la RIHH27.
ConclusionesA pesar de los grandes avances en cuanto al conocimiento de sus fundamentos, la mayor disponibilidad de materiales que facilitan su implementación, la creciente evidencia científica disponible y el entusiasmo colectivo en la adopción de la técnica, la EF debe aún superar algunos obstáculos y arrojar luz sobre ciertas áreas de incertidumbre para poder convertirse en la modalidad de elección en la estimulación cardiaca permanente.
FinanciaciónEsta revisión no ha contado con financiación.
Contribución de los autoresTodos los autores han contribuido sustancialmente a la concepción y redacción del artículo, han dado la aprobación a la versión final y asumen las responsabilidades sobre todos los aspectos del mismo.
Conflicto de interesesNinguno.