Evaluar el tratamiento y aplicación de las recomendaciones de las guías europeas del tratamiento de fibrilación auricular (FA), en una cohorte contemporánea de pacientes con FA.
MétodosREGUEIFA es un estudio observacional, prospectivo y multicéntrico de pacientes con diagnóstico primario o secundario de FA que residen en la comunidad autónoma de Galicia y son valorados por cardiólogos.
ResultadosSe incluyeron 1.007 pacientes con una edad media de 67 años y 32% mujeres. Un 50% de pacientes tenía enfermedad cardiovascular. La amiodarona fue el fármaco antiarrítmico más utilizado (24,5%). El riesgo tromboembólico fue de 2,3±1,5 en la escala CHA2DS2-VASc y el riesgo hemorrágico de 0,7±0,7 en la escala HAS-BLED. Se prescribió tratamiento con anticoagulantes orales (ACO) en el 91,1%. Una mayor puntuación en la escala CHA2DS2-VASc, y la ablación de FA se identificaron como factores independientes asociados a ACO mientras que la forma paroxística se asoció a no anticoagulación. Se identificaron la edad y la insuficiencia renal como factores independientes de prescripción de antagonistas de la vitamina K mientras que la cardioversión eléctrica y la ablación de FA se asociaron de forma independiente a la prescripción de ACO de acción directa.
ConclusionesEl estudio REGUEIFA proporciona información contemporánea del tratamiento cardiológico de pacientes con FA. La prescripción de ACO fue del 91,1%. Se describen los factores independientes asociados a la prescripción de ACO y de ACO de acción directa.
To assess the management and implementation of the European Society of Cardiology Guidelines on atrial fibrillation (AF), in a contemporary cohort of AF patients.
MethodsREGUEIFA is a prospective, multicenter and observational study of patients diagnosed with primary or secondary AF, dwelling in the region of Galicia and evaluated by cardiologists.
ResultsOne thousand and seven patients have been recruited. Mean age was 67±11 years and 32% were women. Fifty percent of patients have underlying cardiovascular disease. Amiodarone was the antiarrhythmic drug more often used (24,5%). The thromboembolic risk assessed by CHA2DS2-VASc score was 2.3±1.5 and the bleeding risk assessed by HASBLED score was 0.7±0.7. Oral anticoagulant therapy (OAC) was prescribed in 90.1%. CHA2DS2-VASc score, hypertension and AF ablation were independent predictor factors of OAC and paroxysmal AF was associated with no anticoagulation. Age and renal insufficiency, were independent predictor factors of vitamin K antagonists prescription whereas electrical cardioversion and AF ablation were independent predictor factors of direct oral anticoagulation therapy prescription.
ConclusionsREGUEIFA registry provides contemporary information on AF management by cardiologists. Prescription of OAC was 91,1%. Independent predictor factors associated with OAC and direct oral anticoagulation prescription were described.
La fibrilación auricular (FA) y sus consecuencias clínicas constituyen un problema de salud de primera magnitud por su elevado coste sociosanitario y el esperado incremento de prevalencia en las próximas décadas1–4. Las guías de práctica clínica de la European Society of Cardiology (ESC) de 2016 indican que el tratamiento de la FA engloba múltiples campos de actuación en los que destacan la identificación de nuevos factores de riesgo, enfermedades cardiovasculares subyacentes, el tratamiento antitrombótico para prevención de enfermedad cerebrovascular y la estrategia de tratamiento de control de ritmo o frecuencia5. Múltiples estudios observacionales han puesto de manifiesto una adherencia subóptima a las guías de práctica clínica6–11 y una mejoría de la adherencia se asocia a un mejor resultado en supervivencia12. También, la implementación de los anticoagulantes de acción directa (ACOD) en el manejo del tratamiento antitrombótico de pacientes con FA no valvular ha ido cambiando las pautas de prescripción a lo largo de los últimos años13–15.
El análisis prospectivo del impacto clínico de la FA en vida real ha sido evaluado en el pasado por varios estudios entre los que se encuentra la Encuesta Europea de FA de 200516 y posteriormente el programa piloto EORP-AF17 (2012-2013), y el EORP (2013-2016) a largo plazo18 así como el estudio GARFIELD19. En ellos se evalúa a más largo plazo la repercusión de la FA sobre la morbimortalidad cardiovascular. No obstante, en los registros del programa EORP-AF se incluyeron pacientes no solo en el ámbito de la cardiología sino también en atención primaria, una variación geográfica grande que hace que el tratamiento sea muy heterogéneo y reclutaron a sus pacientes antes de la publicación de las guías europeas de FA de 2016. Recientemente se ha publicado el diseño de un nuevo registro del programa de la ESC EORP -Atrial Fibrillation III que pretende actualizar la información de los registros previos20. El estudio GARFIELD se ha focalizado en los pacientes con FA de reciente comienzo en la valoración pronóstica y el porcentaje de pacientes con FA crónica es más bajo. El estudio REGUEIFA (Registro Gallego Intercéntrico de Fibrilación Auricular)
pretende evaluar el tratamiento contemporáneo de una población de todo tipo de FA, por especialistas de cardiología en diferentes ámbitos (consulta u hospitalización), y su adecuación a las guías europeas de práctica clínica de FA de 2016.
MétodosEl estudio REGUEIFA pretende evaluar el tratamiento contemporáneo de pacientes con diagnóstico de FA entre los cardiólogos que trabajan en Galicia y proporcionar información de la calidad de vida, eventos clínicos y mortalidad a lo largo de los 2 años de seguimiento del estudio.
ObjetivosLos objetivos generales del estudio son:
- -
Evaluar la aplicación de las recomendaciones de diagnóstico y tratamiento de las guías de la ESC en FA así como reforzar la implementación de dichas guías5.
- -
Analizar el resultado de diferentes estrategias de tratamiento de pacientes con FA.
- -
Promover la implementación de la medicina basada en la evidencia.
Los objetivos específicos del estudio son:
- -
Evaluar el uso del tratamiento antitrombótico en FA (anticoagulantes orales [ACO] con antagonistas de la vitamina K [AVK] o con ACOD±antiagregantes plaquetarios) así como las complicaciones hemorrágicas asociadas. En caso de utilización de AVK, evaluaremos la estabilidad de la razón internacional normalizada a lo largo del tiempo y la persistencia al tratamiento anticoagulante al cabo de 12 y 24 meses.
- -
Evaluar los eventos clínicos vasculares, especialmente el ictus, durante el seguimiento.
- -
Descripción del uso de nuevos fármacos antiarrítmicos así como de nuevas terapias no farmacológicas en el tratamiento en la FA.
- -
Evaluación del tratamiento, tratamiento y complicaciones hemorrágicas y trombóticas del subgrupo de pacientes con FA y cardiopatía isquémica. Conocer la adecuación de la prescripción antitrombótica a las guías de práctica clínica en este subgrupo de pacientes así como el porcentaje de pacientes en tratamiento anticoagulante simple, antiagregante doble, ACO+antiagregación y triple terapia y sus respectivas complicaciones trombóticas y hemorrágicas.
- -
Evaluar los cambios en calidad de vida general por medio del cuestionario EQ5-D y en relación con la anticoagulación (cuestionario Anti-Clot Treatment Scale [ACTS]).
- -
Evaluación de la morbimortalidad de los pacientes con FA al cabo de 2 años.
- -
Estudio de la progresión de la forma paroxística a persistente de la FA.
- -
Evaluar diferencias relacionadas con el sexo en el tratamiento de la FA.
El estudio REGUEIFA es un registro observacional, prospectivo y multicéntrico, de pacientes consecutivos que residen en Galicia y que tienen el diagnóstico primario o secundario de FA. Los pacientes pueden proceder tanto de la planta de hospitalización como de la consulta externa de cardiología o de la unidad de arritmias en aquellos hospitales que tengan esta consulta monográfica.
Los criterios de inclusión son:
- -
Pacientes varones y mujeres≥18 años
- -
Diagnóstico electrocardiográfico o a través de Holter externo o implantable de FA de más de 30s de duración.
- -
Episodio de FA que califica para el reclutamiento se ha producido en el transcurso del último año.
- -
La FA puede ser un diagnóstico primario o secundario (en casos de ingreso hospitalario, la causa que motiva el ingreso puede ser diferente a la arritmia)
- -
El paciente puede estar en ritmo sinusal en el momento de la inclusión.
- -
Firma de consentimiento informado.
Los criterios de exclusión son:
- -
Pacientes cuyo seguimiento a largo plazo no está previsto o no es posible dentro del hospital donde se inscribieron, o con el médico de medicina familiar y comunitaria asociado.
- -
Pacientes con FA secundaria transitoria por causa reversible.
- -
Pacientes que participan en un estudio intervencionista que dicte los tratamientos, la frecuencia de las consultas o los procedimientos diagnósticos.
- -
Flutter auricular aislado.
Se seleccionan 1.007 pacientes desde el 2 enero de 2018 hasta el 27 de febrero de 2020 que se seguirán durante un periodo de 2 años. Se realizará una evaluación de la morbimortalidad total y cardiovascular así como de las hospitalizaciones, eventos tromboembólicos, eventos hemorrágicos, calidad de vida y cambios en la estrategia de tratamiento. Durante los 2 años de seguimiento el paciente realizará las visitas preestablecidas en su especialista de cardiología según la práctica habitual. La información se recogerá en visitas presenciales y del registro de la historia electrónica con los episodios recogidos tanto en atención primaria como en urgencias y atención especializada al cabo de 1 y 2 años respectivamente (fig. 1 del material adicional).
Declaración éticaLa Sociedad Gallega de Cardiología es la patrocinadora y organizadora de este estudio iniciado por investigadores y cuyo protocolo se hace acorde con: a) La declaración de Helsinki.; b) Las pautas vigentes de la Conferencia Internacional sobre Armonización [CIA] para la Buena práctica clínica (BPC) y la Buena práctica farmacoepidemiológica (BPF).; c) Los requisitos éticos y normativos locales aplicables. El registro recibió la aprobación del Comité Ético de Investigación Clínica de Galicia (CEI) con el Código de Registro 2016/376.
Hospitales participantesParticipan 8 hospitales con área sanitaria propia, de la red de asistencia hospitalaria de Galicia que abarcan la atención del 100% de la población gallega. En la figura 2 del material adicional) y la tabla 1 del material adicional se muestran el mapa y los hospitales de atención sanitaria de Galicia
Características de los centrosDe los 8 centros seleccionadores, en 4 de ellos se realizan procedimientos de ablación percutánea de FA y cierre de orejuela, y en 6 de ellos hay una consulta monográfica de arritmias. Todos los pacientes fueron incluidos desde una consulta o una planta de hospitalización de cardiología (tabla 2 material adicional). La evolución global la selección se muestra en la figura 3 del material adicional.
Tratamiento de pacientesTodos los pacientes que cumplan con los criterios de inclusión/exclusión se han considerado para la inscripción y su información se recopiló en el formulario electrónico de inclusión de casos. Los datos recopilados fueron enviados al centro de coordinación del registro, a través de sitios web seguros sin que la confidencialidad haya sido comprometida. Todos los pacientes han recibido la hoja informativa para el paciente y se ha obtenido un consentimiento informado por escrito de acuerdo con los requisitos locales antes de que se lleven a cabo los procedimientos relacionados con el registro (es decir, la transferencia de información de las historias clínicas a los formularios electrónicos de inclusión de casos).
Toda la información relativa al paciente cumple la normativa vigente. Todos los pacientes que den su consentimiento recibieron un número único. Este número es el identificador personal del paciente.
Registro de los datosLos datos se recopilan al inicio, a los 12 y 24 meses. Estos puntos de tiempo se usarán como marcadores para recabar toda la información del periodo intermedio anterior. El objetivo de la recopilación de información es registrar con precisión todas las visitas planificadas y no planificadas, las interrupciones en el tratamiento y los eventos. También se registrarán todos los resultados de la razón internacional normalizada de los pacientes que estén en tratamiento con AVK. Los datos se recogen en un formulario de registro electrónico diseñado por los investigadores principales y elaborado por la empresa Odds S.L.
Garantía de calidad y control de calidadEl supervisor del registro revisará el 10% de todos los formularios electrónicos de inclusión de casos frente a la documentación de origen en los centros del registro de acuerdo con el plan de supervisión.
Las variables que se definen como fundamentales para el análisis estadístico, como los eventos cardiovasculares y mortalidad, estarán sujetas a una revisión electrónica del 100% en intervalos regulares durante el registro.
Análisis estadísticoLas diferencias entre los grupos se evaluaron mediante la prueba χ2 o la prueba exacta de Fisher en el caso de las variables cualitativas. En el caso de las variables cuantitativas se utilizó el prueba de Kruskal-Wallis o el de la U de Mann-Whitney (prueba Mann-Whitney) en función del número de grupos comparados.
Se realizó un análisis de regresión logística para identificar los factores que se relacionan con la prescripción de anticoagulantes. Se seleccionaron para incluir inicialmente en el modelo variables demográficas y clínicas de potencial importancia para el desenlace de interés (anticoagulación en un caso y tipo de anticoagulante usado en otro). El procedimiento utilizado fue por pasos hacia atrás. Las variables iniciales fueron edad, sexo, hipertensión arterial, insuficiencia cardiaca, infarto de miocardio, angina, FA aislada, antecedentes personales de ictus, hemorragia, neoplasia o enfermedad renal, cardioversión previa, cardioversión farmacológica, cardioversión eléctrica, ablación con catéter, tipo de FA (primer episodio, paroxística, persistente, persistente de larga duración y permanente), escala CHA2DS2-VASc y fracción de eyección de ventrículo izquierdo<40%. La prueba estadística utilizada para evaluar la calibración ha sido la prueba de Hosmer-Lemeshow. Como medida de discriminación se utiliza el área bajo la curva (ABC) receiver operating characteristic (ROC). Para el modelo de regresión logística de uso de ACO se obtiene un resultado χ2 Hosmer-Lemeshow=11,57 (p=0,1713) y ABC=0,8171. Para el modelo de regresión logística de uso de ACOD frente a AVK se obtiene un resultado χ2 Hosmer-Lemeshow=5,16 (p=0,7402) y ABC=0,7338. Por tanto, el modelo tiene un ajuste y discriminación adecuados.
Todos los análisis estadísticos se han realizado con el programa estadístico STATA versión 12.
ResultadosCaracterísticas basalesEl estudio REGUEIFA ha incluido a 1.007 pacientes con edad media de 67 años y 32% de mujeres. La hipertensión arterial fue el factor de riesgo más prevalente con el 62% de los casos y un 41% de pacientes eran obesos. Con relación a las patologías concomitantes, un 16% de los casos padecían enfermedad pulmonar obstructiva crónica o apnea del sueño. Entre los antecedentes cardiovasculares, el 50% aproximadamente presentaba enfermedad cardiovascular establecida con una prevalencia de insuficiencia cardiaca del 15% siendo un 41,3% con fracción de eyección del ventrículo izquierdo preservada, un 39,3% con fracción de eyección del ventrículo izquierdo reducida y un 19,3% con fracción de eyección del ventrículo izquierdo intermedia (tabla 3 del material adicional).
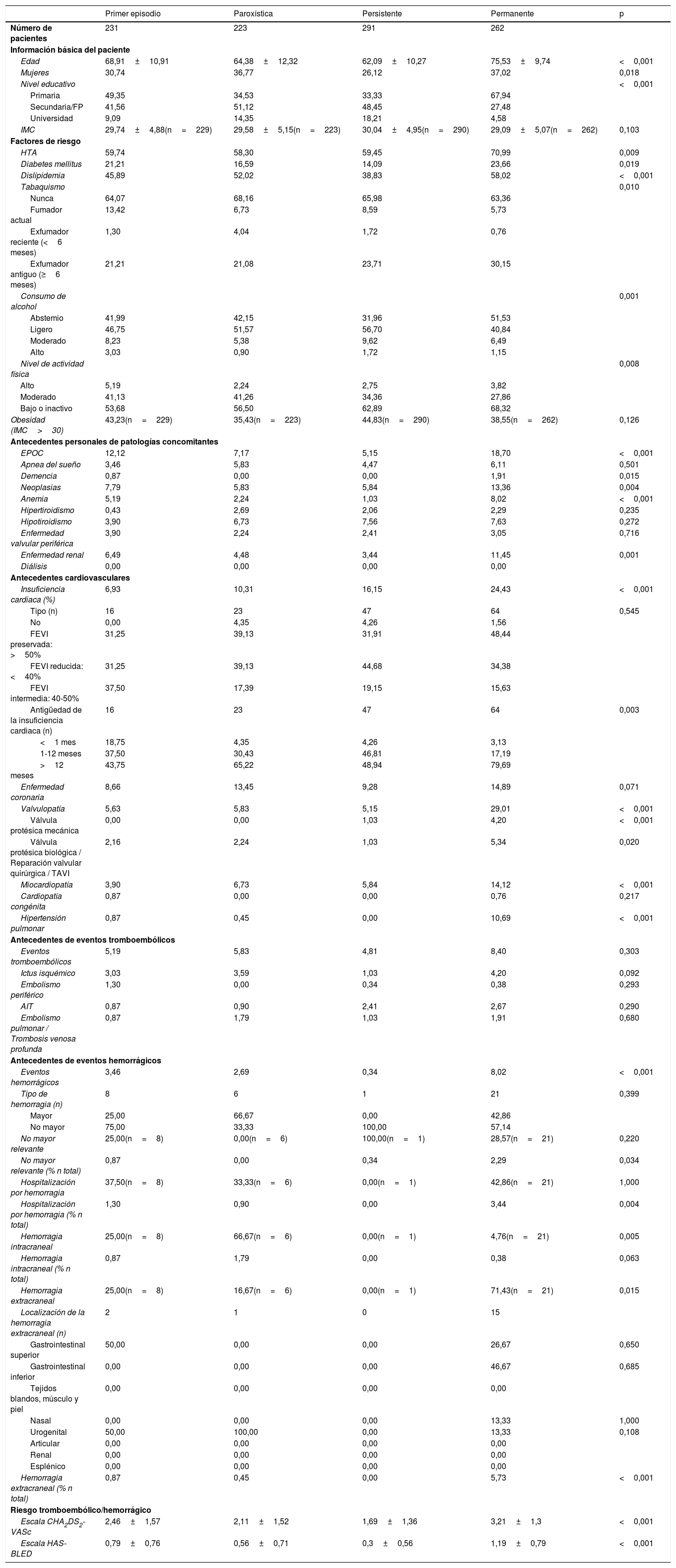
Características basales según tipo de fibrilación auricularLos pacientes con la forma permanente de FA tenían edad más avanzada, mayor porcentaje de mujeres y mayor prevalencia de factores de riesgo como hipertensión arterial, diabetes mellitus y dislipidemia. También tenían significativamente un porcentaje mayor de enfermedades concomitantes como enfermedad pulmonar obstructiva crónica, anemia e insuficiencia renal. Los antecedentes de cardiopatía estructural también fueron significativamente más frecuentes en la forma permanente respecto al resto. Los eventos hemorrágicos previos fueron significativamente más frecuentes en la forma permanente y se observó una tendencia no significativa a mayor número de eventos tromboembólicos previos. Los scores de riesgo CHA2DS2-VASc y HAS-BLED tuvieron puntuaciones significativamente más altas en la forma permanente (tabla 1).
Características basales de los pacientes según el tipo de fibrilación auricular
| Primer episodio | Paroxística | Persistente | Permanente | p | |
|---|---|---|---|---|---|
| Número de pacientes | 231 | 223 | 291 | 262 | |
| Información básica del paciente | |||||
| Edad | 68,91±10,91 | 64,38±12,32 | 62,09±10,27 | 75,53±9,74 | <0,001 |
| Mujeres | 30,74 | 36,77 | 26,12 | 37,02 | 0,018 |
| Nivel educativo | <0,001 | ||||
| Primaria | 49,35 | 34,53 | 33,33 | 67,94 | |
| Secundaria/FP | 41,56 | 51,12 | 48,45 | 27,48 | |
| Universidad | 9,09 | 14,35 | 18,21 | 4,58 | |
| IMC | 29,74±4,88(n=229) | 29,58±5,15(n=223) | 30,04±4,95(n=290) | 29,09±5,07(n=262) | 0,103 |
| Factores de riesgo | |||||
| HTA | 59,74 | 58,30 | 59,45 | 70,99 | 0,009 |
| Diabetes mellitus | 21,21 | 16,59 | 14,09 | 23,66 | 0,019 |
| Dislipidemia | 45,89 | 52,02 | 38,83 | 58,02 | <0,001 |
| Tabaquismo | 0,010 | ||||
| Nunca | 64,07 | 68,16 | 65,98 | 63,36 | |
| Fumador actual | 13,42 | 6,73 | 8,59 | 5,73 | |
| Exfumador reciente (<6 meses) | 1,30 | 4,04 | 1,72 | 0,76 | |
| Exfumador antiguo (≥6 meses) | 21,21 | 21,08 | 23,71 | 30,15 | |
| Consumo de alcohol | 0,001 | ||||
| Abstemio | 41,99 | 42,15 | 31,96 | 51,53 | |
| Ligero | 46,75 | 51,57 | 56,70 | 40,84 | |
| Moderado | 8,23 | 5,38 | 9,62 | 6,49 | |
| Alto | 3,03 | 0,90 | 1,72 | 1,15 | |
| Nivel de actividad física | 0,008 | ||||
| Alto | 5,19 | 2,24 | 2,75 | 3,82 | |
| Moderado | 41,13 | 41,26 | 34,36 | 27,86 | |
| Bajo o inactivo | 53,68 | 56,50 | 62,89 | 68,32 | |
| Obesidad (IMC>30) | 43,23(n=229) | 35,43(n=223) | 44,83(n=290) | 38,55(n=262) | 0,126 |
| Antecedentes personales de patologías concomitantes | |||||
| EPOC | 12,12 | 7,17 | 5,15 | 18,70 | <0,001 |
| Apnea del sueño | 3,46 | 5,83 | 4,47 | 6,11 | 0,501 |
| Demencia | 0,87 | 0,00 | 0,00 | 1,91 | 0,015 |
| Neoplasias | 7,79 | 5,83 | 5,84 | 13,36 | 0,004 |
| Anemia | 5,19 | 2,24 | 1,03 | 8,02 | <0,001 |
| Hipertiroidismo | 0,43 | 2,69 | 2,06 | 2,29 | 0,235 |
| Hipotiroidismo | 3,90 | 6,73 | 7,56 | 7,63 | 0,272 |
| Enfermedad valvular periférica | 3,90 | 2,24 | 2,41 | 3,05 | 0,716 |
| Enfermedad renal | 6,49 | 4,48 | 3,44 | 11,45 | 0,001 |
| Diálisis | 0,00 | 0,00 | 0,00 | 0,00 | |
| Antecedentes cardiovasculares | |||||
| Insuficiencia cardiaca (%) | 6,93 | 10,31 | 16,15 | 24,43 | <0,001 |
| Tipo (n) | 16 | 23 | 47 | 64 | 0,545 |
| No | 0,00 | 4,35 | 4,26 | 1,56 | |
| FEVI preservada: >50% | 31,25 | 39,13 | 31,91 | 48,44 | |
| FEVI reducida: <40% | 31,25 | 39,13 | 44,68 | 34,38 | |
| FEVI intermedia: 40-50% | 37,50 | 17,39 | 19,15 | 15,63 | |
| Antigüedad de la insuficiencia cardiaca (n) | 16 | 23 | 47 | 64 | 0,003 |
| <1 mes | 18,75 | 4,35 | 4,26 | 3,13 | |
| 1-12 meses | 37,50 | 30,43 | 46,81 | 17,19 | |
| >12 meses | 43,75 | 65,22 | 48,94 | 79,69 | |
| Enfermedad coronaria | 8,66 | 13,45 | 9,28 | 14,89 | 0,071 |
| Valvulopatía | 5,63 | 5,83 | 5,15 | 29,01 | <0,001 |
| Válvula protésica mecánica | 0,00 | 0,00 | 1,03 | 4,20 | <0,001 |
| Válvula protésica biológica / Reparación valvular quirúrgica / TAVI | 2,16 | 2,24 | 1,03 | 5,34 | 0,020 |
| Miocardiopatía | 3,90 | 6,73 | 5,84 | 14,12 | <0,001 |
| Cardiopatía congénita | 0,87 | 0,00 | 0,00 | 0,76 | 0,217 |
| Hipertensión pulmonar | 0,87 | 0,45 | 0,00 | 10,69 | <0,001 |
| Antecedentes de eventos tromboembólicos | |||||
| Eventos tromboembólicos | 5,19 | 5,83 | 4,81 | 8,40 | 0,303 |
| Ictus isquémico | 3,03 | 3,59 | 1,03 | 4,20 | 0,092 |
| Embolismo periférico | 1,30 | 0,00 | 0,34 | 0,38 | 0,293 |
| AIT | 0,87 | 0,90 | 2,41 | 2,67 | 0,290 |
| Embolismo pulmonar / Trombosis venosa profunda | 0,87 | 1,79 | 1,03 | 1,91 | 0,680 |
| Antecedentes de eventos hemorrágicos | |||||
| Eventos hemorrágicos | 3,46 | 2,69 | 0,34 | 8,02 | <0,001 |
| Tipo de hemorragia (n) | 8 | 6 | 1 | 21 | 0,399 |
| Mayor | 25,00 | 66,67 | 0,00 | 42,86 | |
| No mayor | 75,00 | 33,33 | 100,00 | 57,14 | |
| No mayor relevante | 25,00(n=8) | 0,00(n=6) | 100,00(n=1) | 28,57(n=21) | 0,220 |
| No mayor relevante (% n total) | 0,87 | 0,00 | 0,34 | 2,29 | 0,034 |
| Hospitalización por hemorragia | 37,50(n=8) | 33,33(n=6) | 0,00(n=1) | 42,86(n=21) | 1,000 |
| Hospitalización por hemorragia (% n total) | 1,30 | 0,90 | 0,00 | 3,44 | 0,004 |
| Hemorragia intracraneal | 25,00(n=8) | 66,67(n=6) | 0,00(n=1) | 4,76(n=21) | 0,005 |
| Hemorragia intracraneal (% n total) | 0,87 | 1,79 | 0,00 | 0,38 | 0,063 |
| Hemorragia extracraneal | 25,00(n=8) | 16,67(n=6) | 0,00(n=1) | 71,43(n=21) | 0,015 |
| Localización de la hemorragia extracraneal (n) | 2 | 1 | 0 | 15 | |
| Gastrointestinal superior | 50,00 | 0,00 | 0,00 | 26,67 | 0,650 |
| Gastrointestinal inferior | 0,00 | 0,00 | 0,00 | 46,67 | 0,685 |
| Tejidos blandos, músculo y piel | 0,00 | 0,00 | 0,00 | 0,00 | |
| Nasal | 0,00 | 0,00 | 0,00 | 13,33 | 1,000 |
| Urogenital | 50,00 | 100,00 | 0,00 | 13,33 | 0,108 |
| Articular | 0,00 | 0,00 | 0,00 | 0,00 | |
| Renal | 0,00 | 0,00 | 0,00 | 0,00 | |
| Esplénico | 0,00 | 0,00 | 0,00 | 0,00 | |
| Hemorragia extracraneal (% n total) | 0,87 | 0,45 | 0,00 | 5,73 | <0,001 |
| Riesgo tromboembólico/hemorrágico | |||||
| Escala CHA2DS2-VASc | 2,46±1,57 | 2,11±1,52 | 1,69±1,36 | 3,21±1,3 | <0,001 |
| Escala HAS-BLED | 0,79±0,76 | 0,56±0,71 | 0,3±0,56 | 1,19±0,79 | <0,001 |
AIT: accidente isquémico transitorio; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; HTA: hipertensión arterial; IMC: índice de masa corporal; TAVI: implante percutáneo de válvula aórtica.
El 81% de los pacientes consultan por FA y los síntomas atribuibles a la FA más frecuentes fueron disnea (40%) y palpitaciones (38%). Un 34% de los pacientes estaban asintomáticos (clase i de la clasificación de la European Heart Rhythm Association). Los tipos más frecuentes de FA fueron la forma persistente (29%) y permanente con un 26%. Se detectó un primer episodio en el 23% y la forma paroxística en el 22% casos. Se registró una forma de FA aislada en el 23%. Dentro de las formas recurrentes, el tiempo desde el primer episodio hasta la inclusión fue de 54 meses y el número de episodios mensuales 1,24. Se estableció previamente una estrategia de control de ritmo en el 64% (tabla 4 del material adicional).
Procedimientos previosSe realizó una cardioversión eléctrica en el 22,5% de los pacientes (66% de los dirigidos a estrategia de control de ritmo), ablación de venas pulmonares en el 7,5% de los pacientes (un 19% de los de control de ritmo), ablación de flutter auricular común en el 5% de los casos y tenían dispositivo previo (marcapasos o desfibrilador) un 10% de pacientes.
Procedimientos programadosTras la consulta o hospitalización del paciente se estableció una estrategia de control de ritmo en el 68% de los pacientes y se programaron intervenciones para restaurar el ritmo sinusal en el 54%, siendo la cardioversión eléctrica el procedimiento más frecuente con el 28% de casos, seguido de la ablación con catéter con el 17% y la cardioversión farmacológica con el 2,6%.
Se realizó un ecocardiograma transtorácico al 93,5% de los pacientes y ecocardiograma transesofágico en el 5% (tabla 5 del material adicional).
Eventos tromboembólicos y hemorrágicos previosLa tasa de eventos tromboembólicos previos en la población basal del estudio fue del 6% y la tasa de eventos hemorrágicos del 3,5%. Entre ellas un 0,7% del total fueron hemorragias intracraneales y un 39% de los pacientes con evento hemorrágico tuvieron que ser hospitalizados. La puntuación de la escala CHA2DS2-VASc fue de 2,35±1,54 y la HAS-BLED 0,7±0,78 (tabla 3 del material adicional).
Controles de la razón internacional normalizadaRespecto a los controles de coagulación, se realizaron en centros de atención primaria en el 91% de los casos. Se revisaron los últimos 6 controles consecutivos de los pacientes crónicamente sometidos a ACO con AVK sin que hubiera interrupción del tratamiento con ACO. El tiempo en rango terapéutico según método de Rosendaal fue de 54,88±26,27% y el porcentaje de pacientes con tiempo en rango terapéutico<65% fue del 63% de los casos (tabla 5 del material adicional).
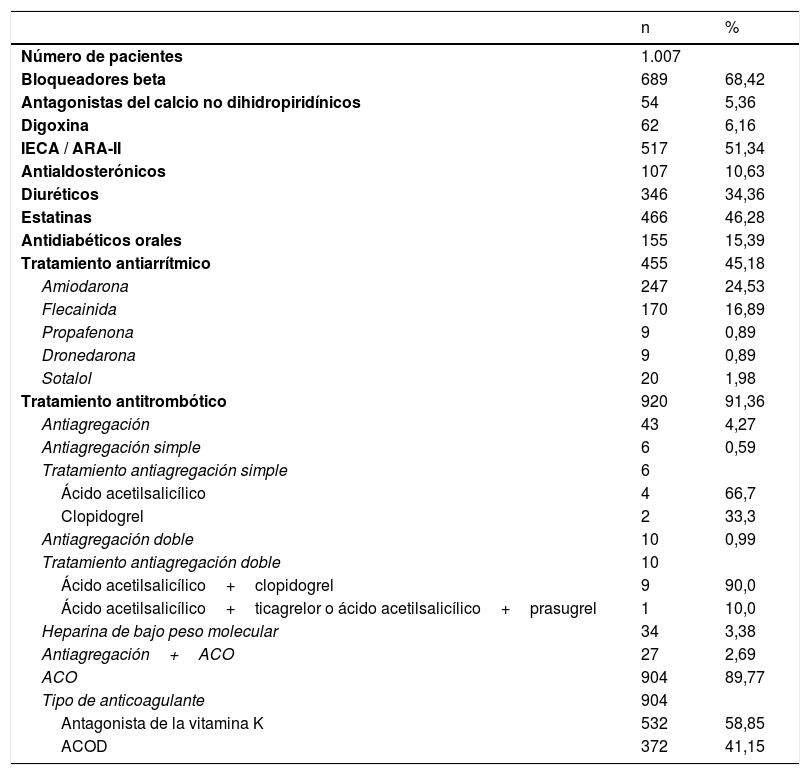
Tratamiento farmacológico antiarrítmico/antitrombóticoEl tratamiento antiarrítmico más frecuentemente prescrito tras consulta u hospitalización fue la amiodarona con el 24,5% de los pacientes seguido de flecainida con el 16,9%. Amiodarona fue también el fármaco más utilizado para la cardioversión farmacológica aguda (tabla 2).
Tratamiento farmacológico al alta hospitalaria o de la consulta
| n | % | |
|---|---|---|
| Número de pacientes | 1.007 | |
| Bloqueadores beta | 689 | 68,42 |
| Antagonistas del calcio no dihidropiridínicos | 54 | 5,36 |
| Digoxina | 62 | 6,16 |
| IECA / ARA-II | 517 | 51,34 |
| Antialdosterónicos | 107 | 10,63 |
| Diuréticos | 346 | 34,36 |
| Estatinas | 466 | 46,28 |
| Antidiabéticos orales | 155 | 15,39 |
| Tratamiento antiarrítmico | 455 | 45,18 |
| Amiodarona | 247 | 24,53 |
| Flecainida | 170 | 16,89 |
| Propafenona | 9 | 0,89 |
| Dronedarona | 9 | 0,89 |
| Sotalol | 20 | 1,98 |
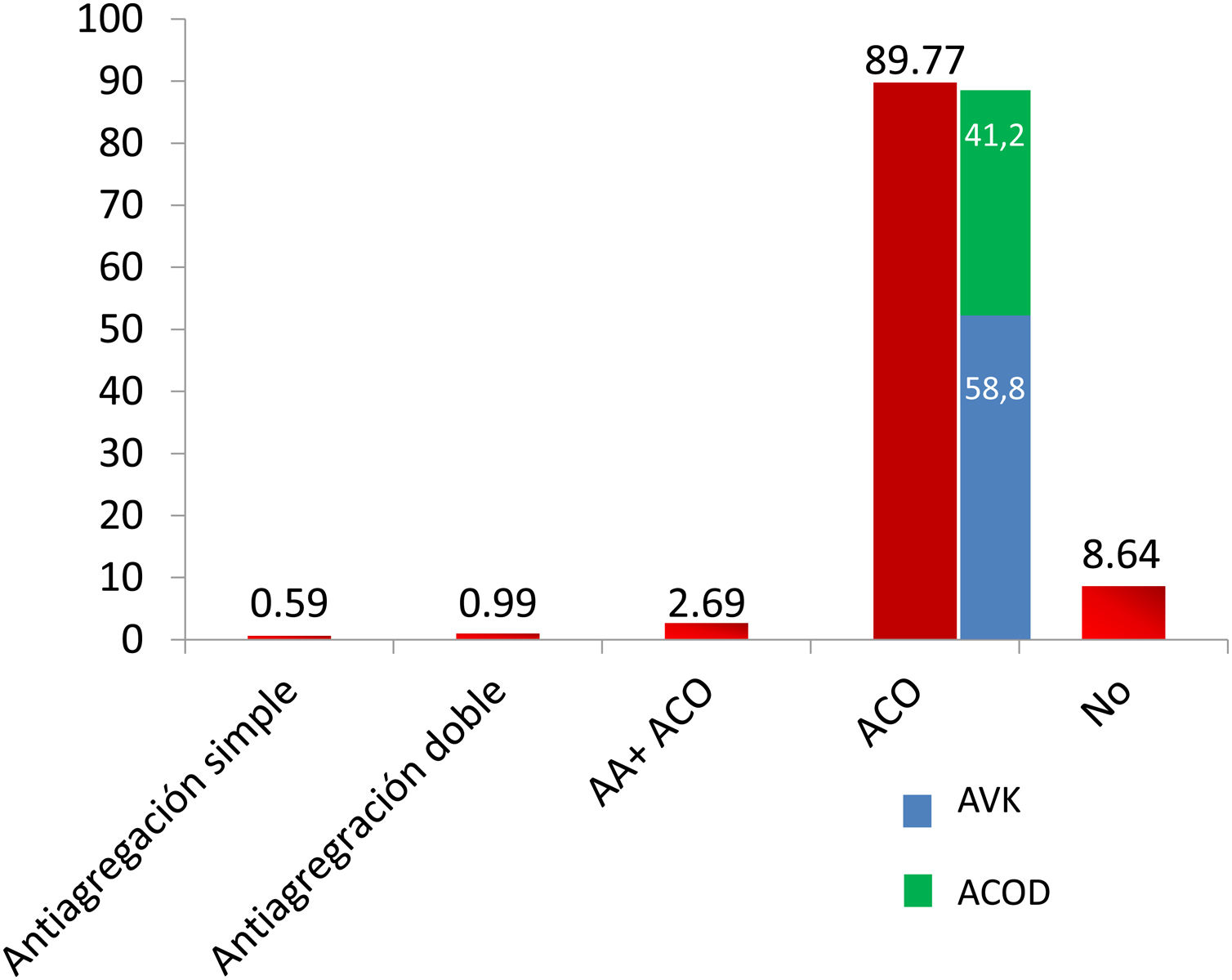
| Tratamiento antitrombótico | 920 | 91,36 |
| Antiagregación | 43 | 4,27 |
| Antiagregación simple | 6 | 0,59 |
| Tratamiento antiagregación simple | 6 | |
| Ácido acetilsalicílico | 4 | 66,7 |
| Clopidogrel | 2 | 33,3 |
| Antiagregación doble | 10 | 0,99 |
| Tratamiento antiagregación doble | 10 | |
| Ácido acetilsalicílico+clopidogrel | 9 | 90,0 |
| Ácido acetilsalicílico+ticagrelor o ácido acetilsalicílico+prasugrel | 1 | 10,0 |
| Heparina de bajo peso molecular | 34 | 3,38 |
| Antiagregación+ACO | 27 | 2,69 |
| ACO | 904 | 89,77 |
| Tipo de anticoagulante | 904 | |
| Antagonista de la vitamina K | 532 | 58,85 |
| ACOD | 372 | 41,15 |
ARA-II: antagonista del receptor de la angiotensina II; ACO: anticoagulantes orales; ACOD: anticoagulantes orales de acción directa; IECA: inhibidores de la enzima de conversión de la angiotensina.
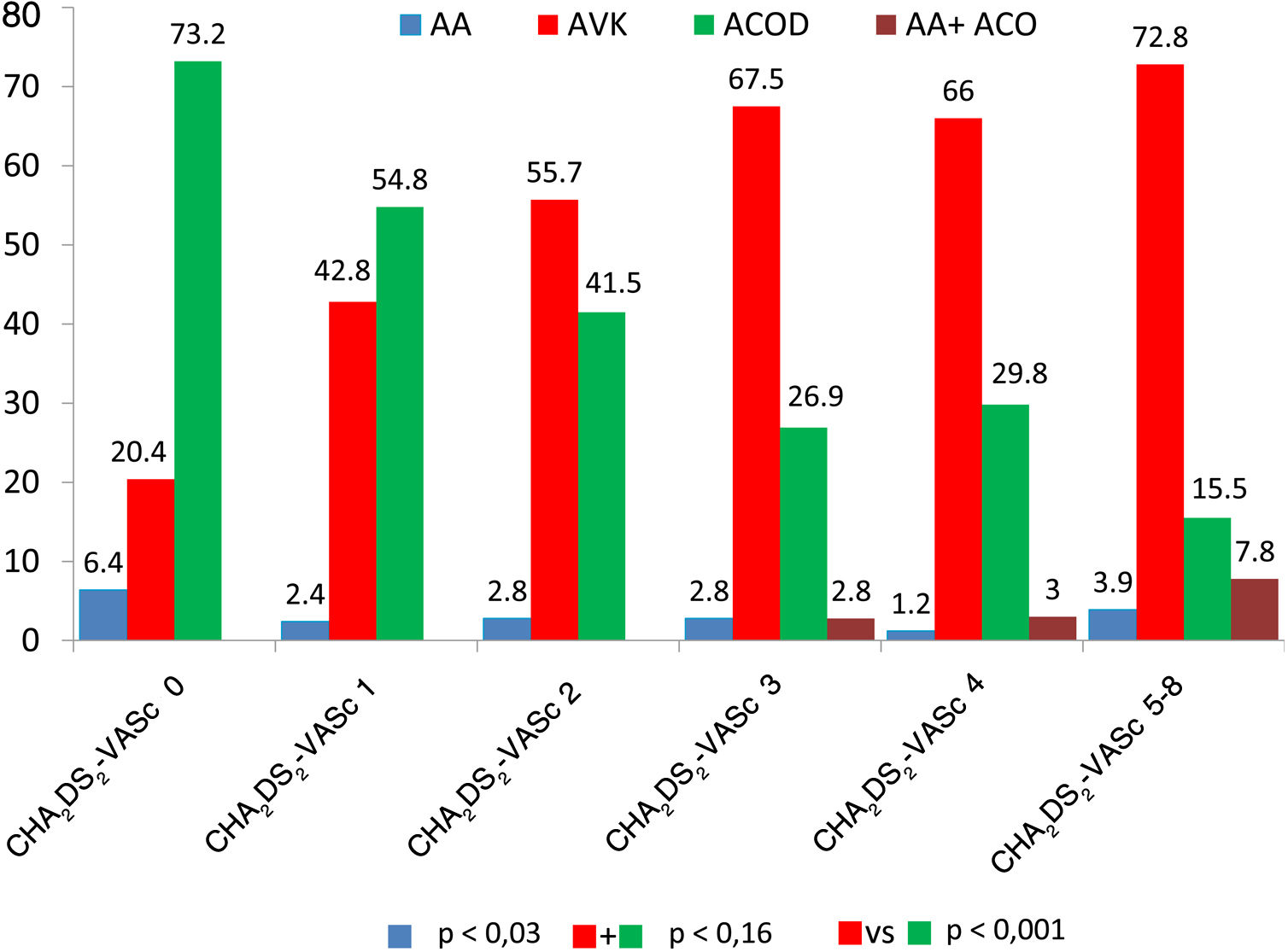
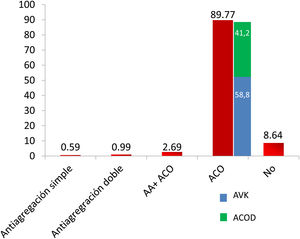
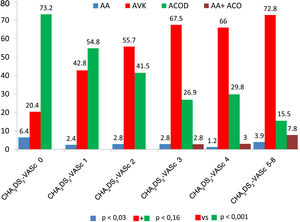
Recibieron tratamiento antitrombótico al alta de la consulta o de la hospitalización el 92,5% de los pacientes. A un 4,27% del total se prescribió antiagregación (simple: 0,59%; doble: 0,99%; triple con AVK: 2,69%), heparinas de bajo peso molecular al 3,38%; ACO al 91,1% (simple: 88,43% [AVK: 58,85%; ACOD: 41,15%] y antiagregación+ACO al 2,69%) de los pacientes (tabla 2 y fig. 1). Los pacientes bajo tratamiento antitrombótico tenían un CHA2DS2-VASc significativamente más alto (2,47±1,50), que los pacientes que no estaban en tratamiento antitrombótico (0,85±1,32; p<0,001). Se evidenciaron diferencias significativas en el tratamiento antitrombótico ajustado por la puntuación CHA2DS2-VASc de forma global (figura 4 del material adicional) y entre los distintos tipos de tratamiento antitrombótico ajustadas por la puntuación CHA2DS2-VASc (fig. 2).
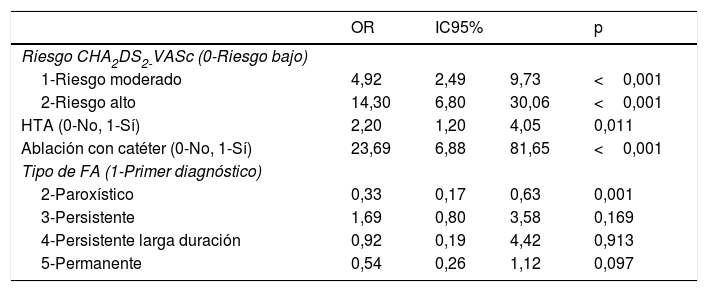
Se ha realizado un modelo de regresión logística para identificar las variables independientes predictoras de prescripción de ACO. En el modelo final, los pacientes con valores más altos de la escala CHA2DS2-VASc, hipertensión arterial y sometidos a ablación de FA se asociaron significativamente a prescripción de tratamiento anticoagulante mientras que la forma paroxística se asoció a no anticoagulación (tabla 3).
Modelo de regresión logístico multivariante final para anticoagulantes orales
| OR | IC95% | p | ||
|---|---|---|---|---|
| Riesgo CHA2DS2-VASc (0-Riesgo bajo) | ||||
| 1-Riesgo moderado | 4,92 | 2,49 | 9,73 | <0,001 |
| 2-Riesgo alto | 14,30 | 6,80 | 30,06 | <0,001 |
| HTA (0-No, 1-Sí) | 2,20 | 1,20 | 4,05 | 0,011 |
| Ablación con catéter (0-No, 1-Sí) | 23,69 | 6,88 | 81,65 | <0,001 |
| Tipo de FA (1-Primer diagnóstico) | ||||
| 2-Paroxístico | 0,33 | 0,17 | 0,63 | 0,001 |
| 3-Persistente | 1,69 | 0,80 | 3,58 | 0,169 |
| 4-Persistente larga duración | 0,92 | 0,19 | 4,42 | 0,913 |
| 5-Permanente | 0,54 | 0,26 | 1,12 | 0,097 |
FA: fibrilación auricular; HTA: hipertensión arterial; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Variable respuesta: Anticoagulación (0=No y 1=Sí)
Variables independientes: edad, escala CHA2DS2-VASc (riesgo CHA2DS2-VASc, cuyas categorías son: 0=riesgo bajo (escala CHA2DS2-VASc=0); 1=riesgo moderado (escala CHA2DS2-VASc=1); 2=riesgo alto (escala CHA2DS2-VASc≥2), sexo, HTA, insuficiencia cardiaca, infarto de miocardio previo, angina, fibrilación auricular aislada, ictus previo, hemorragia previa, neoplasia, enfermedad renal, cardioversión previa, fracción de eyección de ventrículo izquierdo reducida (<40%), cardioversión eléctrica, ablación con catéter, tipo de fibrilación auricular.
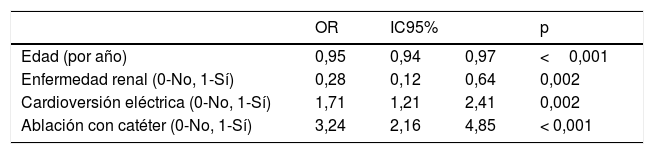
Se ha realizado un modelo de regresión logística para identificar las variables independientes predictoras de utilización de ACOD frente a AVK. En el modelo final la edad y la insuficiencia renal se asociaron con la prescripción de AVK mientras que la realización de una cardioversión eléctrica y una ablación a la prescripción de ACOD (tabla 4).
Modelo logístico multivariante final para tipo de anticoagulantes orales (antagonistas de la vitamina K o ACOD)
| OR | IC95% | p | ||
|---|---|---|---|---|
| Edad (por año) | 0,95 | 0,94 | 0,97 | <0,001 |
| Enfermedad renal (0-No, 1-Sí) | 0,28 | 0,12 | 0,64 | 0,002 |
| Cardioversión eléctrica (0-No, 1-Sí) | 1,71 | 1,21 | 2,41 | 0,002 |
| Ablación con catéter (0-No, 1-Sí) | 3,24 | 2,16 | 4,85 | < 0,001 |
IC95%: intervalo de confianza del 95%, OR: odds ratio.
Variable respuesta: Tipo de anticoagulante (0=AVK y 1=ACOD).
Variables independientes: edad, sexo, hipertensión arterial, infarto de miocardio previo, angina, fibrilación auricular aislada, ictus previo, hemorragia previa, neoplasia, enfermedad renal, cardioversión previa, cardioversión farmacológica, cardioversión eléctrica, ablación con catéter, tipo de fibrilación auricular.
Los datos basales muestran algunas diferencias con los registros prospectivos de mayor relevancia. La edad media (67,6 años) es más baja que la de la mayoría de los registros contemporáneos (GARFIELD: 69,8 años19, EORP-AF: 69 años18) y la proporción de mujeres sensiblemente inferior (el 32% frente al 40-43%18,19). Los pacientes con antecedentes de infarto previo y de insuficiencia cardiaca fueron el 11% y el 15% respectivamente. Esta proporción es significativamente más baja que la observada en otros registros donde se sitúa entre el 20, 30 y hasta 50%6–8,18. Estas diferencias se deben probablemente a un menor porcentaje de pacientes incluidos desde hospitalización cardiovascular (33%) respecto a otros registros (50%)18. El porcentaje de pacientes con eventos tromboembólicos isquémicos previos es semejante a otros registros y el de eventos hemorrágicos es del 3,5%, inferior al de otros registros, relacionado con valores de las escala de riesgo de tromboembolismo y hemorragia más bajos8,15,18.
Tipos de fibrilación auricularSe observa un equilibrio entre los diferentes tipos de FA con la forma persistente como las más frecuente (29,9%). Difiere de GARFIELD8,19 donde el primer diagnóstico es el más frecuente con más del 45% de los casos, ya que se trata de un registro de FA recientemente diagnosticada, o del registro EORP-AF18 donde se han incluido pacientes con formas más evolucionadas de FA (FA permanente: 33%) probablemente porque el reclutamiento se hizo no solo desde cardiología sino también desde otras especialidades médicas incluyendo atención primaria. Este hecho es relevante pues se ha observado tanto en un subanálisis del estudio ENGAGE21, como del estudio ARISTOTLE22 una mayor tasa de ictus isquémico en la FA permanente respecto a la FA paroxística. Además se ha publicado una mayor tasa de mortalidad cardiovascular en la forma permanente (4,49 / 100 pacientes-año) respecto a la paroxística (3,16 /100 pacientes-año)21.
Tratamiento antitrombóticoEn el estudio REGUEIFA, el 92,6% de los pacientes recibieron algún tratamiento antitrombótico, siendo indicada la ACO en el 91,1% de los casos (88,3% ACO aislada y 2,69% ACO+antiagregación). Esta cifra es la más alta de todos los registros prospectivos publicados, superando ampliamente el 60,8% de GARFIELD19 y el 84,9% de EORP-AF18, a pesar de que en el estudio REGUEIFA el valor de la escala CHA2DS2-VASc era significativamente más bajo. Probablemente, la razón de ello es multifactorial. Por un lado, la prescripción más alta de anticoagulación por parte de cardiólogos respecto a otras especialidades médicas13 y, por otro, el mayor porcentaje de pacientes en los que se indicó estrategia de control de ritmo (68%) que requiere ACO para la restauración del ritmo sinusal independientemente del valor de la escala de riesgo tromboembólica. También es destacable la reducción en el porcentaje de pacientes con antiagregación simple o doble respecto (1,58%) siendo el valor más bajo respecto a todos los estudios publicados6–11,16–19 cuya protección frente a eventos tromboembólicos es muy inferior a la ACO8,18.
Tipo de tratamiento antitrombóticoLos pacientes con CHA2DS2-VASc más bajos (0 y 1) tuvieron una prescripción significativamente mayor de ACOD que los pacientes con CHA2DS2-VASc más elevado (≥2) que tuvieron una prescripción significativamente mayor de AVK. No hay una explicación clínica para ello, aunque sí está en relación con la organización de los procedimientos de restauración del ritmo sinusal. Las autoridades sanitarias han permitido la introducción de los ACOD en pacientes a quienes se somete a determinados procedimientos de control de ritmo como la cardioversión eléctrica o la ablación con catéter, pero que no tienen indicación de ACO a largo plazo. Esto ha permitido que estos procedimientos se hayan organizado dando prevalencia al tratamiento con ACOD sobre AVK. Sin embargo, la mayor utilización de AVK sobre ACOD en pacientes con CHA2DS2-VASc elevados (≥2 para un escenario clínico del estudio REGUEIFA en que el tiempo en rango terapéutico es inferior al 57%) no constituye una buena opción terapéutica ya que en estos subgrupos es donde los ACOD han demostrado mayor coste-efectividad sobre el tratamiento con AVK23.
Modelos de regresión logística de anticoagulaciónEn el estudio de los factores independientes predictores de prescripción de ACO destaca que el tipo paroxístico se anticoagula menos frecuentemente que otras formas de FA independientemente del CHA2DS2-VASc. El valor de CHA2DS2-VASc fue de 2,11±1,52 en la forma paroxística, sensiblemente más bajo que en la forma permanente (3,21±1,3), pero similar a la forma persistente (1,69±1,36). Este tratamiento contrasta con la indicación de las guías de práctica clínica de la ESC donde el tipo de FA no es un factor que se contemple para la decisión de la indicación de ACO. Probablemente los subanálisis de ENGAGE21 y ARISTOTLE22, donde la forma paroxística presentaba una menor tasa de ictus isquémico (1,49% y 0,98% anual, respectivamente) desempeñen un papel en esta observación clínica.
Modelos de regresión logística de anticoagulación (ACOD frente a AVK)La menor prescripción de ACOD frente a AVK en pacientes con insuficiencia renal responde a una de las limitaciones de uso de los ACOD. En el estudio ORBIT II, la prescripción de ACOD se asoció también a pacientes más jóvenes, con filtrado glomerular mayor, CHA2DS2-VASc más bajos, en ausencia de ictus previo y nivel educacional más alto24. Sin embargo, la situación es diferente a la del registro REGUEIFA ya que el 75% de las prescripciones en pacientes näive en el registro ORBIT II se hicieron con ACOD24. No parece, sin embargo, justificada la menor utilización de ACOD en pacientes de edad avanzada con valores de las escalas CHA2DS2-VASc y HAS-BLED más altos en los que se ha demostrado mayor beneficio clínico neto en su utilización24. El único factor que parece determinante en su infrautilización en esos subgrupos es la prescripción a largo plazo y la restricción de las autoridades sanitarias para ello. La mayor prescripción de ACOD en cardioversión eléctrica y ablación de FA parece ligado al uso temporal de los ACOD en un perfil de pacientes que no necesitan ACO a largo plazo.
ConclusionesEl estudio REGUEIFA proporciona información del tratamiento contemporáneo de una población de FA manejado por cardiólogos. La prescripción de tratamiento ACO fue del 91,1%. La escala CHA2DS2-VASc, hipertensión arterial y ablación de FA se asociaron significativamente a prescripción de tratamiento anticoagulante mientras que la forma paroxística se asoció a no anticoagulación. La edad y la insuficiencia renal se asociaron con la prescripción de AVK mientras que cardioversión eléctrica y ablación de FA se asociaron a la prescripción de ACOD.
Aunque se han publicado numerosos registros que tratan de valorar aspectos relacionados con el tratamiento y el pronóstico de la FA, la gran mayoría han reclutado sus pacientes antes de la publicación de las guías europeas de práctica clínica sobre el tratamiento de FA de 2016, son heterogéneos y en algunos casos el seguimiento no ha sido adecuado para la valoración de aspectos relacionados con el pronóstico.
¿Qué novedades aporta?El estudio REGUEIFA pretende evaluar el tratamiento contemporáneo de una cohorte de pacientes con FA en Galicia desde cardiología, su adherencia a las guías europeas de práctica clínica sobre el tratamiento de FA de 2016 y realizar un seguimiento de eventos clínicos y pronósticos en un periodo de 2 años.
El estudio ha sido promovido por la Sociedad Galega de Cardioloxía (SOGACAR) y ha recibido financiación de Daiichi-Sankyo.
Conflicto de interesesNinguno.
El estudio REGUEIFA ha sido posible por la colaboración de la Sociedade Galega de Cardioloxía que ha ejercido como promotora del estudio y ha prestado a los investigadores todos los aspectos logísticos para su realización.