En el último año se han producido importantes avances en el conocimiento y el diagnóstico de las arritmias cardiacas, así como en nuevas opciones de tratamiento. En este artículo pretendemos realizar un resumen de los trabajos del año 2019 con interés para los electrofisiólogos, principalmente centrados en el tratamiento intervencionista y los avances en dispositivos electrónicos implantables.
There have been important advances in the understanding and diagnosis of cardiac arrhythmias in the past year, as well as the development of new therapeutic options. In this article, it is intended to provide a summary of the main advances published during 2019 with interest for electrophysiologists, mainly focused on the interventional treatment and advances in cardiac implantable electronic devices.
La electrofisiología cardiaca es un campo en continuo crecimiento, por lo que la producción científica del pasado año ha sido muy cuantiosa. Destacan los avances en el estudio de la caracterización del sustrato arrítmico mediante mapas electroanatómicos de alta densidad, que permiten conocer mejor los mecanismos y el pronóstico, y plantear nuevas estrategias de ablación de arritmias auriculares y ventriculares en poblaciones especiales. Además, novedades tecnológicas permiten crear lesiones miocárdicas más precisas, eficaces o seguras buscando mejorar los resultados en determinados sustratos. En dispositivos implantables, se continúa avanzando en las indicaciones basadas en la evidencia y en tecnologías que eviten los efectos secundarios de los dispositivos convencionales.
En este artículo realizamos un resumen de las publicaciones del año (último trimestre de 2018 y durante 2019) con interés para los electrofisiólogos. Aunque nos hemos centrado en trabajos destacados o con impacto en nuestro medio, nos es imposible abarcar toda la producción científica de este tiempo, por lo que pedimos disculpas de antemano por posibles ausencias de importancia.
Actualizaciones en práctica clínicaLas sociedades científicas han actualizado algunas guías de práctica clínica y aportado nuevos documentos de consenso durante este año. Destacan las guías de tratamiento de las bradiarritmias y los trastornos de la conducción1, enfocadas en una actualización de las recomendaciones de abordaje clínico y uso de terapias de estimulación emergentes, como la estimulación hisiana (EH) y los marcapasos sin cables. Con la evidencia hasta la fecha (mayor efectividad frente a embolia y mejor perfil de seguridad) en la actualización de las guías de fibrilación auricular (FA) norteamericanas2, los anticoagulantes directos son también la primera elección sobre la warfarina en todos los casos, salvo en la estenosis mitral grave o en portadores de válvula cardiaca mecánica. Entre los documentos de consenso, es de gran interés el de ablación de taquicardia ventricular (TV)3, que se actualiza con los avances de los últimos 10 años, y los de uso de desfibriladores implantables (DAI) (programación adaptada a las peculiaridades de cada casa comercial y asistencias ventriculares)4,5. Desde el punto de vista clínico, el documento de consenso sobre arritmias asintomáticas6 intenta arrojar luz sobre el abordaje de estos pacientes en un campo donde la evidencia es más limitada.
Fibrilación auricularDesde el punto de vista clínico, destaca el estudio RACE 7 ACWAS7, que comparó 2 estrategias de control del ritmo (cardioversión precoz<48h o diferida con control inicial de frecuencia) en pacientes con FA reciente, y en el que se observó que la cardioversión eléctrica diferida conseguía unas tasas de ritmo sinusal a las 4 semanas no inferiores a la precoz. Por otro lado, el estudio RACE-38 mostró que un control intensivo de los factores de riesgo y rehabilitación conseguían mejorar los resultados en el mantenimiento del ritmo sinusal.
Respecto a la anticoagulación oral, en el estudio AUGUSTUS9, una estrategia de apixabán más un inhibidor del P2Y12 en pacientes con FA y revascularización reciente conseguía una tasa de hemorragias menor sin incremento de eventos isquémicos en comparación con otras estrategias con antagonistas de la vitamina K y antiagregación. El estudio ELIMINATE10 concluyó que el uso ininterrumpido de edoxabán durante el procedimiento de ablación de FA es seguro. Por último, el documento de consenso del tratamiento perioperatorio de la anticoagulación en los diferentes escenarios clínicos intenta estandarizar la práctica clínica diaria en estas situaciones11.
En el esperado estudio CABANA12, la ablación de la FA no consiguió alcanzar significación en el objetivo primario comparada con el tratamiento médico convencional (reducción de ictus, muerte, sangrado o muerte cardiovascular), aunque redujo las hospitalizaciones de causa cardiovascular. El elevado grado de entrecruzamiento y una tasa baja de eventos podrían haber influido en estos resultados. En un análisis de calidad de vida de este estudio, la ablación fue significativamente mejor a 12 meses de seguimiento13.
Las recidivas tras un procedimiento de ablación se atribuyen generalmente a la baja tasa de desconexión permanente de las venas pulmonares (VP). En este sentido, la utilización de mapas de la aurícula izquierda de ultra alta densidad permite realizar un análisis diferenciado del patrón de reconexión de VP según el tipo de energía utilizada14. En la ablación con radiofrecuencia, el uso de catéteres de contacto con unos parámetros de aplicación preestablecidos y la contigüidad de las lesiones son actualmente los principales determinantes del aislamiento permanente de las VP15,16. Con estos criterios, la reconexión de las VP dejará de ser la norma en los reprocedimientos de ablación, con más de un 60% de los pacientes con todas las VP aisladas17. El abordaje de las recidivas en estos pacientes no está totalmente definido y debe ser individualizado, probablemente extendiendo la ablación a focos extrapulmonares o a la modificación del sustrato (fig. 1)16,17. En esta línea, un análisis inicial del voltaje auricular y su distribución permite identificar a los pacientes que presentarán recidivas al año de seguimiento o que evolucionarán a formas más avanzadas de FA18.
Reprocedimiento de ablación de fibrilación auricular realizado con mapas de alta densidad (Carto 3). En malva, voltaje>0,5mV. A: vista posterior, aislamiento eléctrico en las coronas de ablación previas. B: vista anterior, zona de escara en la porción anterior de la aurícula izquierda. El registro de señal en esta zona detectó zonas de fragmentación y conducción retrasada.
Los primeros resultados clínicos de la ablación de FA con catéteres que permiten el uso de aplicaciones very high power-short duration confirman su seguridad añadiendo un acortamiento significativo de los procedimientos y de la escopia utilizada19. El uso de la electroporación, al provocar una lesión selectiva de la aurícula, permite realizar procedimientos de forma más rápida y segura, con una tasa de desconexión de VP muy alta a 3 meses de seguimiento20.
Ablación con catéter de taquicardia ventricularLa ablación con catéter representa una herramienta de gran utilidad para el abordaje de los episodios recurrentes de TV dependiente de cicatriz. Un metanálisis21 ha mostrado que la ablación es superior al tratamiento farmacológico, sobretodo en TV postinfarto, en términos de recurrencias y tormenta arrítmica, sin beneficio en la mortalidad.
Las técnicas actuales de ablación de TV en pacientes con cardiopatía estructural requieren una adecuada caracterización del sustrato arrítmico. Identificar las zonas de bloqueo/enlentecimiento del frente de onda ayuda a localizar los istmos de conducción. Modificar dichos frentes de onda mediante la estimulación en diferentes puntos permite identificar sustrato adicional y definir mejor el istmo crítico de la TV, especialmente empleando frentes de activación perpendiculares al istmo22.
Shirai et al.23 han mostrado que la identificación del sustrato arrítmico es especialmente compleja en la cardiopatía no isquémica. Además, la menor accesibilidad del sustrato arrítmico en estos pacientes supuso una mayor tasa de inducibilidad al final del procedimiento y de recurrencias. En aras de abordar el sustrato no accesible desde el endocardio, Stevenson et al.24 han comunicado resultados prometedores mediante la ablación con radiofrecuencia con aguja de infusión en 31 pacientes con ablación previa fallida.
Los resultados de la ablación de TV no son homogéneos en los distintos perfiles de pacientes/cardiopatías. Vergara et al.25 han validado la escala I-VT, que permite estimar el riesgo de recurrencia y mortalidad al año de la ablación de TV, lo que podría mejorar la selección de pacientes con mayor probabilidad de beneficiarse de esta técnica.
Cabe destacar los resultados sobre la ablación con catéter en el contexto de la fibrilación ventricular refractaria a fármacos en pacientes isquémicos. En un estudio multicéntrico, el mapeo electroanatómico identificó el disparador de la fibrilación ventricular en latidos prematuros procedentes de fibras de Purkinje situadas en la periferia de la cicatriz a nivel septal26. La ablación de estos focos consiguió el control agudo de la tormenta en el 86% de los casos y una supervivencia intrahospitalaria del 73%.
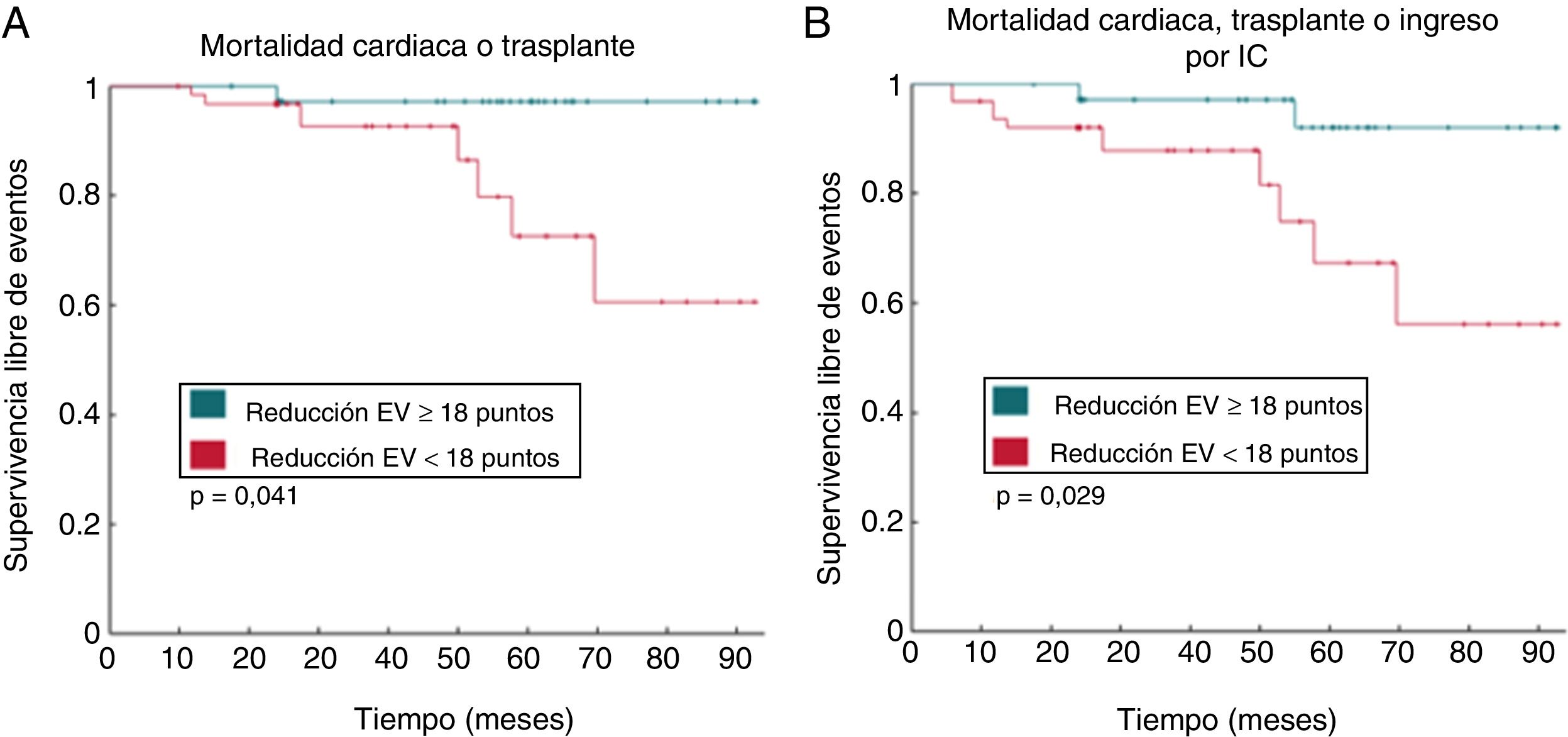
Por otro lado, si bien ya se conocían los beneficios de la ablación de extrasistolia ventricular en términos de función ventricular y parámetros neurohormonales, Berruezo et al.27 han mostrado que la reducción sostenida a largo plazo de la carga de extrasistolia tras la ablación se asocia a una reducción de la mortalidad y de los ingresos por insuficiencia cardiaca, independientemente del tipo de cardiopatía subyacente (fig. 2).
Curvas de supervivencia en pacientes con y sin reducción de la carga de EV≥18 puntos en Holter de 24h a los 6 meses de la ablación. A: objetivo combinado de muerte cardiaca y trasplante cardiaco. B: objetivo combinado de muerte cardiaca, trasplante e ingreso por insuficiencia cardiaca. Modificada de Berruezo et al.27 con permiso.
EV: extrasistolia ventricular; IC: insuficiencia cardiaca.
En el último año se han publicado más datos de SABRUS, un registro retrospectivo internacional de 678 pacientes con síndrome de Brugada y un primer evento arrítmico documentado. Entre las características poblacionales, la enfermedad es rara en mujeres, presenta menor proporción de patrón espontáneo o inducibilidad, pero mayor prevalencia de mutaciones en SCN5A (48 frente a 28%; p=0,007)28. Como grupo, los menores de 20 años tienen mayor riesgo arrítmico y los pacientes asiáticos suelen ser predominantemente varones adultos, con mayor presencia de patrón espontáneo o muerte súbita y menor proporción de mutaciones en SCN5A29,30.
En cuanto a la estratificación de riesgo arrítmico, se confirma la utilidad del DAI profiláctico y como la presencia de síncope o patrón espontáneo se relacionan con un menor tiempo a la descarga31. Por otro lado, los pacientes con patrón inducido y mutaciones en SCN5A (non-missense o missense que afecta a la región transmembrana o al poro) podrían representar una población de mayor riesgo arrítmico en el seguimiento32.
En un registro33 de 672 pacientes con síndrome de Brugada y FA (a menudo asintomática), es llamativa la alta incidencia de accidente cerebrovascular (14%), sin que guarde relación con las escalas de riesgo tromboembólico. La validez de estas observaciones debe ser confirmada en otros estudios. Los autores ponen en valor la detección de FA asintomática con monitorización prolongada en este grupo de pacientes.
Mazzanti et al.34 analizan la utilidad de la quinidina en dosis bajas en el síndrome de Brugada. Aunque en el grupo global no hay diferencias significativas, muestran una llamativa reducción de eventos anuales tras tratar a los supervivientes de muerte súbita con quinidina (14,7 frente a 3,9%; p = 0,03), con pocos efectos secundarios. Sin embargo, persiste un 15% de pacientes con eventos bajo tratamiento, por lo que su uso en pacientes de alto riesgo debe ser coadyuvante al del DAI.
En la TV polimórfica catecolaminérgica se insiste en la importancia del tratamiento médico y de seleccionar cuidadosamente a los candidatos a DAI. Al analizar a 136 pacientes con muerte súbita y posterior diagnóstico de la enfermedad, donde más de la mitad recibieron un DAI, este no aportó mejoras en la supervivencia (3,8% muerte súbita con DAI frente al 0%; p=0,1), a pesar de asociarse frecuentemente a choques apropiados (45%), además de inapropiados y otras complicaciones35. Se han publicado resultados prometedores de la terapia génica en ratones con el uso de virus cardiotropos como vector, consiguiendo inhibir eficaz y selectivamente una proteína cinasa clave en la enfermedad (CaMKII) y suprimir las arritmias36.
Se abre la puerta al tratamiento con mexiletina más allá del QT largo tipo 3. Bos et al.37, en un grupo de pacientes con QT largo tipo 2 tratados con mexiletina, observan retrospectivamente que el intervalo QT corregido se reducía significativamente y quedaban asintomáticos durante un seguimiento de 1,3 años.
Pasados 5 años de la publicación de la escala de riesgo de muerte súbita en la miocardiopatía hipertrófica38, se ha publicado un metanálisis con 7.291 pacientes que confirma la precisión en sus estimaciones y apoya fuertemente su uso39.
El estudio VEST40 no consiguió disminuir la mortalidad arrítmica tras el infarto con la chaqueta desfibriladora, aunque hubo una tendencia a reducir la mortalidad total. Los autores insisten en considerarlo no concluyente. La potencia del estudio, la dificultad para asignar la causa de la muerte o el tiempo que se llevó la chaqueta pueden haber afectado a los resultados.
Arritmias pediátricas y en cardiopatías congénitas del adultoEn el último año se han publicado varios artículos sobre ablación de taquicardia auricular y FA en pacientes con cardiopatías congénitas. El grupo del Royal Brompton Hospital analiza los procedimientos de taquicardia auricular realizados con mapas de alta densidad41 y encuentra que la presencia de 2 o más taquicardias y un área de bajo voltaje indexada≥0,24cm2/ml predicen la recurrencia a un año. Un segundo artículo42 publica también una mayor eficacia aguda en la ablación de taquicardia auricular relacionada con la existencia de un único mecanismo, con mayor tasa de recurrencia en pacientes con reconstrucción de Fontan.
En la ablación de FA destaca un estudio multicéntrico43 sobre la seguridad y la eficacia en pacientes con cardiopatías congénitas simples y complejas. En el seguimiento al año no se encontraron diferencias en recurrencia en función de la complejidad de la cardiopatía (53% de los pacientes sin recidivas); el 71,6% experimentó mejoría clínica, sin existir complicaciones mayores. En las recientemente publicadas guías de tratamiento de arritmias en cardiopatías congénitas44, la ablación de FA puede considerarse en cardiopatías simples en centros con experiencia. Aunque no se contraindica en cardiopatías complejas, no se hace mención expresa en este sentido.
Kimura et al.45 analizan el valor pronóstico del intervalo PR y su prolongación en 176 pacientes con tetralogía de Fallot. En un seguimiento de 10 años, la presencia de bloqueo auriculoventricular de primer grado y el incremento del intervalo PR>2ms/año son factores de riesgo independientes para el desarrollo de arritmias ventriculares letales y bloqueo auriculoventricular completo. El hallazgo es independiente de otros marcadores, aunque se relaciona de forma proporcional y directa con la dilatación del ventrículo derecho. Los autores teorizan sobre la posibilidad de que la propia prolongación del intervalo sea no solo consecuencia, sino causa propiamente dicha de la dilatación ventricular.
En arritmología pediátrica, Alonso-García et al.46 confirman la seguridad de la ablación en centros de referencia en nuestro medio. La ivabradina podría ser útil para el tratamiento de la taquicardia yuncional posquirúrgica, y puede plantearse como alternativa a la amiodarona47. El efecto potencial de la ivabradina sobre la conducción en el nódulo auriculoventricular es objeto de investigación en el estudio BRAKE-AF48, cuyo objetivo es demostrar su eficacia para el control de la frecuencia cardiaca en adultos con FA permanente.
Dispositivos cardiacos implantablesMarcapasos y resincronización cardiacaEl carácter fisiológico de la EH la ha hecho entrar de lleno en el terreno de la resincronización cardiaca. Las recientes guías de tratamiento de los pacientes con bradicardia1 contemplan ya su uso en pacientes con una estimulación prevista mayor del 40% y una función ventricular inferior al 50% (IIb, B-R).
En el primer estudio aleatorizado que compara la estimulación biventricular con la EH en pacientes con indicación de terapia de resincronización (His-SYNC)49, esta demuestra una no inferioridad en cuanto al incremento de la fracción de eyección del ventrículo izquierdo o la reducción de la hospitalización y la muerte cardiovascular. Por otro lado, en pacientes en los que la EH logra un escaso o nulo estrechamiento del QRS o en no respondedores a la resincronización convencional, el estudio HOT-CRT50 combina ambas técnicas y logra así un porcentaje de respuesta clínica del 84% y ecocardiográfica del 92%. Si bien se trata de estudios preliminares, con un número de pacientes y un seguimiento limitados, no deja de ser un prometedor punto de partida de la EH en este campo.
Respecto a la estimulación sin cables, se ha publicado el mayor registro multicéntrico51 hasta la fecha, que incluye 1.817 implantes del dispositivo Micra (Medtronic, EE. UU.). Tras un seguimiento medio de 7 meses, quedan reforzados los buenos resultados descritos en estudios previos, con un éxito en el implante del 99,1% y una tasa de complicaciones mayores a 12 meses del 2,7%.
Desfibriladores implantablesContinúa abierto el debate sobre el papel del DAI en la prevención primaria de la muerte súbita en la miocardiopatía dilatada no isquémica. Un nuevo metanálisis muestra resultados favorables para el implante de DAI en esta población, con una reducción significativa de la mortalidad52. No obstante, con datos procedentes del registro Medicare, añadir la terapia de desfibrilación a la resincronización no mostró beneficios en términos de mortalidad y hospitalizaciones en una población de 5.595 pacientes53.
En cuanto a parámetros de programación, con datos procedentes del registro UMBRELLA, se evaluó la estimulación antitaquicardia antes y durante la carga frente a solamente durante la carga en TV en zona de fibrilación ventricular (longitud de ciclo entre 200 y 320ms), y se observó un aumento en la efectividad general, con reducción en la necesidad de descargas y sin prolongación de los episodios54.
En el ámbito del DAI subcutáneo, continúa la búsqueda de nuevas herramientas que permitan optimizar y predecir su rendimiento. Se ha descrito la escala PRAETORIAN55, cuya finalidad es detectar a los pacientes con una elevada probabilidad de presentar umbrales de desfibrilación incrementados usando únicamente parámetros basados en la radiografía de tórax. Del mismo modo, una evaluación prospectiva de la tecnología SmartPass en una muestra de 1.984 pacientes demostró una reducción significativa de los choques inapropiados, sin suponer un compromiso para la seguridad56.
Infección de dispositivosEl estudio PADIT57, con 19.603 pacientes aleatorizados, indica que una estrategia de profilaxis antibiótica más intensiva no logra reducir la incidencia de infecciones respecto al uso único de cefazolina antes de la cirugía (1,03 frente a 0,78%; p = 0,10). El estudio WRAP-IT58, por el contrario, demuestra una reducción de la incidencia de infecciones (0,7 frente a 1,2%; p = 0,04) con el uso de una bolsa absorbible liberadora de antibióticos (TYRX Absorbable Antibacterial Envelope, Medtronic, Fridley, MN, EE. UU.) en pacientes catalogados como de alto riesgo. No obstante, se trata de una reducción absoluta de 17 pacientes infectados de un total de 3.490 pacientes tratados con TYRX, lo cual permite inferir una necesidad de tratar en torno a 200 pacientes para evitar una infección.
En pacientes con infección ya establecida, el registro europeo ELECTRa59 demuestra que la extracción transvenosa de electrodos es una técnica eficaz y segura, con un éxito total del 95,67%, una incidencia de complicaciones mayores del 1,7% y una mortalidad del 0,34%. Las complicaciones fueron más frecuentes en presencia de 3 o más electrodos para extraer (OR = 3,02; p = 0,0107) o de más de 10 años de antigüedad (OR = 5,13; p=0,0001).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.