La inteligencia artificial (IA) aplicada al análisis del electrocardiograma (ECG) ha mostrado ser prometedora para predecir la morbimortalidad cardiovascular. Este metanálisis evalúa la precisión diagnóstica y pronóstica de algoritmos de deep learning (DL) y machine learning (ML) en la predicción de eventos adversos y mortalidad cardiovascular.
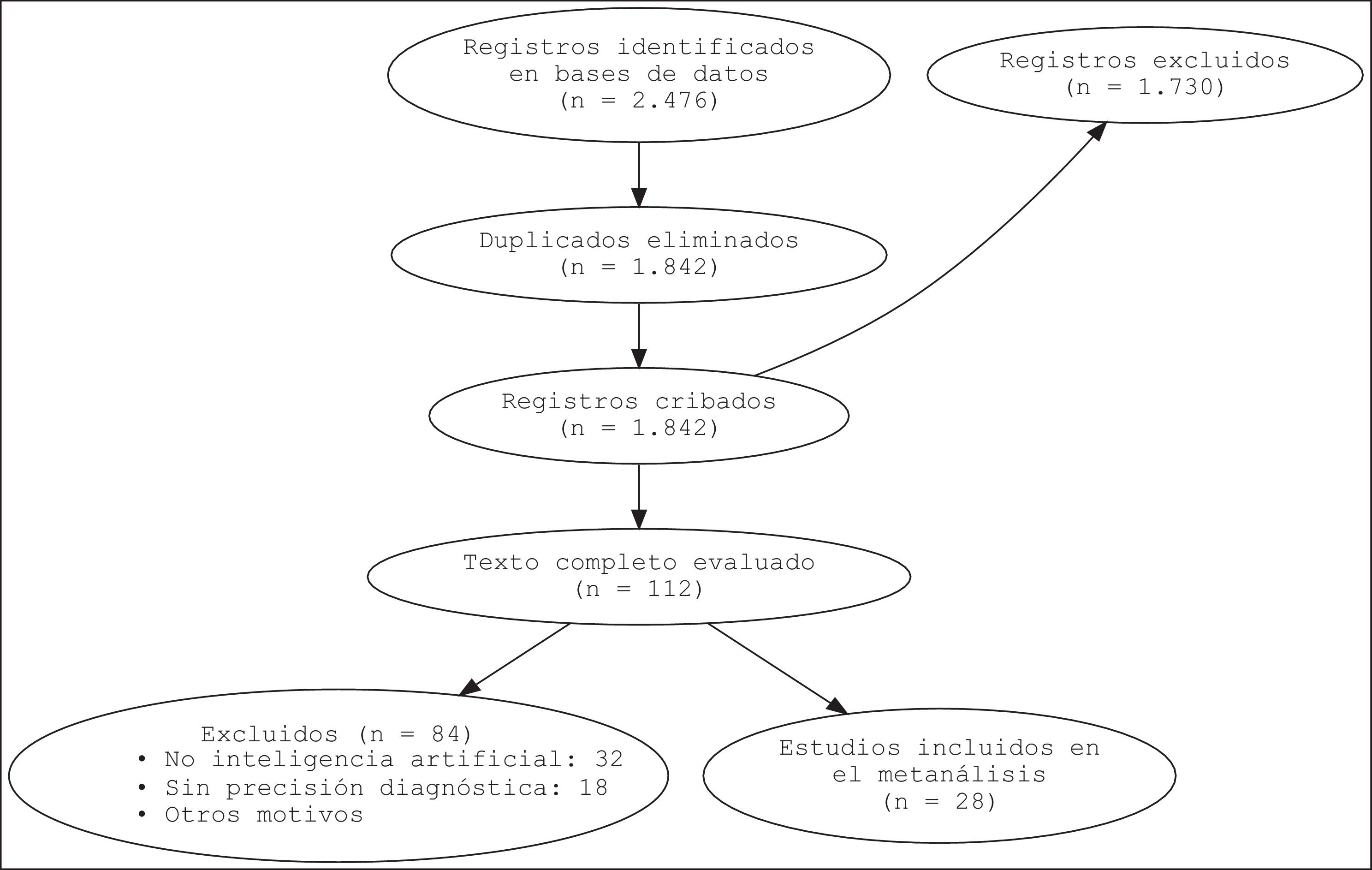
MétodosSe realizó una búsqueda sistemática en las bases de datos como PubMed, Embase, Cochrane y Web of Science (2010-2024). Se incluyó estudios que evaluaron la IA aplicada al ECG para predecir la morbimortalidad, y se calcularon las medidas de precisión diagnóstica mediante metanálisis. El protocolo fue registrado previamente en PROSPERO (CRD420251017753).
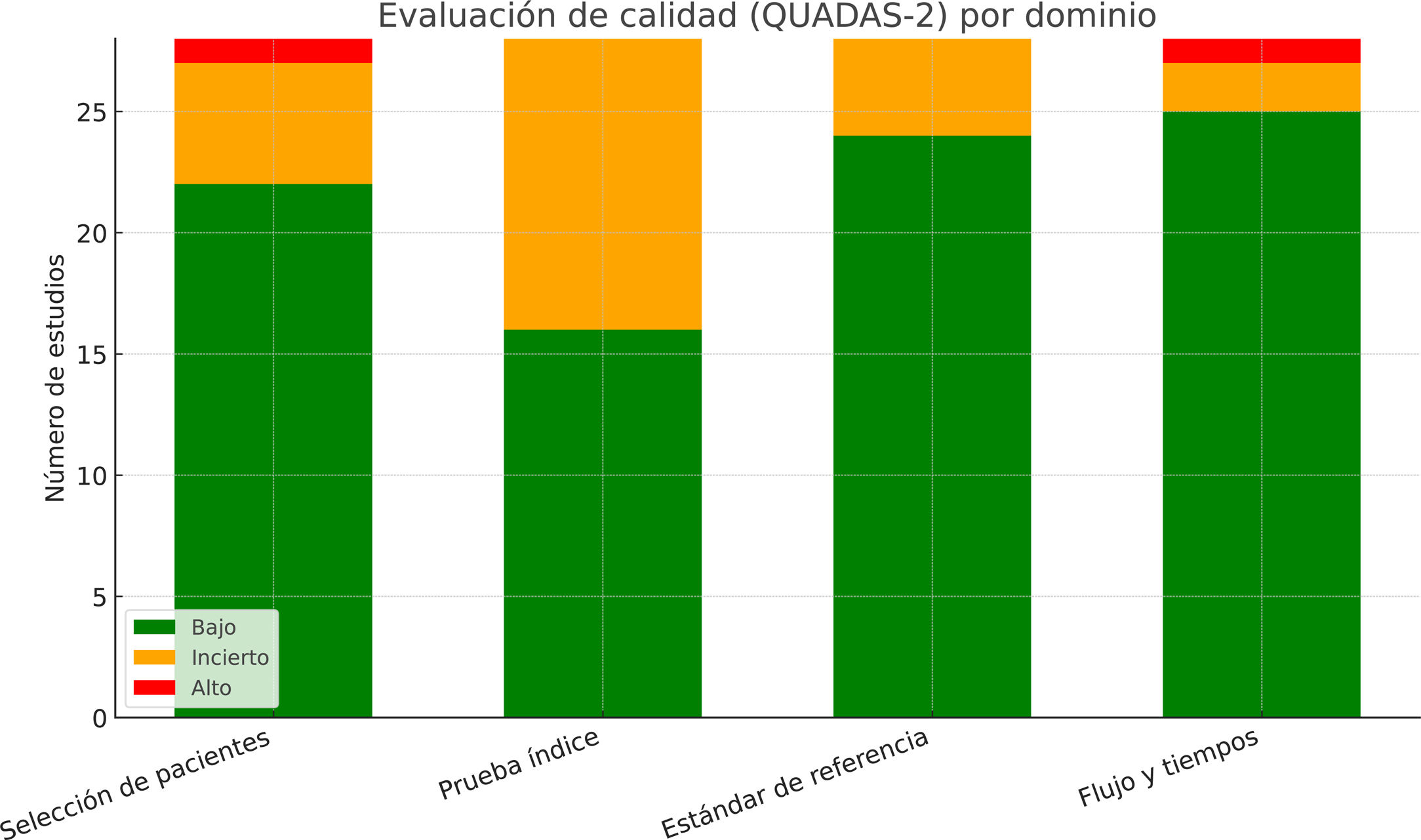
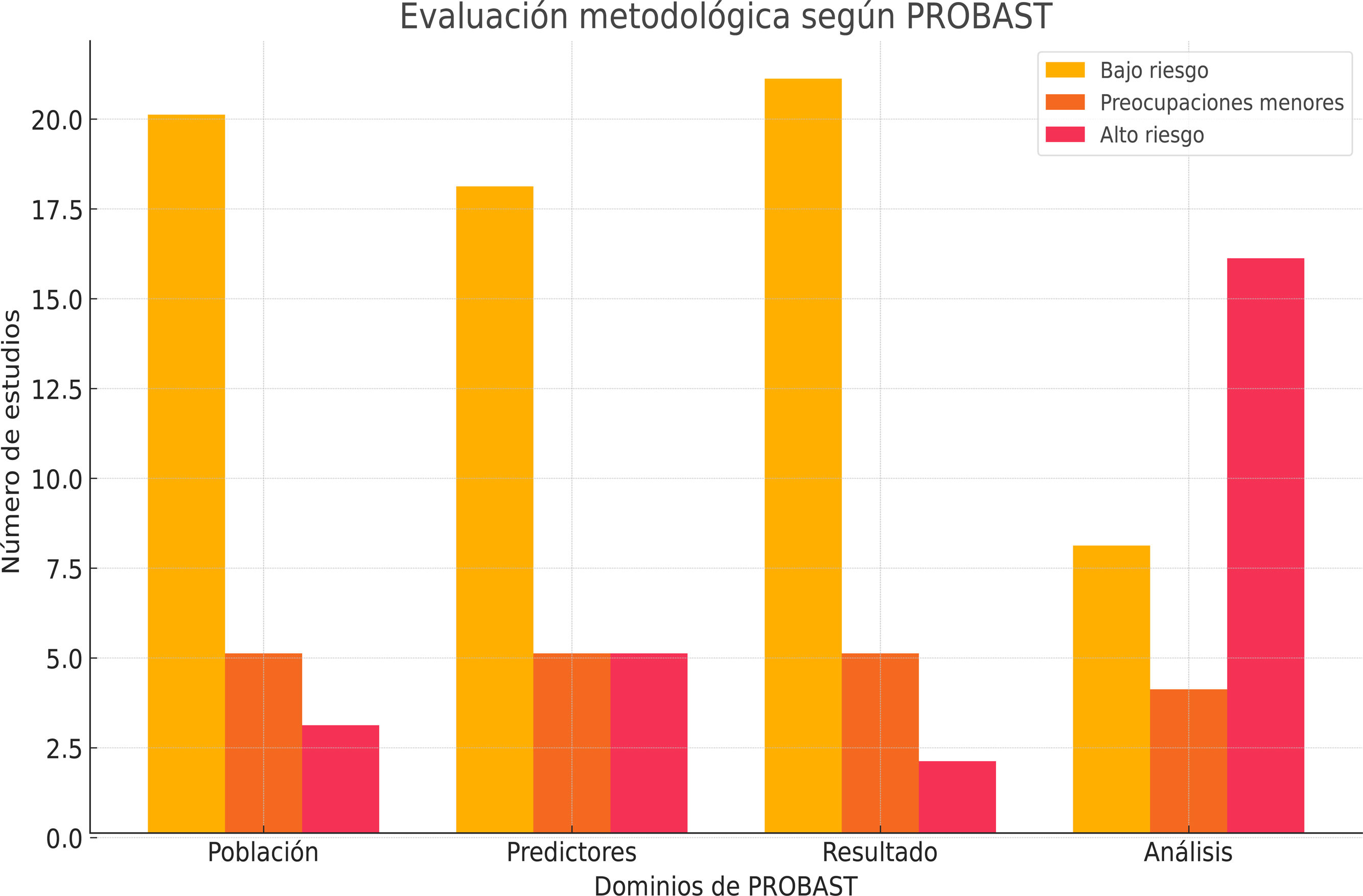
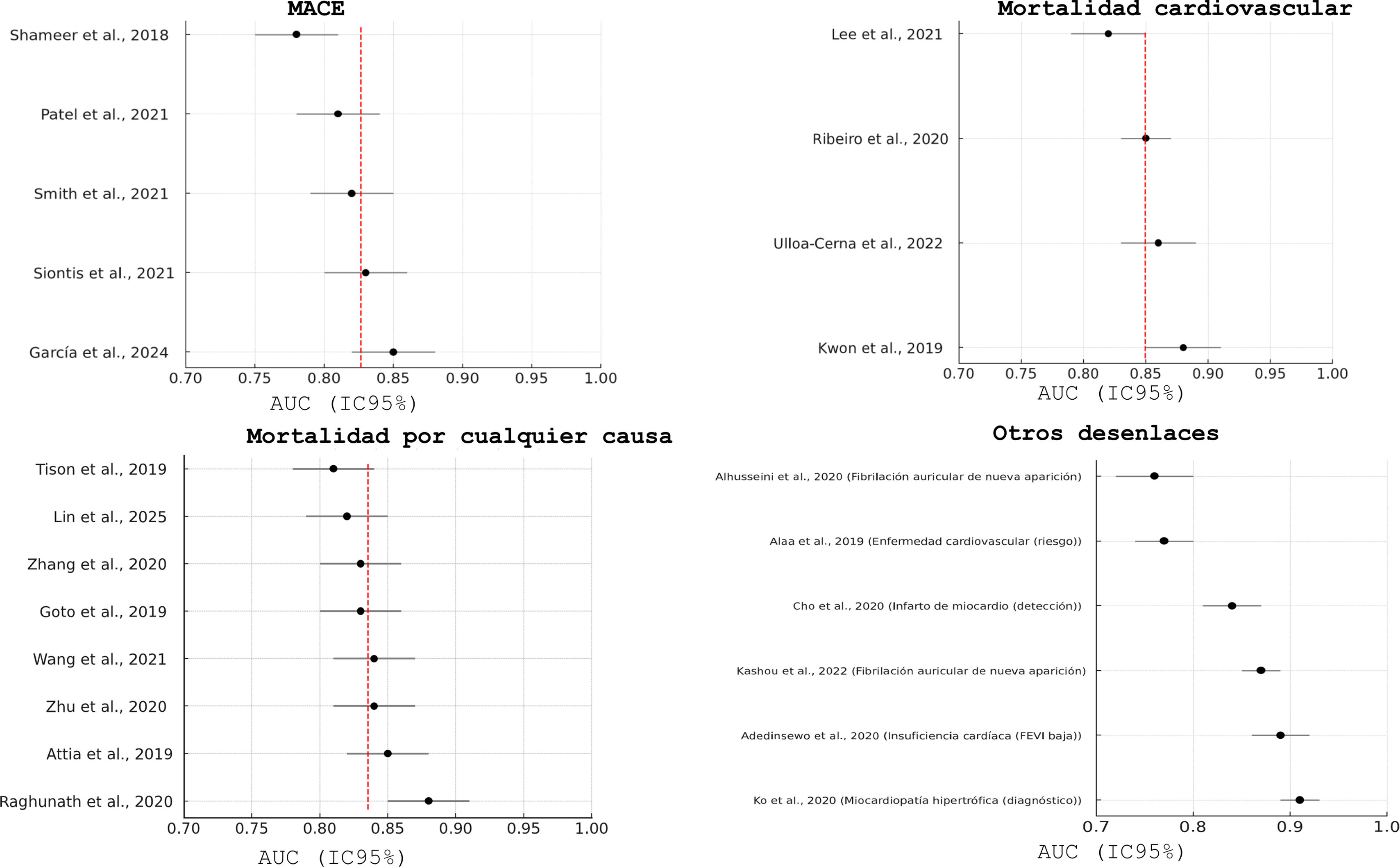
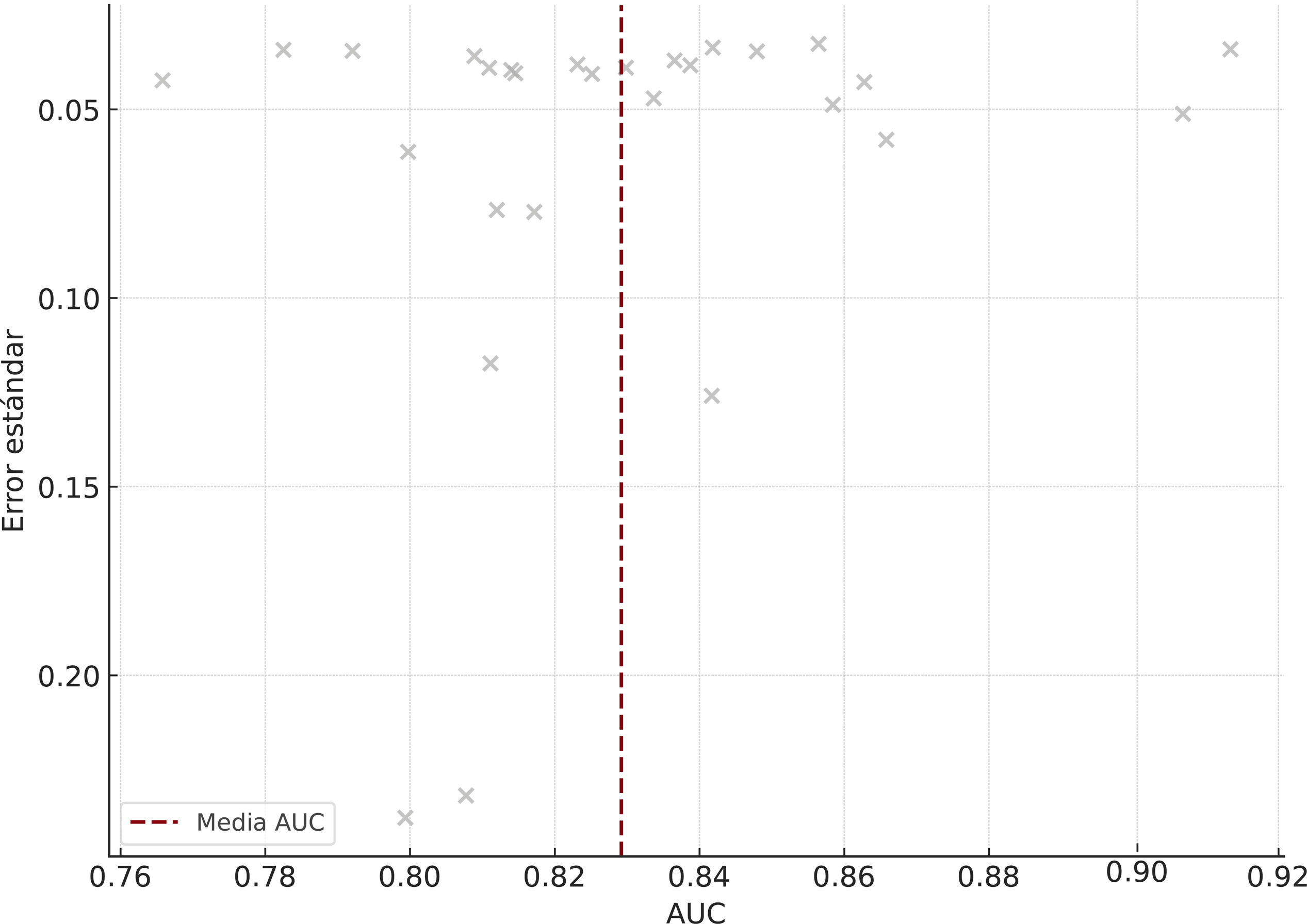
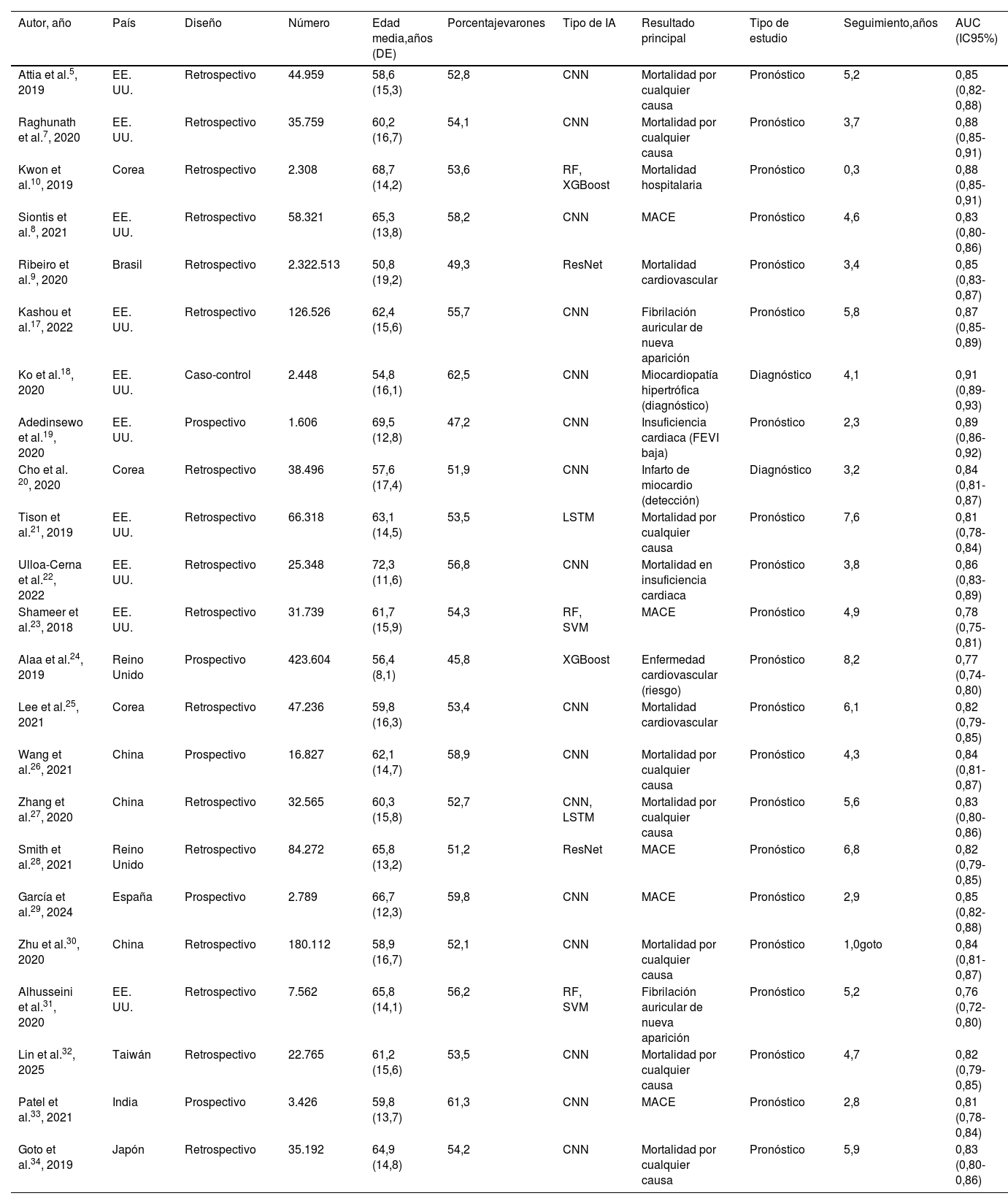
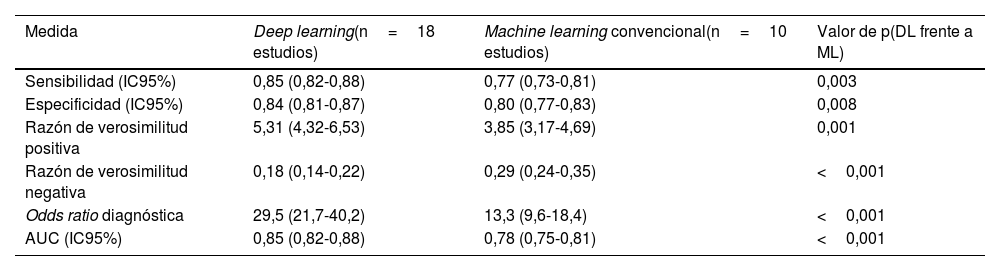
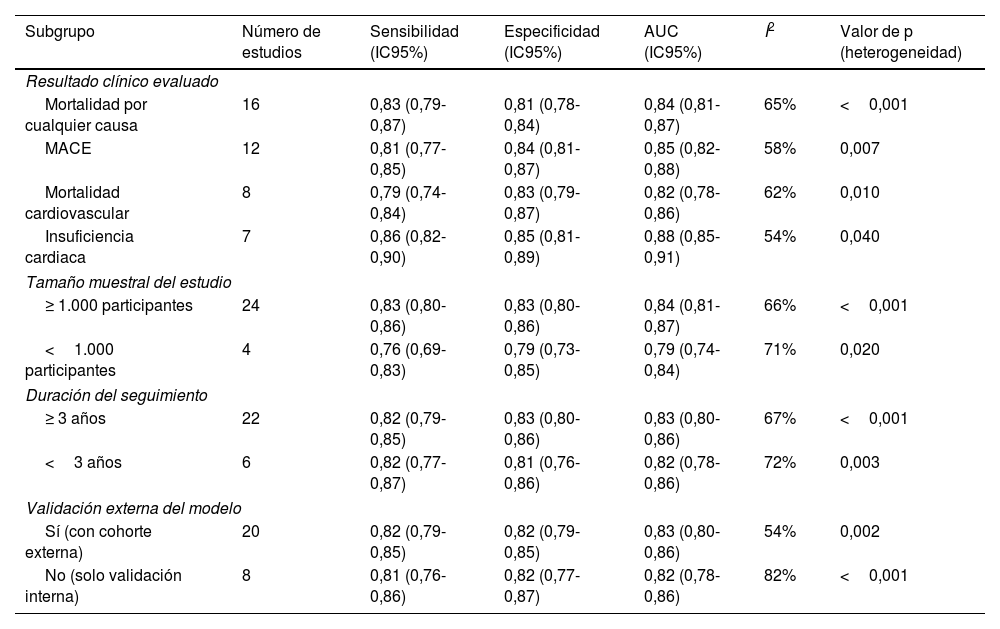
ResultadosSe incluyeron 28 estudios con 3.569.731 pacientes. Los algoritmos de DL mostraron mayor precisión que los de ML (AUC combinada: 0,85 frente a 0,78; p<0,001). Para la predicción de mortalidad y los eventos cardiovasculares adversos mayores, la sensibilidad y la especificidad fueron altas. La heterogeneidad entre los estudios fue moderada-alta (I2=68%, p<0,001).
ConclusionesLos algoritmos de IA aplicados al ECG son efectivos para predecir morbimortalidad cardiovascular, con los modelos de DL demostrando mayor precisión que los de ML. Se requiere validación externa en las poblaciones diversas antes de su implementación clínica generalizada.
Artificial intelligence (AI) applied to electrocardiogram (ECG) analysis has shown promise for predicting cardiovascular morbidity and mortality. This meta-analysis evaluates the diagnostic and prognostic accuracy of deep learning (DL) and machine learning (ML) algorithms in predicting adverse events and cardiovascular mortality.
MethodsA systematic search was conducted in PubMed, Embase, Cochrane, and Web of Science (2010-2024). Studies evaluating AI applied to ECG for predicting morbidity and mortality were included, and diagnostic accuracy measures were calculated through meta-analysis. The protocol was previously registered at PROSPERO (CRD420251017753).
ResultsA total of 28 studies with 3 569 731 patients were included. DL algorithms showed higher accuracy than ML algorithms (combined AUC: 0.85 vs 0.78; P <.001). For predicting mortality and major cardiovascular adverse events, sensitivity and specificity were high. Heterogeneity between studies was moderate to high (I2=68%, P <.001).
ConclusionsAI algorithms applied to ECG are effective for predicting cardiovascular morbidity and mortality, with DL models demonstrating higher accuracy than ML models. External validation in diverse populations is required before widespread clinical implementation.
Artículo
REC: CardioClinics
Use datos de acceso a SEC en el menú Acceder.
Si es socio de la Sociedad Española de Cardiología y no puede acceder con sus claves, escriba a rec@cardioclinics.org.
Use the Society's website login and password here.
If you are member of SEC and you have some problems with your login data, please contact with rec@cardioclinics.org.
Si ya tiene sus datos de acceso, clique aquí.
Si olvidó su clave de acceso puede recuperarla seleccionando la opción "He olvidado mi contraseña".Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora