La miocardiopatía hipertrófica se define por un aumento del grosor de las paredes del ventrículo izquierdo que no se puede atribuir a las condiciones de poscarga1. Es la forma más frecuente de enfermedad cardiaca hereditaria, así como de muerte súbita (MS) en adultos jóvenes. Su penetrancia es incompleta y presenta una gran variabilidad clínica intrafamiliar e interfamiliar. Los parámetros utilizados para la estratificación del riesgo de MS en niños no están tan bien establecidos como en adultos. Existen múltiples genes implicados, siendo los más frecuentes los relacionados con proteínas sarcoméricas2. Habitualmente la herencia es autosómica dominante. Las mutaciones más frecuentes ocurren en el gen de la cadena pesada de la betamiosina cardiaca (MYH7) y en de la proteína C fijadora de la miosina cardiaca (MYBPC3). Las mutaciones en el gen MYBPC3 se han asociado a fenotipos más leves con comienzo sintomático más tardío3. En niños, las miocardiopatías hipertróficas se deben a mutaciones en proteínas sarcoméricas en el 50% de los casos. Se han descrito casos de inicio precoz y grave para pacientes heterocigotos compuestos (2 alelos mutados diferentes en un mismo locus, 1 en cada cromosoma) para MYBPC3, así como para doble heterocigosis (mutación en 2 loci diferentes) de MYBPC3 y otros genes de proteínas sarcoméricas4. Describimos 2 casos pediátricos de la misma familia con heterocigosis compuesta para el gen MYBCP3.
Se trata de un paciente varón de 5 años remitido a cardiología pediátrica por soplo cardiaco. Se encuentra asintomático y sin antecedentes personales de interés. No refiere historia familiar de miocardiopatía. Una hermana del abuelo paterno falleció en su tercera década de vida de forma súbita.
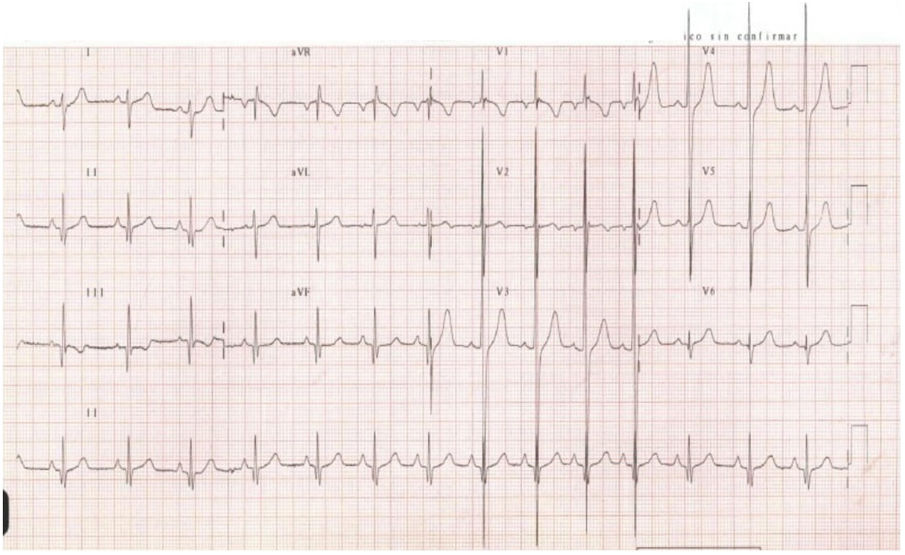
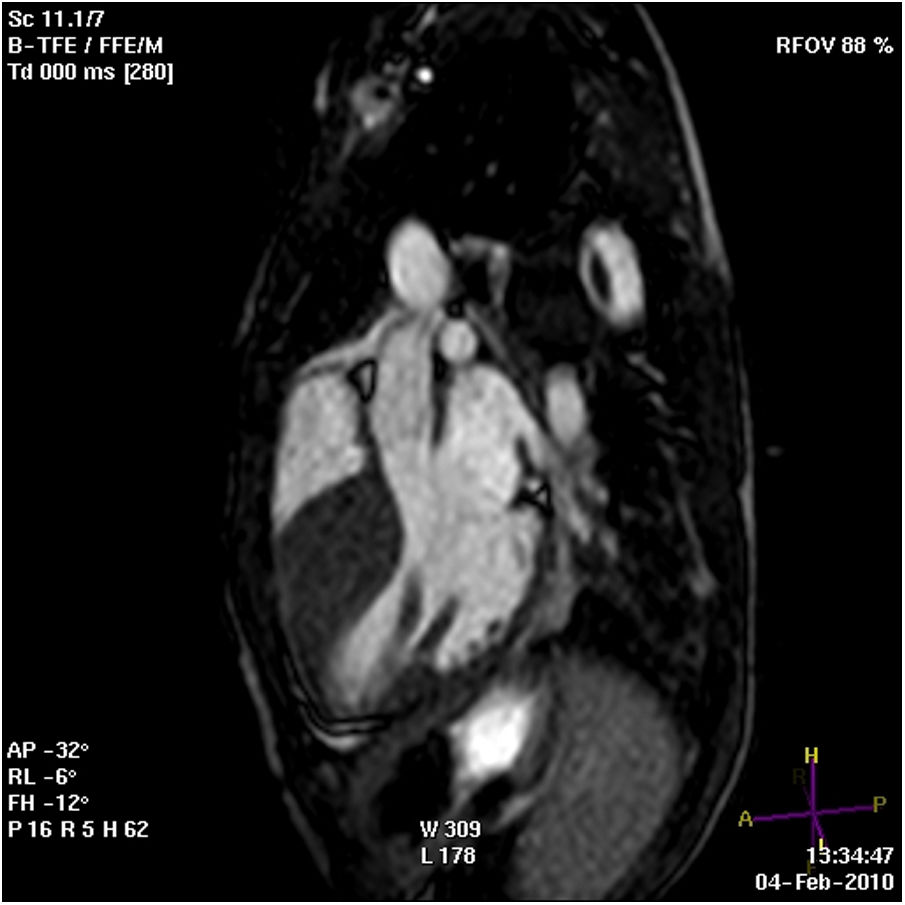
En la exploración física el soplo es de características funcionales, pero llama la atención la presencia de un precordio hiperdinámico. El electrocardiograma (ECG) muestra signos de voltaje de hipertrofia ventricular (fig. 1). En la ecocardiografía se observa una hipertrofia septal basal grave (hasta 34mm de espesor) no obstructiva. La resonancia magnética (fig. 2) confirma una hipertrofia miocárdica, con ausencia de realce tardío. No se detectan arritmias en el estudio Holter-ECG. Se realiza un estudio cardiológico (ECG y ecocardiograma) a los padres y al hermano (12 años) del paciente, sin observarse datos de hipertrofia cardiaca en ninguno de ellos. A los 6 meses el mayor de los hermanos sufre un episodio de pérdida de conciencia jugando un partido de fútbol. El personal que lo atiende observa parada cardiorrespiratoria e inicia maniobras de reanimación cardiopulmonar básica. Se registra fibrilación ventricular que responde a desfibrilación. Se realiza un nuevo estudio ecocardiográfico, en el que se evidencia un ventrículo izquierdo de aspecto levemente hipertrófico, especialmente en el septo anterior (hasta 14-15mm), que podría haber tenido las mismas características en el estudio previo. Con los datos clínicos se indica implantación de desfibrilador intravenoso en los 2 hermanos (prevención secundaria de MS en el hermano mayor; prevención primaria en el hermano menor por el antecedente de MS abortada en el mayor y la presencia de hipertrofia masiva).
Electrocardiograma: ritmo sinusal con signos de hipertrofia ventricular izquierda. La presencia de ondas Q en límite superior de la normalidad en cara inferior con R>20mm en V2 y V3, S>40mm en precordiales de transición y R de escasa amplitud en V5 y V6 sugiere hipertrofia de predominio septal.
Se completó la evaluación con un estudio genético mediante secuenciación masiva de 24 genes relacionados con la miocardiopatía hipertrófica. Se encontró que el hermano pequeño era portador en heterocigosis de las mutaciones c.1828G>C (p.Asp610His) y c.772G>A (p.Glu258Lys) en MYBPC3. La mutación p.Glu258Lys afecta al último nucleótido del exón 6 de MYBPC3, que altera el sitio donador del splicing y, como consecuencia, aparece un codón de parada prematuro, lo que produce una proteína truncada. La mutación p.Asp610His es una mutación missense clasificada como patogénica.
En el estudio familiar se identificaron las mismas mutaciones en el hermano mayor. Ambas variantes vienen heredadas en trans: la madre es portadora de p. Glu258Lys y el padre es portador de p.Asp610His. Se obtuvo el consentimiento informado verbal de los pacientes.
La asociación de 2 o más mutaciones en genes codificantes de proteínas sarcoméricas podría relacionarse con fenotipos clínicos más graves: inicio más precoz, mayor grosor del miocardio y mayor frecuencia de eventos arrítmicos graves. En este caso, ambos hermanos son heterocigotos compuestos para mutaciones en MYBPC3. Sin embargo, no se encontraron alteraciones en los progenitores portadores de una única mutación. El cambio p.Glu258Lys produciría una proteína truncada y, por tanto, puede ser considerado en sí mismo como de peor pronóstico. De hecho, existen casos neonatales graves con fallecimiento precoz producidos por 2 mutaciones truncantes en MYBPC3 que incluyen este cambio5. En estos 2 casos, el comienzo ha sido precoz y grave, con una hipertrofia miocárdica masiva en el paciente de 5 años y una MS abortada en su hermano de 12. Sin embargo, no han sido iguales. La presencia de proteína, secundaria a la mutación missense aunque con una menor función, puede explicar un fenotipo intermedio entre el inicio neonatal y el inicio en la edad adulta característico de los heterocigotos simples. Se puede proponer también la presencia de otros genes con efecto modulador o mecanismos epigenéticos que puedan estar interactuando y expliquen el fenotipo distinto en nuestros pacientes a pesar de ser portadores de las mismas mutaciones en MYBPC3.
Como conclusiones cabe destacar la importancia de la realización del cribado genético familiar ante el hallazgo de mutaciones en un caso índice con independencia de la aparición de otros signos de miocardiopatía en la familia. El hallazgo de una heterocigosis compuesta para mutaciones patogénicas en pacientes pediátricos con miocardiopatía hipertrófica debería tenerse en cuenta en la toma de decisiones como factor de peor pronóstico.
FinanciaciónNo se ha recibido financiación para la realización del estudio.
Conflicto de interesesNo existen conflictos de intereses por parte de ninguno de los autores.