Las distintas definiciones o clasificaciones y el análisis de series tanto angiográficas como necrópsicas y, en los últimos años, ecocardiográficas hacen que la incidencia publicada de las anomalías coronarias congénitas oscile entre el 0,1 y el 8,4%, por lo que es difícil conocer con exactitud la magnitud del problema que representan1. Su importancia clínica radica en la posibilidad de producir isquemia miocárdica y taquiarritmias ventriculares potencialmente mortales.
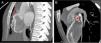
Se presenta el caso de una niña de 11 años con desarrollo pondoestatural normal y asintomática desde el punto de vista cardiovascular, remitida desde su pediatra de zona por auscultación de soplo cardiaco de características funcionales y electrocardiograma patológico con ondas Q en aVL, infradesnivelación del segmento ST en V3-V6 y T negativa en aVL, I y precordiales. Se realizó un ecocardiograma, en el que destaca la salida de la coronaria derecha dilatada en su origen y el origen de la coronaria izquierda en tronco pulmonar con flujo diastólico en tronco pulmonar (fig. 1A,B). El ventrículo izquierdo no estaba dilatado y la función ventricular era normal; se observa un gran desarrollo en las ramas septales y colateral que origina un aspecto del septo interventricular de «corazón en llamas» (fig. 1C). En la tomografía computarizada coronaria se observa el origen anómalo de la coronaria izquierda desde la pared posterior del tronco de la arteria pulmonar con dilatación y tortuosidad de toda la circulación coronaria (fig. 2B), con un calibre de 4-6mm de la coronaria derecha en su origen, y desarrollo de gruesas ramas septales (fig. 2A). Se inició tratamiento con bisoprolol a dosis bajas y se propuso para cirugía de reparación. Se realizó una translocación de coronaria izquierda a aorta y cierre del defecto de la arteria pulmonar con parche de pericardio bovino, con buen resultado y sin complicaciones tras un seguimiento de un año.
A) Salida de la coronaria derecha dilatada en su origen desde el seno de Valsalva derecho (flecha). B) Origen de la coronaria izquierda (flecha) en el tronco pulmonar con flujo diastólico. C) Eje corto del ventrículo izquierdo con gran desarrollo de ramas septales y colateral que origina un aspecto del septo interventricular de «corazón en llamas».
El origen anómalo de la arteria coronaria izquierda del tronco de la arteria pulmonar (conocido como ALCAPA, del inglés anomalous origin of left coronary artery from pulmonary artery) tiene una incidencia de 1/300.000 recién nacidos vivos y constituye un 0,24-0,46% de las cardiopatías congénitas. La gran mayoría muere antes del primer año de vida por insuficiencia cardiaca grave si no reciben el tratamiento adecuado2. Aunque suele aparecer de forma aislada, puede asociarse a otros defectos cardiovasculares, como la tetralogía de Fallot, defectos de tabique interventricular y coartación de aorta3.
Existen 2 formas anatomoclínicas en función del desarrollo de las colaterales intercoronarias4.
La forma precoz (infantil), con escaso desarrollo de colaterales y con clínica precoz (en los 6 primeros meses de vida) con crisis de disnea, llanto, diaforesis, inquietud, muchas veces precipitadas por esfuerzos (llanto, lactancia). En las primeras semanas de vida, al existir una elevada presión en la arteria pulmonar, se conserva un adecuado flujo anterógrado a través de la arteria coronaria izquierda. Los síntomas de isquemia aparecen posteriormente, al presentarse el descenso normal de las resistencias vasculares pulmonares, cuando aún no se ha desarrollado la circulación coronaria colateral. Otras manifestaciones incluyen insuficiencia mitral secundaria a la isquemia de los músculos papilares, insuficiencia cardiaca congestiva, arritmias ventriculares y muerte súbita.
La segunda forma es la tardía o adulta. Con el tiempo, en niños mayores y adultos se forman arterias colaterales y anastomosis intercoronarias de la coronaria derecha a la izquierda, que aportan flujo sanguíneo suplementario al miocardio, pero conforme las demandas de oxígeno del miocardio izquierdo aumentan, se produce una isquemia miocárdica que provoca fallo cardiaco e incompetencia mitral secundaria, bien por anillo mitral dilatado o por infarto del músculo papilar mitral. Además, como la coronaria izquierda está conectada con la pulmonar (de menor presión) va apareciendo un robo coronario con un shunt izquierda-derecha. Existe un amplio espectro de manifestaciones clínicas, desde un curso asintomático hasta la descompensación de la circulación colateral que revele una isquemia crónica subclínica previa, pudiendo producir cardiopatía isquémica y en ocasiones insuficiencia mitral secundaria o arritmias ventriculares con riesgo de muerte súbita.
En la mayoría de los casos, en el electrocardiograma se observa un patrón característico: onda Q en las derivaciones I, y avL y alteraciones de la repolarización difusa de V4 a V65. El diagnóstico puede realizarse por ecocardiografía, aunque la técnica de imagen de elección es la tomografía computarizada multicorte. La principal característica morfológica es la detección del origen anómalo y del shunt izquierda-derecha con flujo retrógado desde la coronaria izquierda en la arteria pulmonar. En la forma tardía es característica la dilatación y elongación de la coronaria derecha y las arterias colaterales intercoronarias. La resonancia magnética nuclear puede aportar una valoración funcional de anormalidades en la contractilidad regional, insuficiencia mitral secundaria y áreas de infarto en las secuencias de realce tardío de gadolinio6.
El ecocardiograma es de gran utilidad en la orientación diagnóstica; los 3 datos de alarma que deben hacer sospechar esta patología son: la dilatación de la salida de la coronaria derecha, la dilatación de las colaterales coronarias en el septo interventricuar (corazón en llamas) o superficie cardiaca, y la visualización del origen de la coronaria izquierda en la parte posterior de la arteria pulmonar. En ocasiones puede manifestarse como miocardiopatía dilatada con disfunción sistólica ventricular izquierda.
El tratamiento quirúrgico está indicado al diagnóstico en todos los casos. La reparación óptima del origen anómalo de la arteria coronaria izquierda del tronco pulmonar se basa en la creación de un doble sistema coronario. Entre las técnicas más utilizadas, especialmente en niños, está la creación de un túnel intrapulmonar que comunica el ostium de la coronaria anómala con la aorta (reparación de Takeuchi). Este procedimiento genera baja mortalidad, aunque se ha relacionado con varias complicaciones, como son la obstrucción y fugas del túnel, estenosis supravalvular secundaria a la operación y deterioro de la válvula pulmonar. La reimplantación directa de la coronaria anómala a la aorta por transferencia desde la pulmonar es la forma más popular y anatómica de corregir el ALCAPA, por lo que se considera una excelente opción que ocasiona baja mortalidad operatoria (0-23%). Sin embargo, tiene el inconveniente de que no puede realizarse en todas las variantes anatómicas, ya que uno de los requisitos es que el ostium de la coronaria anómala se encuentre cerca de la pared aórtica con el fin de evitar torsión y tensión en la anastomosis y sangrado por desgarramiento del tejido.