La insuficiencia cardiaca (IC) y la fibrilación auricular (FA) son patologías altamente prevalentes, relacionadas con un aumento de la morbimortalidad y de reingresos hospitalarios. Ambas entidades se encuentran estrechamente interrelacionadas, de forma que la IC constituye un factor de riesgo para desarrollar FA, y viceversa, y coexisten hasta en el 30% de los pacientes. Las opciones terapéuticas de la FA en pacientes con IC son diversas. El tratamiento farmacológico es el tratamiento más aceptado; sin embargo, en muchas ocasiones no logra un control óptimo y su impacto pronóstico es limitado. En recientes estudios aleatorizados la ablación de la FA ha mostrado ser superior al tratamiento farmacológico en términos de carga arrítmica y de mortalidad. La evidencia que apoya la ablación como estrategia para el tratamiento de la FA en pacientes con IC es objeto de esta revisión.
Heart failure (HF) and atrial fibrillation (AF) are highly prevalent pathologies, associated with an increased morbidity, mortality and hospital readmissions. Both pathologies are closely interrelated, so that HF constitutes a risk factor for incident AF, and vice versa, and they coexist in up to 30% of patients. Treatment options for AF in HF patients vary widely. Although medical treatment has been the most accepted approach, sometimes it fails to reach appropriate management and has limited prognostic impact. In recent randomized studies, AF ablation has shown to be superior to medical treatment with improved AF burden and mortality. In this article, the evidence supporting ablation as a valid strategy to treat AF in patients with HF is reviewed.
La insuficiencia cardiaca (IC) es una de las enfermedades con mayor prevalencia e impacto a nivel mundial, estimándose que afecta a 26 millones de personas en todo el mundo1. Las cifras de prevalencia global oscilan entre el 2 y el 5%2, aumentan de forma notable en los grupos de mayor edad (6,2% en el grupo de 60-79años y 14% en el grupo de mayores de 80años3), y se espera que continúen aumentando debido a la mayor esperanza de vida y envejecimiento de la población. Además, es la primera causa de hospitalización en mayores de 65años, representando el 3% del total de ingresos hospitalarios y el 2,5% del gasto de la asistencia sanitaria2.
La relación entre IC y fibrilación auricular (FA) ha sido ampliamente estudiada. Ambas entidades comparten factores de riesgo, así como aspectos fisiopatológicos, y la edad es el mayor factor predisponente para ambas. Actualmente la prevalencia de la FA en España es del 4,4%, y se espera que se duplique en el año 20604 debido al incremento de la expectativa de vida de la población. Se prevé que un tercio de los pacientes con FA acabarán desarrollando IC y que, a su vez, la mitad de los pacientes con IC presentarán FA en el seguimiento, según un análisis del estudio Framingham5. Actualmente se calcula que la prevalencia de FA en pacientes con IC se encuentra entre el 31 y el 52%6,7.
Impacto pronóstico de la FA en pacientes con ICLa relación entre estas 2 entidades no es solo relevante por su alta prevalencia, sino también por su importancia pronóstica. Datos derivados de registros poblacionales y grandes ensayos clínicos permiten concluir de forma sólida que la FA es un factor independiente de mayor mortalidad en la IC. Un metaanálisis que incluyó 16 estudios y más de 50.000 pacientes reveló que la presencia de FA se asocia con un incremento del 40% en la mortalidad total en pacientes con IC tanto con fracción de eyección reducida (ICFEr) como con fracción de eyección conservada8. Sin embargo, el empeoramiento pronóstico conferido por la FA podría ser mayor en los pacientes con ICFEr5. Además, la gravedad de la IC facilita la aparición de la FA. Los pacientes con IC clasificados como New York Heart Association (NYHA) gradoI muestran una prevalencia de FA <5%, mientras que los pacientes con síntomas de NYHAIV tienen una prevalencia de FA de hasta el 50%9.
Los mecanismos principales por los cuales la FA afecta al pronóstico de la IC incluyen el control deficiente de la frecuencia cardiaca, la irregularidad de la respuesta ventricular10, la pérdida de actividad sistólica auricular y el aumento del riesgo de eventos tromboembólicos de forma inversamente proporcional a la fracción de eyección11.
Limitaciones del tratamiento farmacológicoEl tratamiento farmacológico ha sido clásicamente el pilar en el abordaje de la FA en pacientes con IC. Pese a ello, la estrategia farmacológica presenta limitaciones importantes, especialmente en el caso de la IC subyacente. Por un lado, algunos de los fármacos utilizados para el control de la frecuencia (bloqueadores de los canales de calcio no hidropiridínicos)12 y fármacos antiarrítmicos de claseIC12 (flecainida, propafenona) o claseIII (dronedarona)13 están contraindicados en los pacientes con ICFEr debido a un aumento en la mortalidad en este subgrupo de pacientes. Asimismo, existe evidencia de que el tratamiento betabloqueante en pacientes con IC no es tan efectivo en presencia de FA como en ritmo sinusal14. Kotecha et al.14 llevaron a cabo un metaanálisis que analizó 18.254 pacientes provenientes de 10 ensayos clínicos aleatorizados que comparaban tratamiento betabloqueante con placebo en pacientes con IC. Los resultados obtenidos mostraron que la terapia betabloqueante condujo a una reducción significativa de la mortalidad por todas las causas en pacientes con IC y ritmo sinusal (hazard ratio [HR]=0,73; p<0,001), pero no en aquellos con FA (HR=0,97; p=0,73), de manera consistente en todos los subgrupos de pacientes con IC y FA. Además, la aparición de efectos indeseados derivados de la terapia farmacológica motiva su abandono en muchas ocasiones.
Control del ritmo frente a control de la frecuenciaAunque se ha demostrado que la presencia de FA en los pacientes con IC se asocia con un peor pronóstico, no queda claro si el mantenimiento del ritmo sinusal bajo tratamiento farmacológico lo modifica. Estudios clásicos como el AFFIRM y el RACE no demostraron diferencias en mortalidad cuando se compararon las estrategias de control farmacológico del ritmo con el control de la frecuencia en pacientes con FA y algún factor de riesgo15,16. En estos estudios, la prevalencia de pacientes con IC fue del 26 y del 50%, respectivamente, sin demostrarse tampoco beneficio en este subgrupo.
El principal estudio que evaluó específicamente la población de pacientes con FA e IC fue el AF-CHF17. Este ensayo multicéntrico y aleatorizado comparó estrategia de control del ritmo (amiodarona en su mayoría) frente a control de frecuencia (bloqueadores beta o digoxina) en pacientes con ICFEr (fracción de eyección del ventrículo izquierdo [FEVI] <35%) sintomática (NYHA ≥II). No hubo diferencias significativas en el objetivo primario de mortalidad cardiovascular (27 en el grupo de control del ritmo frente al 25% en el grupo de control de frecuencia; p=0,59) ni en mortalidad por cualquier causa (32 frente al 33%; p=0,68). Cabe destacar que los pacientes del grupo de control del ritmo presentaron mayor tasa de ingresos hospitalarios por cualquier causa en el primer año (46 frente al 39%; p=0,001).
En base a los resultados de este estudio, las estrategias de control del ritmo y control de la frecuencia en pacientes con FA e IC han sido consideradas equiparables en términos pronósticos. Por ello, las guías de práctica clínica vigentes recomiendan como primera opción la estrategia de control de la frecuencia y optar por el control del ritmo cuando no se consigue dicho control o si la FA provoca síntomas11.
Sin embargo, un análisis post hoc del estudio AFFIRM mostró que el mantenimiento del ritmo sinusal se asociaba a una menor mortalidad en comparación con los pacientes que permanecían en FA18, siendo el uso de fármacos antiarrítmicos, especialmente la amiodarona, lo que comporta un exceso de mortalidad18,19. De forma conceptual, el mantenimiento del ritmo sinusal aporta beneficios evidentes a nivel hemodinámico, como la sincronía auriculoventricular, la regularidad del ciclo cardiaco y los beneficios de la función sistólica y reservorio auricular20. Por este motivo, se ha hipotetizado que el control no farmacológico del ritmo en pacientes con IC podría aportar beneficios en términos de mortalidad y hospitalización, dado que se evitaría el efecto potencialmente nocivo del tratamiento antiarrítmico a largo plazo.
Ablación de la FALa ablación de venas pulmonares es la técnica de elección para el tratamiento no farmacológico de la FA. El fundamento de esta técnica yace en la presencia de desencadenantes (triggers) a nivel de las inserciones miocárdicas de las venas pulmonares21 (independientemente del tipo de FA), por lo que el aislamiento eléctrico de estas se ha consolidado como la piedra angular de la ablación con catéter. Actualmente la ablación de la FA se encuentra recogida en las guías internacionales de práctica clínica como tratamiento de primera elección en pacientes con FA sintomática con refractariedad o intolerancia al menos a un fármaco antiarrítmico22,23. Las guías europeas recomiendan su aplicación en pacientes con FA paroxística con clase de recomendaciónI y nivel de evidenciaA y en FA persistente con claseIIa y nivel de evidenciaA22. La eficacia de esta técnica se ha valorado en múltiples estudios24-29 que han demostrado una mayor probabilidad de mantener el ritmo sinusal a largo plazo que con fármacos antiarrítmicos en la población general, tanto en la FA paroxística como en la FA persistente. El papel de la ablación en casos de FA persistente de larga evolución es más controvertido, ya que su eficacia es más modesta30.
Ablación de la FA en IC con FEVI reducidaEn la última década se han publicado múltiples estudios sobre el papel de la ablación de la FA en población con ICFEr en los que se han podido observar los beneficios potenciales en términos de mejoría de la función ventricular, la capacidad de ejercicio y la calidad de vida (tabla 1).
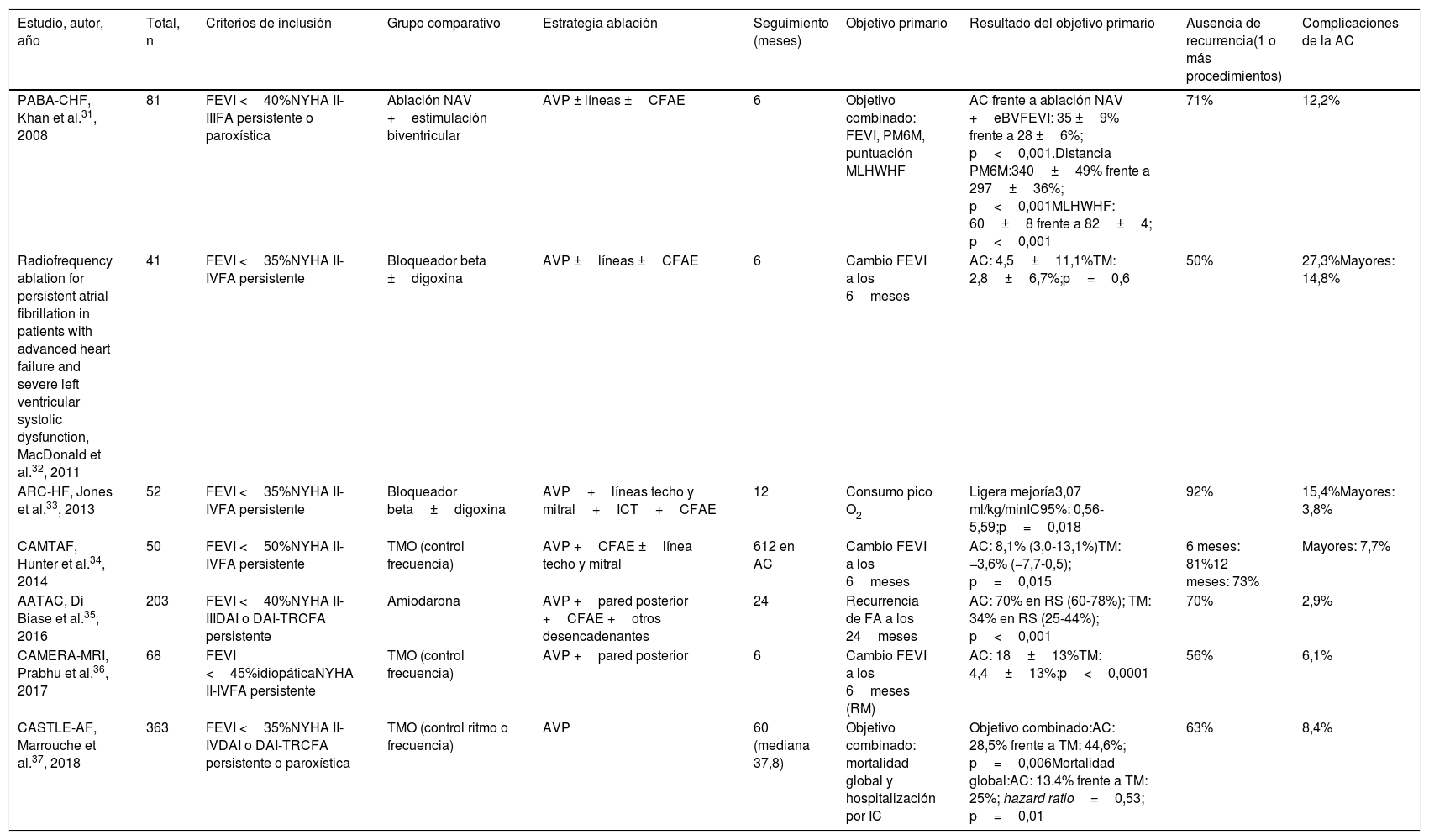
Ensayos clínicos que evalúan la ablación con catéter frente al tratamiento médico en pacientes con insuficiencia cardiaca
| Estudio, autor, año | Total, n | Criterios de inclusión | Grupo comparativo | Estrategia ablación | Seguimiento (meses) | Objetivo primario | Resultado del objetivo primario | Ausencia de recurrencia(1 o más procedimientos) | Complicaciones de la AC |
|---|---|---|---|---|---|---|---|---|---|
| PABA-CHF, Khan et al.31, 2008 | 81 | FEVI <40%NYHA II-IIIFA persistente o paroxística | Ablación NAV +estimulación biventricular | AVP ± líneas ±CFAE | 6 | Objetivo combinado: FEVI, PM6M, puntuación MLHWHF | AC frente a ablación NAV +eBVFEVI: 35 ±9% frente a 28 ±6%; p<0,001.Distancia PM6M:340±49% frente a 297±36%; p<0,001MLHWHF: 60±8 frente a 82±4; p<0,001 | 71% | 12,2% |
| Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction, MacDonald et al.32, 2011 | 41 | FEVI <35%NYHA II-IVFA persistente | Bloqueador beta ±digoxina | AVP ±líneas ±CFAE | 6 | Cambio FEVI a los 6meses | AC: 4,5±11,1%TM: 2,8±6,7%;p=0,6 | 50% | 27,3%Mayores: 14,8% |
| ARC-HF, Jones et al.33, 2013 | 52 | FEVI <35%NYHA II-IVFA persistente | Bloqueador beta±digoxina | AVP+líneas techo y mitral+ICT+CFAE | 12 | Consumo pico O2 | Ligera mejoría3,07 ml/kg/minIC95%: 0,56-5,59;p=0,018 | 92% | 15,4%Mayores: 3,8% |
| CAMTAF, Hunter et al.34, 2014 | 50 | FEVI <50%NYHA II-IVFA persistente | TMO (control frecuencia) | AVP +CFAE ±línea techo y mitral | 612 en AC | Cambio FEVI a los 6meses | AC: 8,1% (3,0-13,1%)TM: −3,6% (−7,7-0,5); p=0,015 | 6 meses: 81%12 meses: 73% | Mayores: 7,7% |
| AATAC, Di Biase et al.35, 2016 | 203 | FEVI <40%NYHA II-IIIDAI o DAI-TRCFA persistente | Amiodarona | AVP +pared posterior +CFAE +otros desencadenantes | 24 | Recurrencia de FA a los 24meses | AC: 70% en RS (60-78%); TM: 34% en RS (25-44%); p<0,001 | 70% | 2,9% |
| CAMERA-MRI, Prabhu et al.36, 2017 | 68 | FEVI <45%idiopáticaNYHA II-IVFA persistente | TMO (control frecuencia) | AVP +pared posterior | 6 | Cambio FEVI a los 6meses (RM) | AC: 18±13%TM: 4,4±13%;p<0,0001 | 56% | 6,1% |
| CASTLE-AF, Marrouche et al.37, 2018 | 363 | FEVI <35%NYHA II-IVDAI o DAI-TRCFA persistente o paroxística | TMO (control ritmo o frecuencia) | AVP | 60 (mediana 37,8) | Objetivo combinado: mortalidad global y hospitalización por IC | Objetivo combinado:AC: 28,5% frente a TM: 44,6%; p=0,006Mortalidad global:AC: 13.4% frente a TM: 25%; hazard ratio=0,53; p=0,01 | 63% | 8,4% |
AC: ablación con catéter; AVP: ablación de las venas pulmonares; CFAE: complex fractioned atrial electrogram; DAI: desfibrilador automático implantable; eBV: estimulación biventricular; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; ICT: istmo cavotricuspídeo; IC95%: intervalo de confianza del 95%; MLHWHF: cuestionario Minnesota Living with Heart Failure; NAV: nodo auriculoventricular; NYHA: clase funcional de la New York Heart Association; PM6M: prueba de marcha de 6minutos; RM: resonancia magnética; RS: ritmo sinusal; TM: tratamiento médico; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca.
Los estudios PABA-CHF31, ARC-HF33, CAMTAF34 y CAMERA-MRI36 mostraron un incremento significativo de la FEVI tras la ablación de la FA, en comparación con el tratamiento médico de control de frecuencia, (o ablación del nodo auriculoventricular junto con estimulación biventricular en el estudio PABA-CHF). Este último estudio encontró además mejoría en la capacidad de ejercicio y en la calidad de vida. En el estudio ARC-HF se observó mejoría en el consumo pico de oxígeno, demostrando una mejor capacidad de ejercicio tras la ablación. Solo uno de los ensayos diseñados para evaluar el beneficio de la ablación de la FA en pacientes con ICFEr mostró resultados neutros en términos de mejoría de la FEVI, capacidad funcional o niveles de péptido natriurético33. Sin embargo, estos estudios evaluaron únicamente variables ecográficas y funcionales a corto plazo (6-12meses).
Más recientemente, el ensayo AATAC35 aleatorizó a 203 pacientes con FA y ICFEr (clase funcional NYHAII-III) a ablación de la FA o control farmacológico del ritmo (principalmente amiodarona). Tras un seguimiento de 24meses se demostró la superioridad de la ablación para el mantenimiento del ritmo sinusal en comparación con fármacos antiarrítmicos (objetivo primario). Además, el estudio AATAC demostró por primera vez el potencial beneficio de la ablación de la FA en términos de mortalidad y hospitalización por cualquier causa (objetivos secundarios), con una reducción relativa del 56 y del 45%, respectivamente.
Sin embargo, a pesar de los resultados positivos de la mayoría de los estudios y de la tasa relativamente baja de complicaciones en el grupo de ablación, el reducido tamaño muestral, el corto periodo de seguimiento, así como la ausencia de objetivos primarios clínicos duros, han dificultado la incorporación de la ablación de la FA al arsenal terapéutico en pacientes con ICFEr.
Estudio CASTLE-AFEl recientemente publicado CASTLE-AF37 es el mayor estudio hasta la fecha que ha evaluado el papel de la ablación de la FA en población de ICFEr. Además, es el primer ensayo clínico de estas características que ha utilizado variables clínicas duras para definir su objetivo primario (combinado de muerte por cualquier causa e ingresos hospitalarios por empeoramiento de la IC). El estudio incluyó 363 pacientes con IC y diagnóstico de FA sintomática paroxística o persistente que no hubieran presentado respuesta al tratamiento antiarrítmico, hubieran presentado intolerancia a fármacos antiarrítmicos o que no estuvieran dispuestos a recibir dicho tratamiento. Estos fueron aleatorizados 1:1 a ablación con catéter (179 pacientes, a los cuales se debía realizar aislamiento de venas pulmonares más sustratos adicionales a discreción de cada operador) o a tratamiento médico farmacológico (184 pacientes), incluyendo control del ritmo (30%) o control de frecuencia (70%). Todos los pacientes presentaban IC con FEVI reducida (≤35%) sintomática (NYHAII-IV) y debían ser portadores de desfibrilador automático implantable unicameral, bicameral o con terapia de resincronización para una exhaustiva monitorización del ritmo cardiaco en el seguimiento. La mayor parte de pacientes presentaba FA persistente (70%), clase funcional NYHAII (60%) y dilatación auricular grave (48-49mm), con una FEVI media del 32%. Una amplia mayoría de la población del estudio estaba bajo tratamiento médico óptimo para la IC de acuerdo con las guías vigentes en el periodo de inclusión (∽90% de los pacientes recibían bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina y diuréticos, incluida la espironolactona cuando estaba indicado).
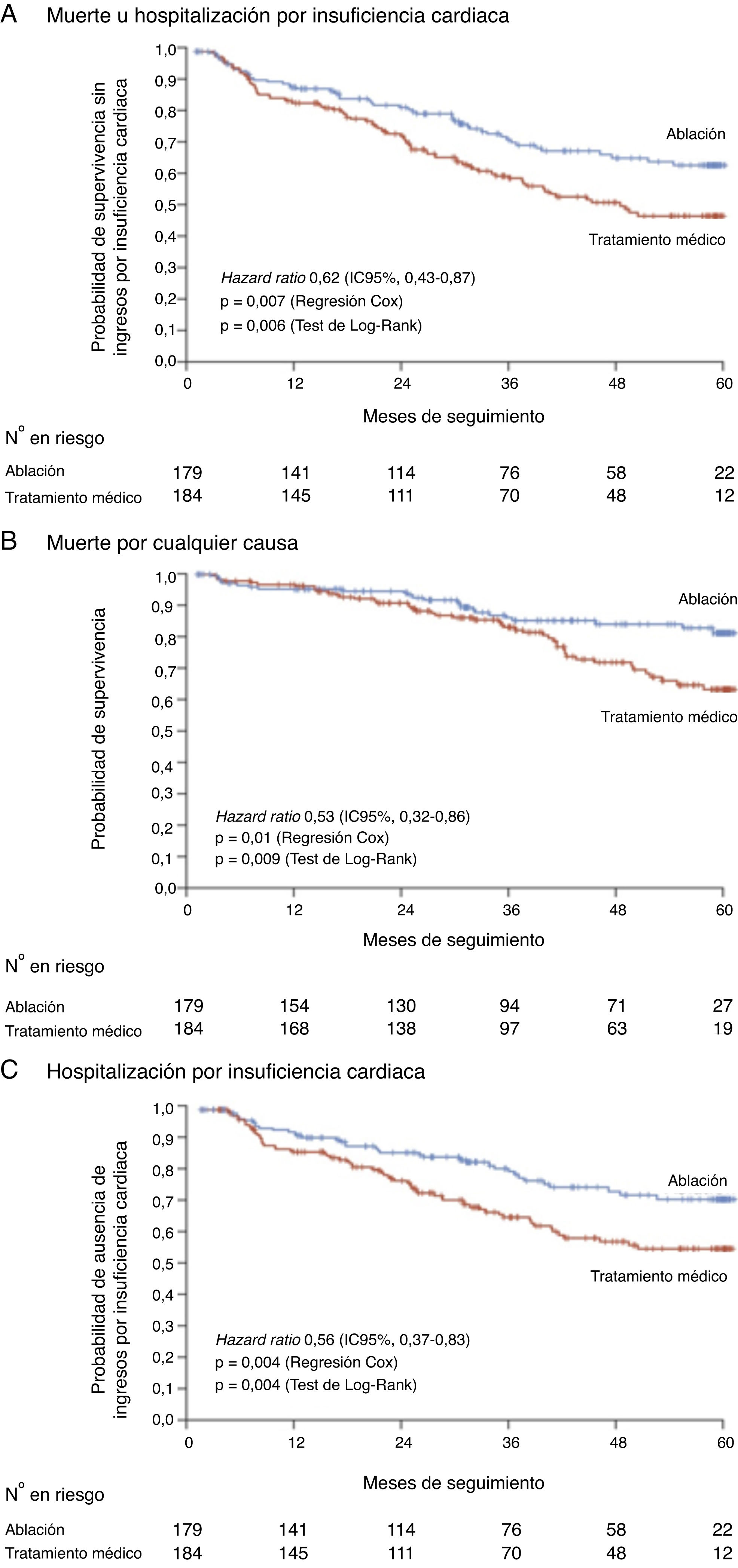
Tras un seguimiento medio de 37,8meses se observó una reducción del objetivo primario en el grupo de ablación respecto al grupo de tratamiento médico (28,5 frente al 44,6%; p=0,006; HR=0,62; intervalo de confianza del 95%, 0,43-0,87; p=0,007) (fig. 1). En los análisis secundarios el tratamiento mediante ablación también demostró una menor mortalidad por todas las causas (13,4 frente al 25%; p=0,01), así como una menor mortalidad de causa cardiovascular (11,2 frente al 22,3%; p=0,009), una menor tasa de ingresos por IC (20,7 frente al 35,9%; p=0,004) y una menor tasa de ingresos de causa cardiovascular (35,8 frente al 48,4%; p=0,04). El incremento absoluto medio de la FEVI a los 60meses de seguimiento fue superior en el grupo ablación (8 frente al 0,2% en el grupo de tratamiento médico; p=0,005).
Efecto de la ablación de la fibrilación auricular (FA) en pacientes con insuficiencia cardiaca (IC), estudio CASTLE-AF. La ablación de la FA se asoció a una reducción del objetivo primario (A: combinado de muerte por cualquier causa y hospitalizaciones por IC) y de los objetivos secundarios (B: muerte por cualquier causa y C: hospitalización por IC), respecto al grupo de tratamiento farmacológico. Adaptada con permiso de Marrouche et al.37.
En el análisis de subgrupos demostró que la reducción del objetivo primario se produjo tanto en los pacientes con FA paroxística como con FA persistente. Por el contrario, cuando se analizó el subgrupo con FEVI <25%, la ablación con catéter no demostró aportar beneficio respecto al tratamiento médico.
En comparación con el grupo control, los pacientes sometidos a ablación de la FA (media de 1,3 procedimientos/paciente) presentaron una menor tasa de recurrencia arrítmica a los 60meses de seguimiento (37 frente al 78% en el grupo control), así como una menor carga arrítmica evaluada por los dispositivos implantables (reducción media del 26 frente al 0% en el grupo control).
Si bien los resultados del CASTLE-AF son prometedores, deben interpretarse con cautela. El estudio presenta ciertas limitaciones que deben ser consideradas. Se trata de un estudio sin enmascaramiento, lo que puede influir en las decisiones terapéuticas en el seguimiento, como la admisión hospitalaria por IC. Los pacientes debían ser portadores de un dispositivo automático implantable o terapia de resincronización de un único fabricante (Biotronik, Berlín, Alemania), condicionando que se tratara de pacientes muy seleccionados (de los 3.013 pacientes que fueron valorados para cribado, se incluyó únicamente a 363, principalmente por ser portadores de dispositivos de otros fabricantes). Otra de las limitaciones es que no se ha publicado la calidad del control de la frecuencia cardiaca en el grupo de tratamiento médico. A destacar que los beneficios de mortalidad de la ablación aparecieron relativamente tarde en el ensayo (a partir de los 36meses), cuando ya solo aproximadamente el 50% de los pacientes iniciales estaban siendo seguidos.
Justificación del beneficio de la ablación de la FA en la ICLa IC y la FA son patologías estrechamente relacionadas, y se ha demostrado que la FA es un factor independiente de mal pronóstico en la IC, por lo que el abordaje de la FA en estos pacientes podría ser determinante. En referencia al tratamiento farmacológico, estudios previos como el AF-CHF no demostraron un beneficio de la estrategia de control del ritmo comparada con el control de la frecuencia. Por el contrario, posteriores ensayos clínicos aleatorizados que evaluaron el papel de la ablación con catéter en pacientes con IC han podido demostrar la superioridad de la ablación comparada con el tratamiento farmacológico. Probablemente la ausencia de beneficio observada en el estudio AF-CHF podría ser atribuida a un exceso de mortalidad secundaria al uso de fármacos antiarrítmicos en pacientes con IC.
Además, el estudio CASTLE-AF pone en evidencia la relevancia de la ablación en términos de carga arrítmica, proporcionando una reducción mantenida a largo plazo y su relación con el pronóstico de los pacientes con ICFEr. Un reciente análisis post hoc mostró que los pacientes cuya carga de FA tras la ablación se redujo a <6% presentaron una reducción aproximada de 3veces la tasa de eventos adversos en el seguimiento, en comparación con los pacientes con cargas de FA tras tratamiento ≥6%38. Otro de los resultados a destacar es la falta de asociación entre la incidencia de recurrencia de FA (como variable dicotómica) con muerte u hospitalización por IC. Todo ello ha conducido a un cambio conceptual: el éxito del procedimiento no se debe basar en la ausencia absoluta de recurrencia, sino en la reducción de la carga de FA. Al igual que ocurre con la extrasistolia ventricular en pacientes con disfunción ventricular39, la reducción del tiempo en FA tiene efectos beneficiosos en cuanto a calidad de vida, mejora de la función ventricular e incluso hospitalizaciones y supervivencia37,38. En este sentido, recientemente se han llevado a cabo estudios en pacientes portadores de dispositivos implantables29,40,41, que han ratificado el importante papel de la ablación en la reducción de la carga de FA. En el estudio CIRCA-DOSE se observó que la ablación de la FA paroxística redujo la carga arrítmica en un 99%, pese a que la tasa de recurrencia evaluada como episodio de FA>30s (objetivo clásico) fue del 47%29. Por tanto, los estudios CASTLE-AF y CIRCA-DOSE nos proporcionan una nueva perspectiva con la que evaluar el éxito clínico de la ablación de la FA.
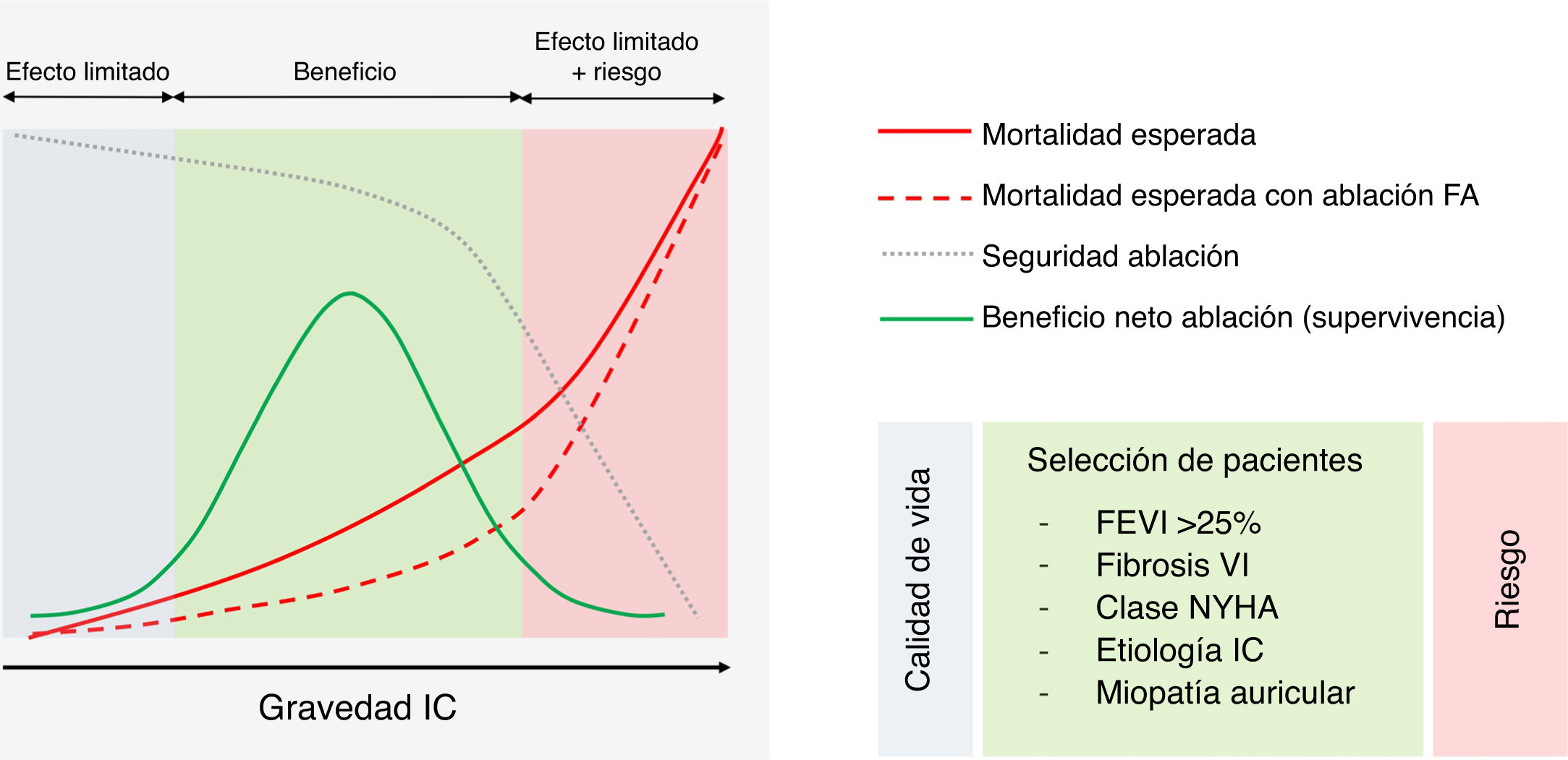
Ablación de la FA: ¿una terapia para todos los pacientes con IC?Las nuevas evidencias atribuyen un papel prometedor de la ablación de la FA en pacientes con IC. Sin embargo, existen variables clínicas que podrían ser determinantes para ofrecer un beneficio clínico en esta población. El análisis de subgrupos del estudio CASTLE-AF mostró que los pacientes con disfunción sistólica grave del ventrículo izquierdo (FEVI<25%) no obtuvieron beneficio de la ablación con respecto al tratamiento médico. La capacidad de recuperación del ventrículo izquierdo parece estar estrechamente vinculada al grado de cicatriz miocárdica. El estudio CAMERA-MRI36 observó que la recuperación de la FEVI tras la ablación de la FA en pacientes con IC era inversamente proporcional al grado de fibrosis ventricular (detectada por captación tardía de gadolinio en resonancia cardiaca), de modo que los pacientes que más se beneficiaron fueron aquellos con menor proporción de fibrosis. Parece razonable, por tanto, no ofrecer esta estrategia de tratamiento a los pacientes con IC avanzada y pobre capacidad de recuperación de la función ventricular (punto de no retorno). De igual modo, como sucede con otras terapias para la IC avanzada como la resincronización cardiaca, la capacidad funcional y la etiología de la IC podrían ser factores determinantes de la respuesta clínica a la ablación42,43.
Por otro lado, hay una gran evidencia de que el grado de enfermedad auricular (determinado en base al tamaño, geometría y fibrosis de la aurícula izquierda) determina el resultado de la ablación44-46, siendo un factor a tener en cuenta a la hora de seleccionar los pacientes candidatos a ablación.
Los efectos en mortalidad pueden ser difíciles de observar en población con FA de bajo riesgo, ya que la mortalidad esperada es baja. Por otro lado, en pacientes con cardiopatía muy evolucionada, en los que se ha alcanzado un punto de no retorno, la ablación de la FA puede no ofrecer ningún beneficio y, en cambio, exponer al paciente a un riesgo inasumible de complicaciones (principalmente consecuencia de la descompensación de la IC periprocedimiento). Por todo lo expuesto, la correcta selección de los pacientes será crucial para ofrecer un beneficio clínico de la ablación de la FA en población de IC (fig. 2).
Impacto en mortalidad de la ablación de la fibrilación auricular (FA) en la insuficiencia cardiaca (IC). Gráfico conceptual sobre los factores pronósticos de respuesta a la ablación de la FA en pacientes con IC.
FEVI: fracción de eyección del ventrículo izquierdo; NYHA, New York Heart Association; VI: ventrículo izquierdo.
En población de ICFEr y FA la ablación con catéter de la FA ha demostrado mejorar la calidad de vida, la capacidad de ejercicio, la función sistólica y reducir la mortalidad y los ingresos por IC. Dichos resultados constituyen un cambio de paradigma en el tratamiento de la FA en IC, favoreciendo cada vez más la implementación de terapias no farmacológicas de la FA en estos pacientes. Actualmente hay un amplio debate sobre si existe evidencia suficiente que justifique un cambio en las guías de práctica clínica. En este sentido, la American Heart Association/American College of Cardiology/Heart Rhythm Society añade en una reciente actualización de las guías americanas de manejo de FA una nueva indicación de ablación en este subgrupo de pacientes (no presente en las guías anteriores de 2014), concediéndose una recomendación claseIb con nivel de evidenciaB47. El texto justifica el no haber otorgado un mayor grado de recomendación debido a las limitaciones de los estudios, alegando tamaños muestrales relativamente pequeños y altamente seleccionados.
En cualquier caso, con los datos clínicos disponibles en la actualidad parece razonable incluir la ablación de la FA al arsenal terapéutico en centros con amplia experiencia con el objetivo de mejorar la calidad y la expectativa de vida de los pacientes con ICFEr.
FinanciaciónEste trabajo ha sido financiado por el Instituto de Salud CarlosIII, Ministerio de Economía y Competitividad, España (PI18/01227), CIBER Cardiovascular (CB16/11/00403), La Marató de TV3 (ID 201527).
R. Adeliño es beneficiaria de una Beca de Retenció de Talents (Institut d’Investigació en Ciències de la Salut Germans Trias i Pujol).
Conflicto de interesesNinguno de los autores de este manuscrito presenta conflicto de intereses.
Los autores agradecen a la doctora en medicina veterinaria Carolina Gálvez-Montón su asistencia en la edición de las figuras.