A pesar de que en los últimos años se ha avanzado en el control de los factores de riesgo vascular, los datos de vida real muestran cómo solo un porcentaje bajo de los pacientes consiguen alcanzar unas concentraciones de colesterol ligado a lipoproteínas de baja densidad definidos. Recientemente, han surgido nuevas dianas terapéuticas en el campo de los fármacos hipolipemiantes que pueden ayudar a la consecución de los objetivos terapéuticos recomendados por las guías de práctica clínica y, por consiguiente, reducir la incidencia de eventos vasculares adversos. No obstante, existen ciertas incertidumbres en la práctica clínica acerca del momento oportuno de su prescripción y en qué pacientes utilizarlas, en comparación con las terapias «clásicas» como las estatinas o la ezetimiba. Debido a este complejo escenario se propone este documento de consenso, certificado por las sociedades científicas que más frecuentemente se enfrentan al paciente con enfermedad aterosclerótica (SEC/SEA/SEEN/SEMFYC/SEMERGEN/SEMG/SEN/SEACV/S.E.N.), y cuyo objetivo es ayudar de una forma práctica y con la evidencia científica actual a la utilización de las nuevas terapias hipolipemiantes en diferentes escenarios clínicos.
Although in the last years a better control of vascular risk factors has been achieved, «real-world» data showed that only a few percentage of patients reach low-density lipoprotein-cholesterol goal levels. Recently, new therapies for the management of dyslipidaemias have emerged, and they could help to achieve the goal targets recommended by currents practical clinical guidelines so as to reduce vascular outcomes. Nevertheless, it is still uncertain in daily clinical practice the ideal timing of prescribing these new drugs, and what are the patients more benefited, compared to «classical» therapies such as statins and/or ezetimibe. In this complex scenario, this consensus document is proposed. It is certified by most of the scientific societies of clinical specialties that may play a role in the patient-healthcare process of atherosclerotic disease (SEC/SEA/SEEN/SEMFYC/SEMERGEN/SEMG/SEN/SEACV/S.E.N.), and its aim is to recommend some practical and simple guidelines, based on current scientific evidence, for the management of new therapies for dyslipidaemias in different scenarios of daily clinical practice.
La enfermedad aterosclerótica continúa siendo la causa más frecuente de morbimortalidad en nuestro entorno1. Existen pruebas consistentes de numerosos tipos de estudios clínicos y genéticos que establecen de forma inequívoca que las partículas de lipoproteínas de baja densidad son las principales causantes de la enfermedad vascular aterosclerótica2. Entre los factores de riesgo vascular, la disminución del colesterol unido a lipoproteínas de baja densidad (cLDL) constituye una de las intervenciones con mayor evidencia y respaldo científico en la reducción de eventos vasculares3. De hecho, clásicamente se ha considerado que cada mmol/l que desciende el cLDL implica una reducción del riesgo relativo de evento aterotrombótico del 22%4. Las actuales guías de práctica clínica de la Sociedad Europea de Cardiología en el manejo de las dislipidemias y de prevención vascular, así como del síndrome coronario agudo, recomiendan alcanzar determinadas concentraciones séricas de cLDL en función de la valoración del riesgo vascular del paciente, y además debería conseguirse lo antes posible, así como mantenerlas en el tiempo5–7. En concreto, para los pacientes de muy alto riesgo vascular (incluidos los que presentan enfermedad vascular establecida), el objetivo de cLDL es<55mg/dl y lograr una reducción del 50% de los niveles basales; incluso en pacientes con eventos aterotrombóticos recurrentes (en los primeros 2 años tras el primer evento) se pueden considerar unas concentraciones<40mg/dl. Previamente, y para facilitar la toma de decisiones, la Sociedad Española de Cardiología, junto con otras sociedades científicas, ha promovido documentos de consenso para facilitar la consecución de objetivos de cLDL8,9. No obstante, y aunque se ha avanzado en el control de los factores de riesgo vascular, los datos de vida real muestran cómo solo un porcentaje bajo de los pacientes consiguen alcanzar los objetivos de cLDL recomendados por las actuales guías de práctica clínica10–13.
En los últimos años han surgido nuevas dianas terapéuticas en el campo de los fármacos hipolipemiantes que pueden ayudar a la consecución de los objetivos terapéuticos recomendados por las guías de práctica clínica. Sin embargo, existen ciertas incertidumbres en la práctica clínica acerca del momento oportuno de su prescripción y en qué pacientes utilizarlas, en comparación con las terapias «clásicas» como las estatinas o la ezetimiba. En este complejo escenario nace este documento de consenso certificado por la Asociación de Cardiología Clínica, la Asociación de Cardiología Preventiva y la Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiológicos de la Sociedad Española de Cardiología, la Sociedad Española de Arteriosclerosis, la Sociedad Española de Endocrinología y Nutrición, la Sociedad Española de Medicina de Familia y Comunitaria, la Sociedad Española de Médicos de Atención Primaria, la Sociedad Española de Médicos Generales y de Familia, la Sociedad Española de Neurología, la Sociedad Española de Angiología y Cirugía Vascular, y la Sociedad Española de Nefrología; es decir, las sociedades científicas que más frecuentemente se enfrentan al paciente con enfermedad aterosclerótica, y cuyo objetivo es ayudar de una forma práctica a la utilización de las nuevas terapias hipolipemiantes en diferentes escenarios clínicos.
Nuevo abordaje en el tratamiento hipolipemianteLa aparición de nuevas terapias hipolipemiantes en la práctica clínica ha generado un enfoque disruptivo en la estrategia para el manejo de las dislipidemias. De hecho, el clásico concepto de tratamiento con estatina de baja, moderada o alta potencia ha dado paso al de tratamiento hipolipemiante de baja, moderada o alta intensidad, para lo cual se va a requerir con frecuencia la asociación de varios fármacos, en función de la potencia en la reducción del cLDL que proporciona su combinación. En este sentido, cobra especial importancia el cambio de paradigma en el abordaje de la enfermedad aterosclerótica, donde los términos prevención primaria/secundaria han dado paso a un enfoque más integral, cuyo objetivo sería la prevención de la aparición de la placa de ateroma, el tratamiento de la misma y la modificación y regresión si fuera posible14,15. De ahí la importancia de realizar una valoración precoz y a nivel poblacional del riesgo del paciente para poder administrar el tratamiento hipolipemiante adecuado que permita alcanzar los objetivos recomendados en función del riesgo individual (tabla 1). Esta evaluación ha de realizarse de manera integral, valorando el riesgo vascular del paciente; para ello, se recomienda utilizar las escalas de riesgo validadas por las actuales guías de práctica clínica, incluyendo valoración del componente genético/hereditario6. Además, la documentación de aterosclerosis subclínica, mediante eco-doppler vascular (que permite la detección de placas carotídeas o femorales), y la determinación de calcio en las arterias coronarias mediante tomografía computarizada pueden ayudar a definir el riesgo vascular con más precisión y de manera individualizada16. La presencia y gravedad de la arteriosclerosis son predictores de eventos vasculares y permiten una adecuada reclasificación del riesgo de poblaciones e individuos17. De hecho, las poblaciones que están peor representadas en las escalas de riesgo son las que más podrían beneficiarse de una estrategia de búsqueda activa de enfermedad subclínica, como son los pacientes con historia familiar de eventos vasculares en ausencia de factores de riesgo evidentes, la hipercolesterolemia familiar diagnosticada en la edad adulta, el riesgo vascular intermedio, la presencia de concentraciones elevadas de lipoproteína (a) [Lp(a)] familiar, la diabetes mellitus tipo 1 de larga evolución (especialmente sin complicaciones microangiopáticas), la diabetes mellitus tipo 2 de corta evolución (<8 años) y los pacientes con enfermedades inflamatorias crónicas. Por otro lado, es fundamental realizar un perfil lipídico completo que incluya no solo el colesterol total, el colesterol unido a lipoproteínas de alta densidad (cHDL), el cLDL, los triglicéridos o el colesterol no-HDL, sino también las concentraciones de lipoproteínas «aterogénicas», como la apolipoproteína B (ApoB), algunos índices aterogénicos (como triglicéridos/cHDL o cLDL/ApoB) y la Lp(a), ya que su elevación confiere un riesgo vascular aumentado18. Concretamente, las concentraciones de Lp(a) pueden reclasificar el riesgo, ya que pacientes con Lp(a)≥210nmol/l presentan mayor riesgo vascular y, aunque todavía no hay datos para establecer un cambio/reclasificación en la categoría de riesgo –salvo concentraciones de Lp(a)>430nmol/l (180mg/dl), en cuyo caso se considera equivalente a una hipercolesterolemia familiar–, se recomienda plantear unos objetivos de cLDL más estrictos5,19. No es de extrañar, pues, que existan dianas terapéuticas sobre la Lp(a), como olpasiran, lepodisiran y pelacarsen, actualmente en desarrollo20.
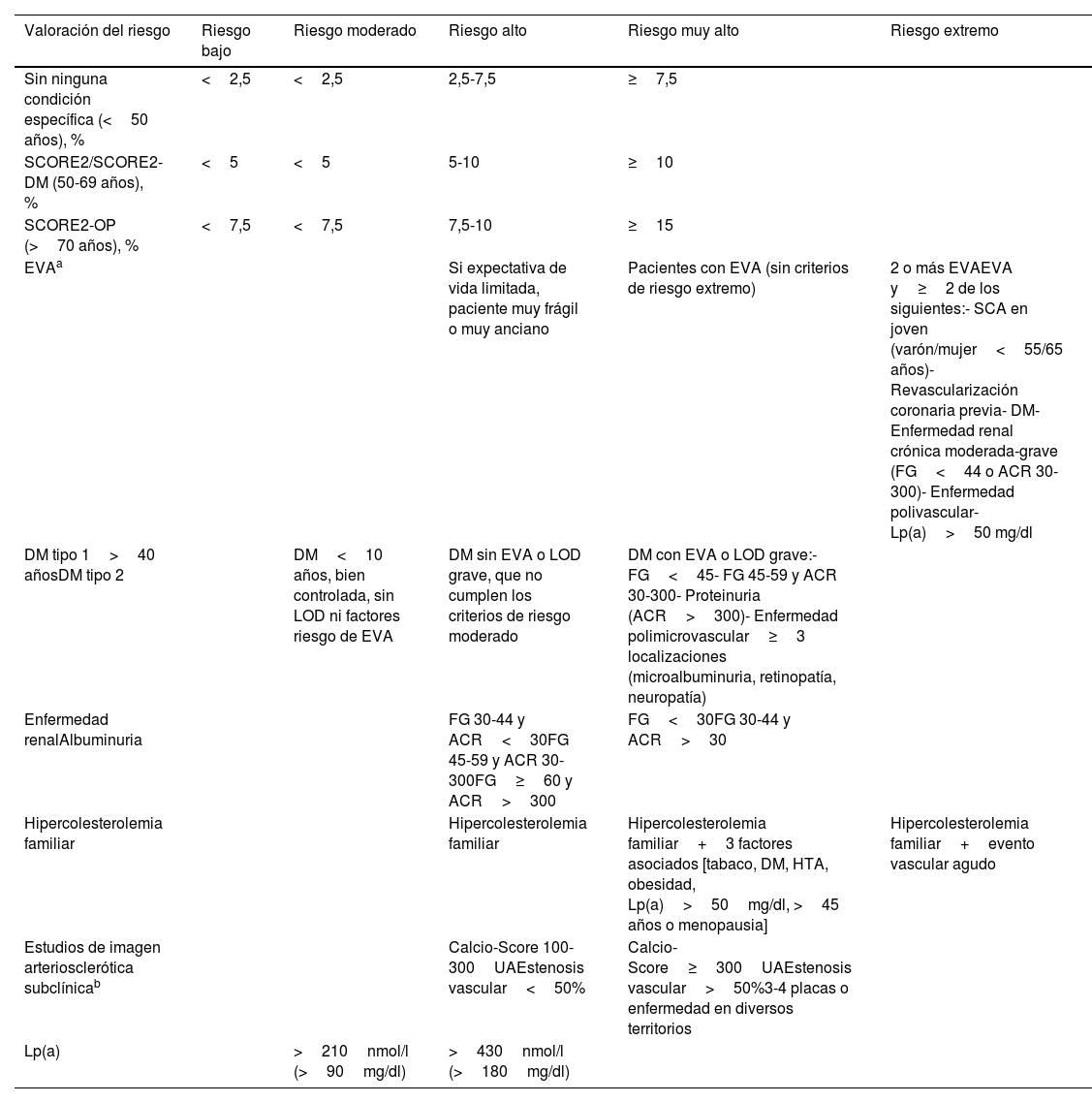
Estratificación del riesgo vascular
| Valoración del riesgo | Riesgo bajo | Riesgo moderado | Riesgo alto | Riesgo muy alto | Riesgo extremo |
|---|---|---|---|---|---|
| Sin ninguna condición específica (<50 años), % | <2,5 | <2,5 | 2,5-7,5 | ≥7,5 | |
| SCORE2/SCORE2-DM (50-69 años), % | <5 | <5 | 5-10 | ≥10 | |
| SCORE2-OP (>70 años), % | <7,5 | <7,5 | 7,5-10 | ≥15 | |
| EVAa | Si expectativa de vida limitada, paciente muy frágil o muy anciano | Pacientes con EVA (sin criterios de riesgo extremo) | 2 o más EVAEVA y≥2 de los siguientes:- SCA en joven (varón/mujer<55/65 años)- Revascularización coronaria previa- DM- Enfermedad renal crónica moderada-grave (FG<44 o ACR 30-300)- Enfermedad polivascular- Lp(a)>50 mg/dl | ||
| DM tipo 1>40 añosDM tipo 2 | DM<10 años, bien controlada, sin LOD ni factores riesgo de EVA | DM sin EVA o LOD grave, que no cumplen los criterios de riesgo moderado | DM con EVA o LOD grave:- FG<45- FG 45-59 y ACR 30-300- Proteinuria (ACR>300)- Enfermedad polimicrovascular≥3 localizaciones (microalbuminuria, retinopatía, neuropatía) | ||
| Enfermedad renalAlbuminuria | FG 30-44 y ACR<30FG 45-59 y ACR 30-300FG≥60 y ACR>300 | FG<30FG 30-44 y ACR>30 | |||
| Hipercolesterolemia familiar | Hipercolesterolemia familiar | Hipercolesterolemia familiar+3 factores asociados [tabaco, DM, HTA, obesidad, Lp(a)>50mg/dl, >45 años o menopausia] | Hipercolesterolemia familiar+evento vascular agudo | ||
| Estudios de imagen arteriosclerótica subclínicab | Calcio-Score 100-300UAEstenosis vascular<50% | Calcio-Score≥300UAEstenosis vascular>50%3-4 placas o enfermedad en diversos territorios | |||
| Lp(a) | >210nmol/l (>90mg/dl) | >430nmol/l (>180mg/dl) |
ACR: cociente albúmina/creatinina (mg/g); DM: diabetes mellitus; EVA: enfermedad vascular aterosclerótica; FG: filtrado glomerular (ml/min/1,73m2); HTA: hipertensión arterial; Lp(a): lipoproteína (a); LOD: lesión órgano diana; SCA: síndrome coronario agudo; UA: unidades Agatston.
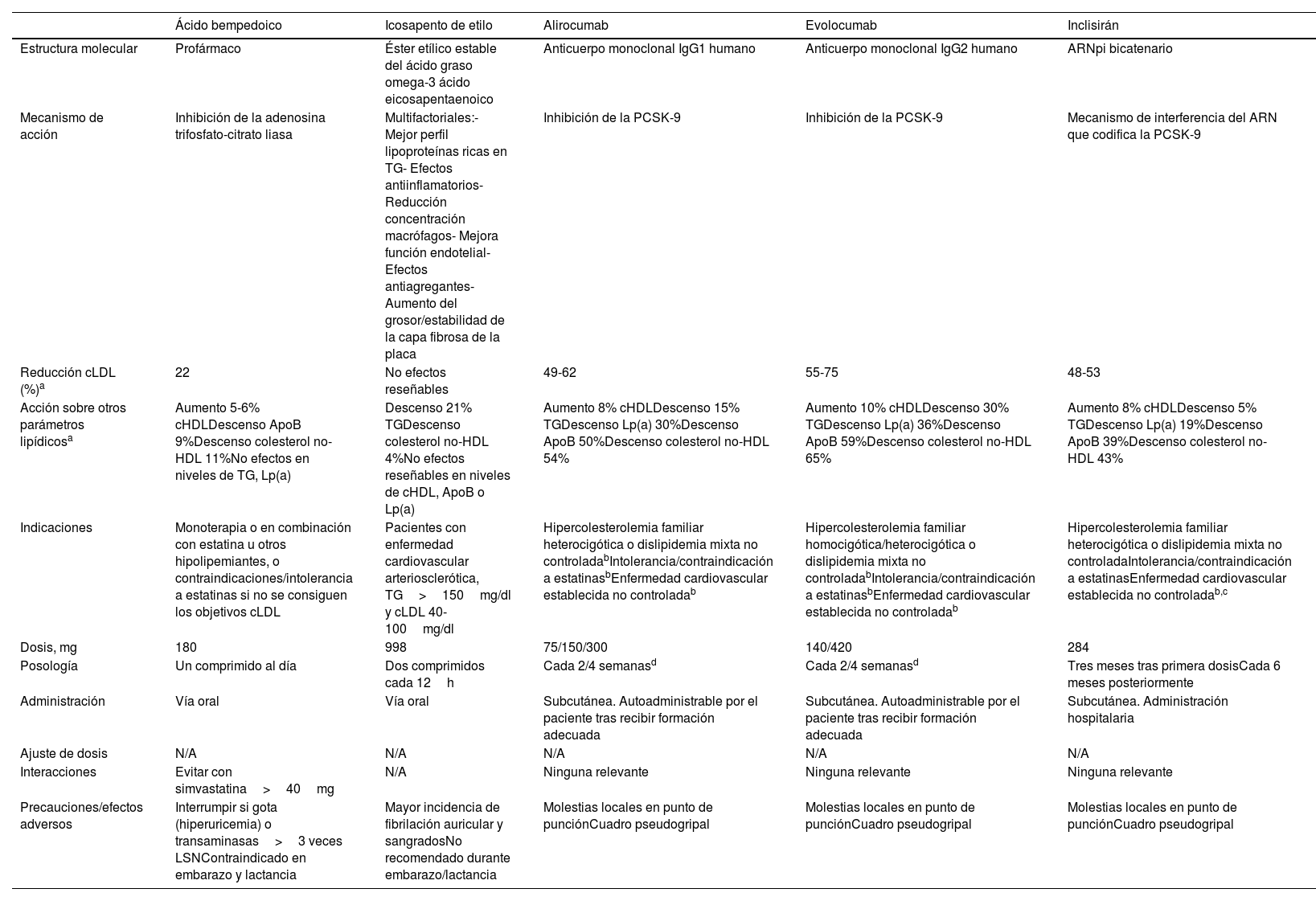
La tabla 2 resume las principales características de los nuevos fármacos hipolipemiantes. Los fármacos inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), evolocumab y alirocumab, son anticuerpos monoclonales administrados de manera subcutánea, una o 2 veces al mes en función de su posología y su dosis, que producen un aumento de la concentración de receptores cLDL en el hepatocito21. Consiguen una potente y rápida reducción de las cifras de cLDL (60-75%), así como un descenso de otros parámetros lipídicos como la ApoB (59%), la Lp(a) (36%) o el colesterol no-HDL (65%)22. Ambas moléculas han demostrado una disminución significativa de eventos vasculares frente a placebo (tanto en pacientes con aterosclerosis crónica como en los que han tenido un síndrome coronario agudo reciente), sin asociarse a eventos adversos significativos23,24.
Resumen de las nuevas terapias farmacológicas para el tratamiento de dislipidemias
| Ácido bempedoico | Icosapento de etilo | Alirocumab | Evolocumab | Inclisirán | |
|---|---|---|---|---|---|
| Estructura molecular | Profármaco | Éster etílico estable del ácido graso omega-3 ácido eicosapentaenoico | Anticuerpo monoclonal IgG1 humano | Anticuerpo monoclonal IgG2 humano | ARNpi bicatenario |
| Mecanismo de acción | Inhibición de la adenosina trifosfato-citrato liasa | Multifactoriales:- Mejor perfil lipoproteínas ricas en TG- Efectos antiinflamatorios- Reducción concentración macrófagos- Mejora función endotelial- Efectos antiagregantes- Aumento del grosor/estabilidad de la capa fibrosa de la placa | Inhibición de la PCSK-9 | Inhibición de la PCSK-9 | Mecanismo de interferencia del ARN que codifica la PCSK-9 |
| Reducción cLDL (%)a | 22 | No efectos reseñables | 49-62 | 55-75 | 48-53 |
| Acción sobre otros parámetros lipídicosa | Aumento 5-6% cHDLDescenso ApoB 9%Descenso colesterol no-HDL 11%No efectos en niveles de TG, Lp(a) | Descenso 21% TGDescenso colesterol no-HDL 4%No efectos reseñables en niveles de cHDL, ApoB o Lp(a) | Aumento 8% cHDLDescenso 15% TGDescenso Lp(a) 30%Descenso ApoB 50%Descenso colesterol no-HDL 54% | Aumento 10% cHDLDescenso 30% TGDescenso Lp(a) 36%Descenso ApoB 59%Descenso colesterol no-HDL 65% | Aumento 8% cHDLDescenso 5% TGDescenso Lp(a) 19%Descenso ApoB 39%Descenso colesterol no-HDL 43% |
| Indicaciones | Monoterapia o en combinación con estatina u otros hipolipemiantes, o contraindicaciones/intolerancia a estatinas si no se consiguen los objetivos cLDL | Pacientes con enfermedad cardiovascular arteriosclerótica, TG>150mg/dl y cLDL 40-100mg/dl | Hipercolesterolemia familiar heterocigótica o dislipidemia mixta no controladabIntolerancia/contraindicación a estatinasbEnfermedad cardiovascular establecida no controladab | Hipercolesterolemia familiar homocigótica/heterocigótica o dislipidemia mixta no controladabIntolerancia/contraindicación a estatinasbEnfermedad cardiovascular establecida no controladab | Hipercolesterolemia familiar heterocigótica o dislipidemia mixta no controladaIntolerancia/contraindicación a estatinasEnfermedad cardiovascular establecida no controladab,c |
| Dosis, mg | 180 | 998 | 75/150/300 | 140/420 | 284 |
| Posología | Un comprimido al día | Dos comprimidos cada 12h | Cada 2/4 semanasd | Cada 2/4 semanasd | Tres meses tras primera dosisCada 6 meses posteriormente |
| Administración | Vía oral | Vía oral | Subcutánea. Autoadministrable por el paciente tras recibir formación adecuada | Subcutánea. Autoadministrable por el paciente tras recibir formación adecuada | Subcutánea. Administración hospitalaria |
| Ajuste de dosis | N/A | N/A | N/A | N/A | N/A |
| Interacciones | Evitar con simvastatina>40mg | N/A | Ninguna relevante | Ninguna relevante | Ninguna relevante |
| Precauciones/efectos adversos | Interrumpir si gota (hiperuricemia) o transaminasas>3 veces LSNContraindicado en embarazo y lactancia | Mayor incidencia de fibrilación auricular y sangradosNo recomendado durante embarazo/lactancia | Molestias locales en punto de punciónCuadro pseudogripal | Molestias locales en punto de punciónCuadro pseudogripal | Molestias locales en punto de punciónCuadro pseudogripal |
ApoB: apolipoproteína B; ARNpi: ácido ribonucleico de interferencia pequeño; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína (a); LSN: límite superior de la normalidad; N/A: no aplica; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; SC: subcutánea; TG: triglicéridos.
Inclisirán es el primer fármaco en el ámbito vascular que utiliza ácido ribonucleico de interferencia. Se trata de un ácido ribonucleico pequeño bicatenario sintético que, administrado de forma subcutánea, interfiere en el ácido ribonucleico que codifica la PCSK9. Este mecanismo produce una disminución de la concentración de esta proteína, lo que hace que se incremente el reciclado y la expresión del receptor del cLDL en la superficie celular de los hepatocitos, aumentando la recaptación de cLDL y reduciendo sus niveles circulantes25. Su efecto frente a PCSK9 se mantiene varios meses, lo que permite su administración en 2 inyecciones al año (excepto la segunda dosis, que ha de pautarse a los 3 meses). Se trata de una terapia que reduce las concentraciones de cLDL en torno al 50%, junto con un descenso importante del resto de otros parámetros lipídicos, como ApoB (39%), Lp(a) (19%) o colesterol no-HDL (43%)26. Aunque se encuentran en marcha estudios específicos para evaluar la capacidad de inclisirán de reducir los eventos vasculares, teniendo en cuenta su capacidad para reducir el cLDL, así como los análisis secundarios de estudios ya publicados, es razonable estimar que muy probablemente pueda ser eficaz para mejorar el pronóstico de los pacientes27,28.
Por otro lado, el ácido bempedoico consigue, de forma complementaria a las estatinas, aumentar la reducción de cLDL. Se trata de un profármaco administrado por vía oral una vez al día que actúa inhibiendo la enzima adenosina trifosfato-citrato liasa (paso previo al que inhiben las estatinas en la síntesis del colesterol en el hígado)29. Como el ácido bempedoico es un profármaco, requiere su activación por una enzima (acil-CoA sintetasa 1), que se encuentra en el hígado, pero no en el músculo esquelético, de ahí una primera ventaja con respecto a las estatinas: la reducción de efectos adversos musculares. Reduce las concentraciones de cLDL en torno al 22%, con leves descensos en el resto de los parámetros lipídicos, junto con una reducción significativa de la proteína C reactiva (20%). Su administración a pacientes con alto riesgo vascular que tenían intolerancia a estatinas o no estaban dispuestos a continuar este tratamiento ha demostrado una disminución de eventos vasculares30. El ácido bempedoico es un fármaco con buena tolerancia, recomendándose su interrupción en caso de aparición de hiperuricemia acompañada de síntomas de gota o si persiste un aumento de las transaminasas 3 veces superior a los valores normales, y debe evitarse su administración concomitante con dosis de simvastatina>40mg, circunstancia esta que no supone realmente una limitación desde el punto de vista clínico.
Aunque clásicamente los fibratos se han utilizado para reducir la hipertrigliceridemia, son fármacos que únicamente han demostrado reducir eventos vasculares en pacientes sin tratamiento con estatinas. Además, y dado que incluso pacientes con buen control de cLDL todavía presentan un riesgo residual no desdeñable, fármacos como el icosapento de etilo pueden ayudar a reducir los eventos vasculares. Se trata de un éster etílico estable del ácido graso omega-3 ácido eicosapentaenoico que consigue reducciones en torno al 21% de los triglicéridos, pero sin efectos reseñables a nivel de cLDL u otros parámetros lipídicos31. Su mecanismo de acción es multifactorial, desde efectos antiinflamatorios hasta mejora de la función endotelial, pasando por efectos antiagregantes y estabilidad de la capa fibrosa de la placa ateromatosa32. La administración de 2 cápsulas cada 12h en pacientes con enfermedad vascular aterosclerótica, con niveles de triglicéridos séricos entre 150-499mg/dl, tratados con estatinas y con concentraciones de cLDL 40-100mg/dl, ha demostrado una significativa reducción de eventos vasculares, con un leve aumento en la incidencia de fibrilación auricular y hemorragias no fatales33. Esta reducción es muy reseñable en aquellos pacientes que presentaron un síndrome coronario agudo en los 12 meses previos a su inclusión, objetivando un número de pacientes a tratar para reducir un evento tan bajo como 1134. Por último, hay que destacar que estos resultados no son aplicables a otros preparados de omega-3 porque la composición es diferente.
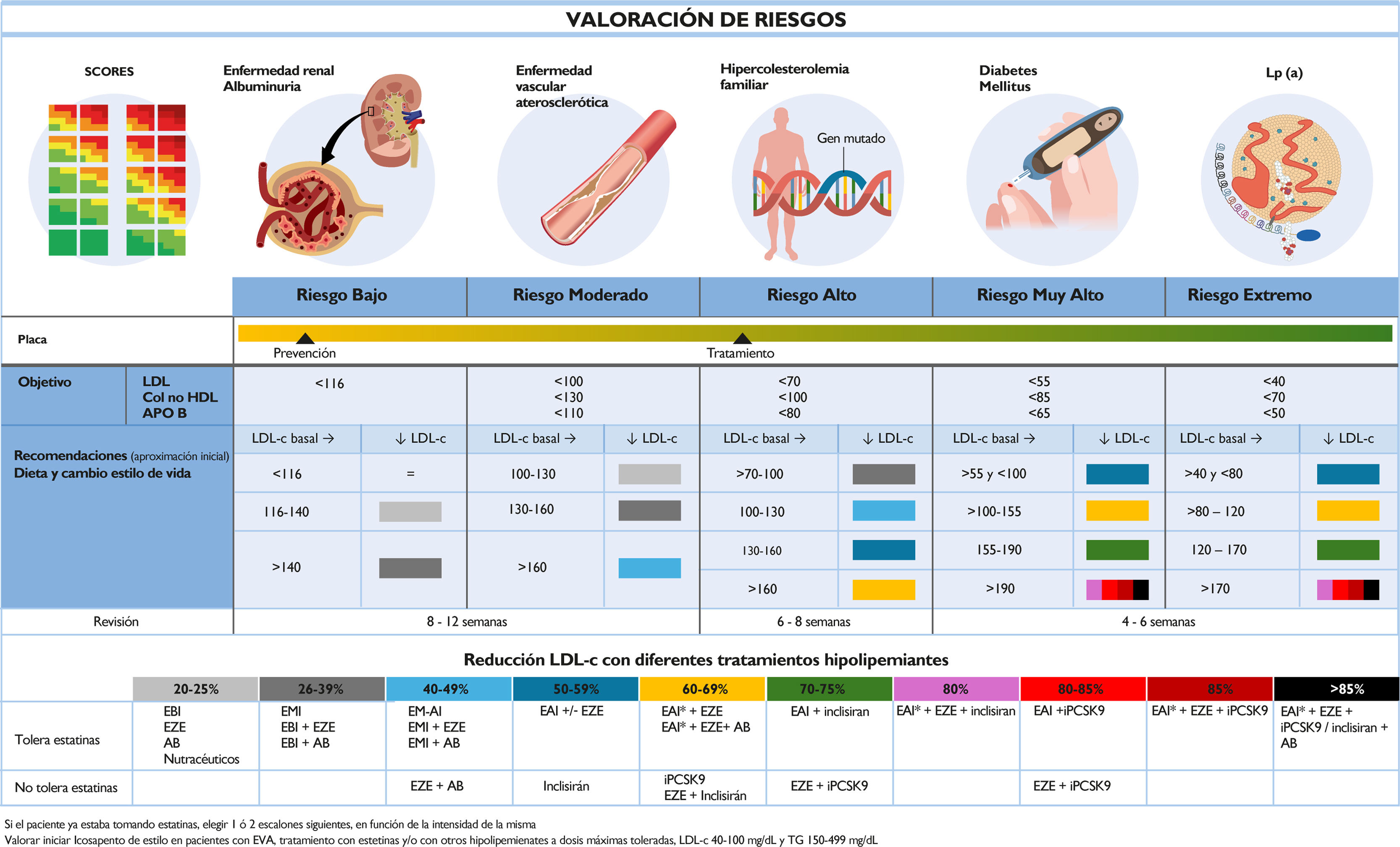
Recomendaciones del grupo de trabajo en diferentes escenarios clínicosA raíz de las evidencias provenientes de los diferentes ensayos clínicos y estudios de vida real, ha evolucionado la aproximación al paciente con dislipidemia. De esta forma, se ha pasado de una estrategia escalonada del tratamiento hipolipemiante, como abogaban las guías europeas de dislipidemia de 2019, a una estrategia individualizada, en la que se debería pautar el tratamiento hipolipemiante de inicio para lograr los objetivos de cLDL cuanto antes, si es posible en el momento de atender al paciente, independientemente del sitio donde esto ocurra5. Es lo que se ha denominado estrategia Fire to Target, imprescindible en pacientes de riesgo cardiovascular alto, muy alto y extremo35. Con este objetivo se publicaron en 2020 y 2021 una serie de algoritmos de tratamiento del paciente dislipidémico tanto en prevención secundaria como primaria, sencillos y fácilmente aplicables, con el fin de lograr que la mayoría de los pacientes lograran los objetivos de control de colesterol de una manera rápida y eficiente8,9. De hecho, su implementación se ha asociado con un mayor grado de control en España36. Sin embargo, dado que en los últimos años han aparecido nuevas evidencias que refuerzan esta estrategia, además de nuevas alternativas terapéuticas, es necesario actualizar dichos algoritmos. Como objetivo principal de tratamiento se sigue manteniendo el cLDL, aunque también se proponen el colesterol no-HDL y la ApoB como objetivos alternativos. Los objetivos terapéuticos varían en función del riesgo vascular del paciente, como se describe en las figuras 1-4. Se ha dividido en 5 categorías de riesgo a los pacientes: bajo, moderado, elevado, muy elevado y extremo. Se mantienen, por tanto, las categorías de riesgo propuestas por las guías europeas de dislipidemias de 2019 y de prevención cardiovascular de 2021, y se añade específicamente la categoría de riesgo extremo, con un objetivo de cLDL<40mg/dl que, aunque era el objetivo que ya se recomendaba previamente en pacientes con 2 eventos vasculares (en el mismo o distinto territorio), dicha categoría se han ampliado a más pacientes5,6.
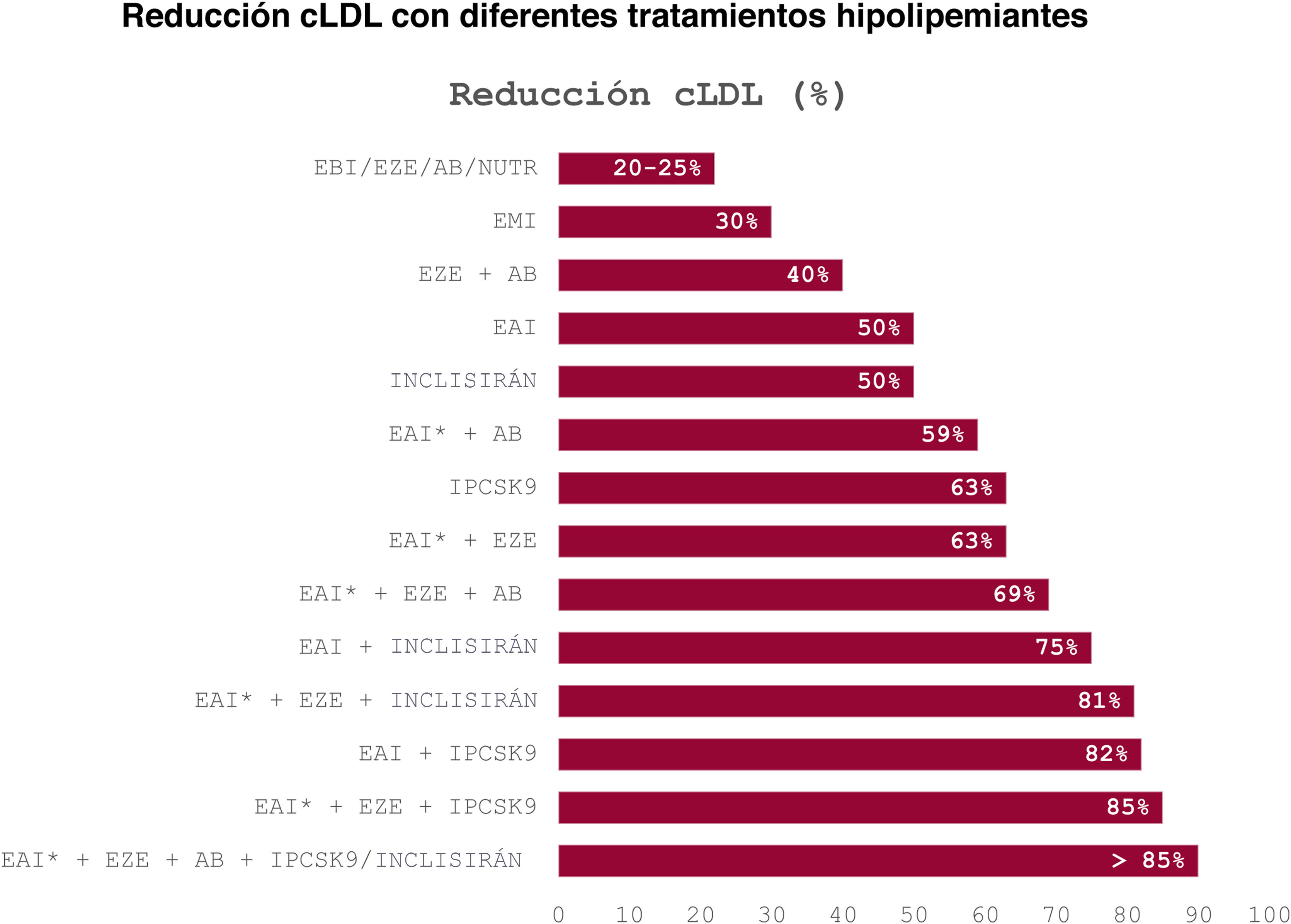
Porcentaje de reducción teórica de las concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL) en función de la combinación de hipolipemiantes. La respuesta al tratamiento es individual y se recomienda que sea reevaluada mediante análisis periódicos. En el caso de concentraciones elevadas de lipoproteína (a), la eficacia de los fármacos inyectables es mayor. En pacientes de riesgo extremo, considerar priorizar fármacos inyectables (inhibidores PCSK9, inclisirán). Si el paciente ya estaba tomando estatinas, elegir uno o 2 escalones siguientes, en función de la intensidad de la misma. AB: ácido bempedoico; EAI: estatina de alta intensidad (rosuvastatina 20-40mg, atorvastatina 40-80mg); EBI: estatina de baja intensidad; EMI: estatina de moderada intensidad; EZE: ezetimiba; iPCSK9: inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (alirocumab, evolocumab); NUTR: combinación nutracéutica con evidencia científica.
*Incluye también rosuvastatina 10mg.
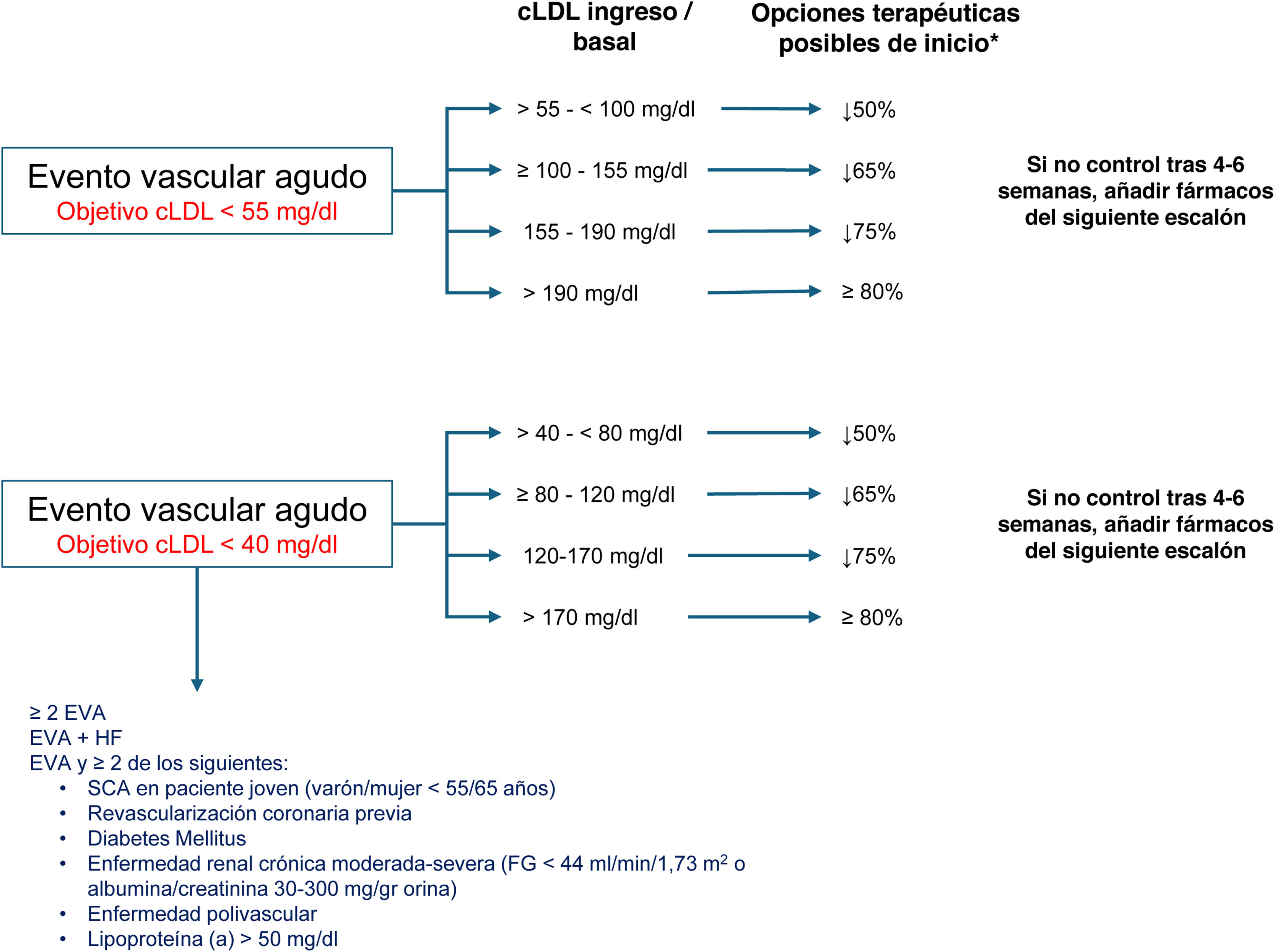
Recomendaciones de tratamiento hipolipemiante tras un evento vascular agudo en pacientes con riesgo vascular muy alto o extremo. Elegir la opción terapéutica según el objetivo de reducción de colesterol unido a lipoproteínas de baja densidad (cLDL) en función de la intensidad requerida (fig. 1). cLDL: colesterol unido a lipoproteínas de baja densidad; EVA: evento vascular agudo (cerebral, cardiaco, enfermedad aneurismática o arterial periférica); FG: filtrado glomerular; HF: hipercolesterolemia familiar; SCA: síndrome coronario agudo.
*Si el paciente ya estaba tomando estatinas, elegir uno o 2 escalones siguientes, en función de la intensidad de la misma.
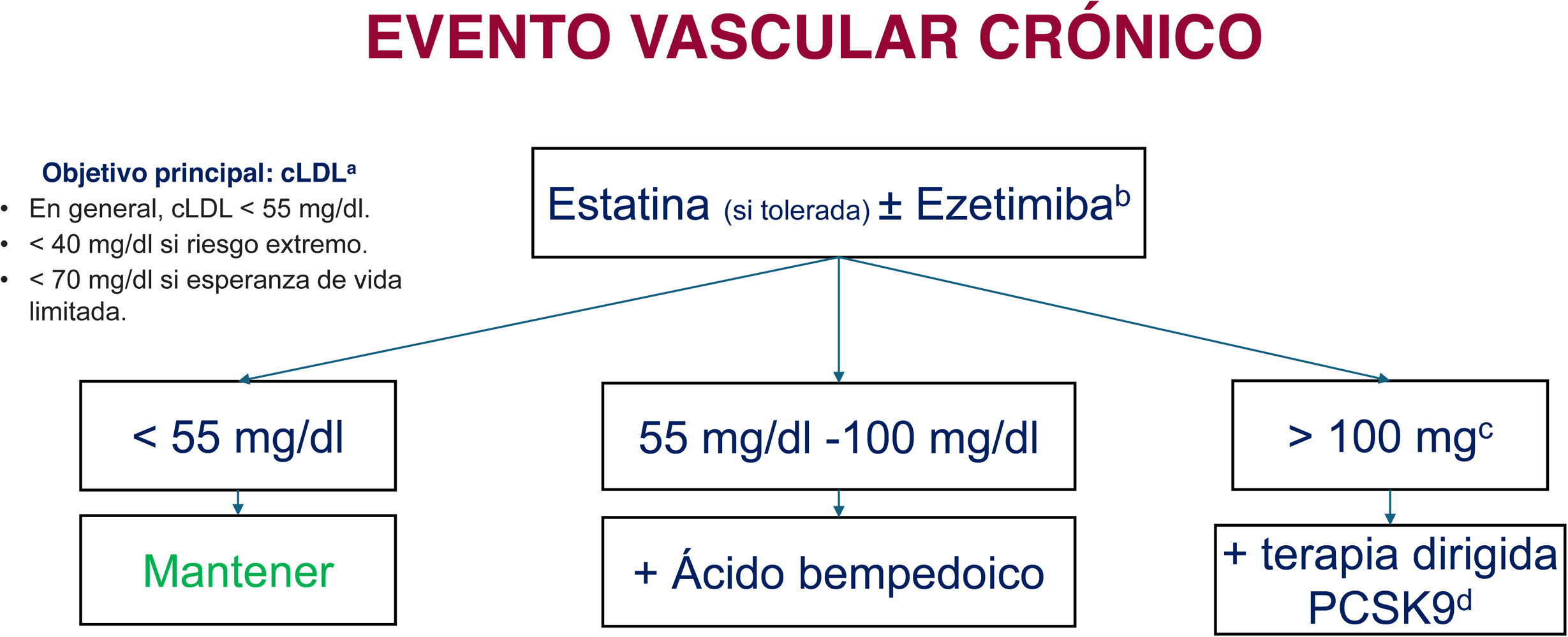
Recomendaciones de tratamiento hipolipemiante tras un evento vascular «crónico» en pacientes con riesgo vascular muy alto o extremo. Elegir la opción terapéutica según el objetivo de reducción de colesterol unido a lipoproteínas de baja densidad (cLDL) en función de la intensidad requerida (fig. 1). EVA: evento vascular agudo (cerebral, cardiaco, enfermedad aneurismática o arterial periférica); FG: filtrado glomerular; HF: hipercolesterolemia familiar; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; SCA: síndrome coronario agudo; TG: triglicéridos.
a Reducción del riesgo de eventos vasculares en pacientes adultos con diagnóstico de enfermedad arteriosclerótica y con un riesgo alto de eventos vasculares con tratamiento optimizado y cLDL 40-100mg/dl, con TG 150-499mg/dl a pesar del tratamiento con estatinas u otros hipolipemiantes a dosis máximas toleradas icosapento de etilo.
b Si intolerancia parcial o total a estatinas, considerar la triple o doble terapia oral de inicio con±estatinas+ezetimiba+ácido bempedoico. Si el paciente ya estaba tomando estatinas, elegir uno o 2 escalones siguientes, en función de la intensidad de la misma.
c >70mg/dl si≥1 de las siguientes circunstancias:
• ≥2 EVA
• EVA+HF
• EVA y≥2 de los siguientes:
• SCA en paciente joven (varón/mujer<55/65 años)
• Revascularización coronaria previa
• Diabetes mellitus
• Enfermedad renal crónica moderada-grave (FG<44ml/min/1,73m2 o albúmina/creatinina 30-300mg/g orina)
• Enfermedad polivascular
• Lipoproteína (a)>50mg/dl
d Alirocumab, evolocumab, inclisirán.
Elegir en función de:
• Capacidad de reducir cLDL
• Evidencia sobre eventos vasculares
• Adherencia al tratamiento
• Experiencia
• Preferencias del paciente.
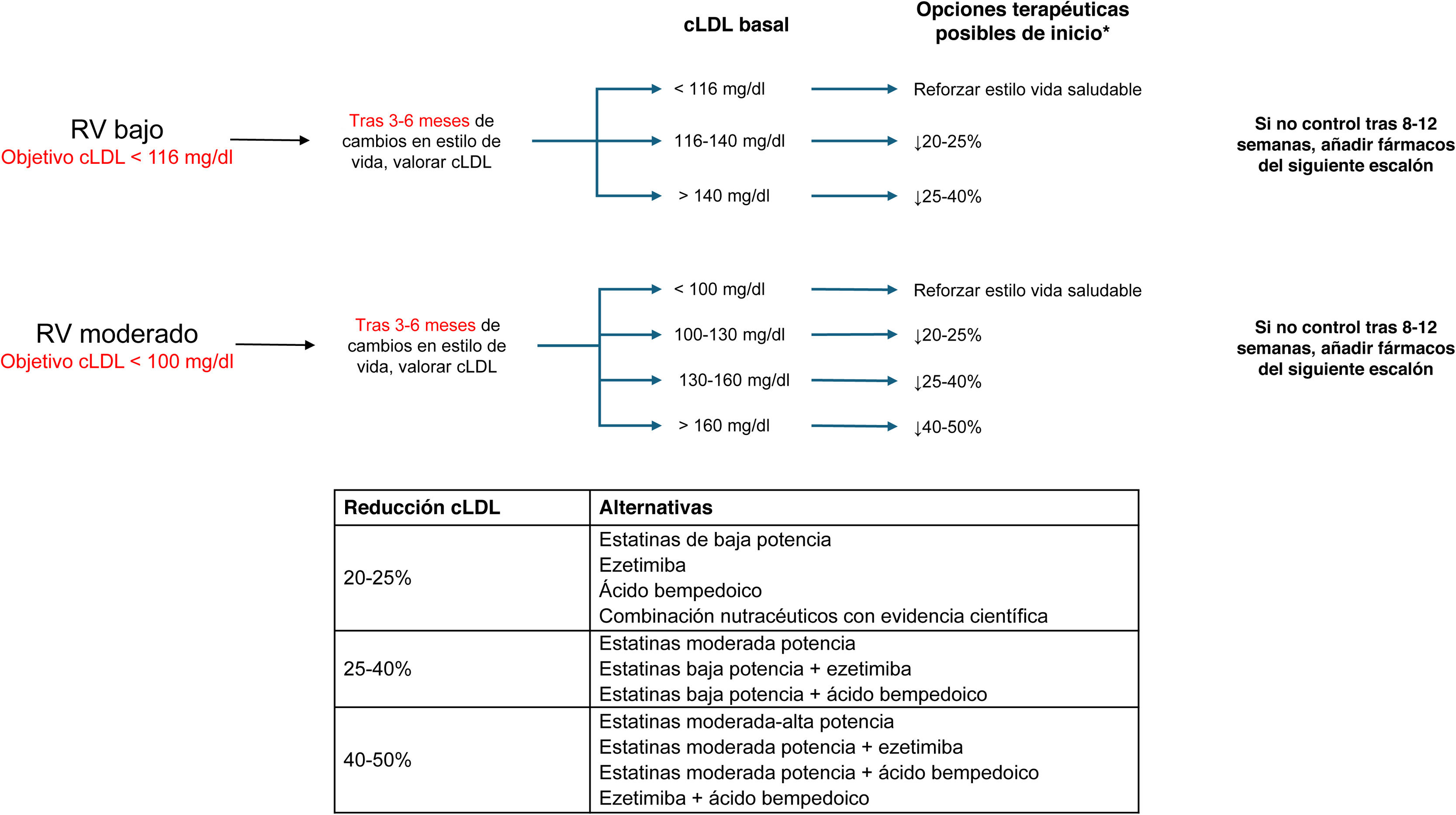
Recomendaciones de tratamiento hipolipemiantes en pacientes con riesgo vascular (RV) bajo, moderado y alto. Elegir la opción terapéutica según el objetivo de reducción de colesterol unido a lipoproteínas de baja densidad (cLDL) en función de la intensidad requerida (fig. 1).
*Si el paciente ya estaba tomando estatinas, elegir uno o 2 escalones siguientes, en función de la intensidad de la misma.
Para conseguir el objetivo de cLDL, se han dividido las terapias hipolipemiantes, solas o en combinación, en función de su capacidad para reducir el cLDL, con un código de colores asociado. Considerando el cLDL basal del paciente y el objetivo final, se indica, según el código de colores, la reducción porcentual necesaria para alcanzar dichos objetivos. Si el paciente ya estaba tomando estatinas, se debería elegir uno o 2 escalones siguientes, en función de la intensidad de la estatina que tomara el paciente. Por otra parte, si bien en todo paciente se tienen que recomendar cambios en el estilo de vida, en el caso de pacientes de riesgo bajo o moderado se podrá esperar 3 meses y valorar la respuesta antes de iniciar tratamiento hipolipemiante farmacológico, pero en el resto de los casos se iniciará directamente el tratamiento farmacológico. Cuando haya varias alternativas terapéuticas que produzcan una misma reducción de cLDL, se tendrán en cuenta distintos factores, incluyendo evidencias sobre eventos vasculares, seguridad, posología y costes, entre otros. En lo que respecta a las terapias que actúan frente a PCSK9 (alirocumab, evolocumab, inclisirán), la decisión de qué fármaco utilizar va a venir determinada por la intensidad buscada en la reducción de las concentraciones de cLDL, su evidencia actual sobre eventos vasculares, la experiencia de uso, la importancia de la adherencia al tratamiento, la facilidad en la mejora de la continuidad asistencial, el coste y, finalmente, las preferencias del paciente (fig. 5).
Recomendaciones del Grupo de Trabajo sobre el Uso de Nuevas Terapias Hipolipemiantes en la Práctica Clínica. AB: ácido bempedoico; cLDL: colesterol ligado a lipoproteínas de baja densidad; EAI: estatinas de alta intensidad (rosuvastatina 20-40mg, atorvastatina 40-80mg); EBI: estatina de baja intensidad; EMI: estatina de moderada intensidad; EVA: enfermedad vascular aterosclerótica; EZE: ezetimiba; iPCSK9: inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (alirocumab, evolocumab); Lp(a): lipoproteína (a).
*Incluye también rosuvastatina 10mg. En pacientes con riesgo bajo/moderado, esperar 3 meses antes de iniciar medicación. En aquellos con riesgo alto/muy alto/extremo, iniciar directamente con medicación.
Entre las anomalías lipídicas características de los pacientes con enfermedad renal crónica (ERC) se encuentran niveles elevados de triglicéridos, disminuidos de cHDL y la presencia de partículas cLDL pequeñas y densas37. Estas anomalías lipídicas imitan y se solapan con la enfermedad metabólica y la diabetes como causa más prevalente de ERC. La ERC se considera un equivalente de enfermedad vascular, por lo que las recomendaciones avalan una intensa reducción de las concentraciones de cLDL acorde al filtrado glomerular38. En la práctica clínica, las recientes guías KDIGO 2024 aún recomiendan una estrategia denominada Fire and Forget en la que todos los pacientes con ERC>50 años con filtrado glomerular<60ml/min que no reciban diálisis crónica deben ser tratados con estatinas o con una combinación de estatinas y ezetimiba, independientemente del cLDL basal39. Las guías de la Sociedad Europea de Cardiología recomiendan objetivos de cLDL<70mg/dl (ApoB, <80mg/dl; colesterol no-HDL, <100mg/dl) para el estadio 3 de ERC y cLDL<55mg/dl (ApoB, <65mg/dl; colesterol no-HDL, <85mg/dl) para los estadios 4/5 de ERC en combinación con una reducción de al menos el 50% del cLDL basal5,6. También se recomienda el tratamiento con estatinas a los receptores de trasplante renal, aunque la evidencia de los ensayos es limitada. No se recomienda iniciar el tratamiento con estatinas en los pacientes que requieren diálisis, pero debe continuarse si se ha prescrito antes. Es importante señalar que la eficacia vascular de la reducción del cLDL disminuye con el deterioro progresivo de la función renal y se pierde en pacientes con enfermedad renal terminal38,40. Los mecanismos responsables de este descenso de la eficacia del tratamiento hipolipemiante con la ERC progresiva siguen sin conocerse del todo, pero pueden ser atribuibles al riesgo competitivo de causas no vasculares de la enfermedad o a la posible irreversibilidad del proceso aterosclerótico mediante la reducción de cLDL cuando la ERC es terminal (existiendo un protagonismo relativamente menor de cLDL y la relevancia de cHDL bajo y disfuncionante). En consecuencia, actualmente se están explorando otros factores de riesgo predominantes, como la inflamación y el estrés oxidativo, como posibles dianas terapéuticas en la población con ERC. Respecto al tratamiento con nuevos fármacos hipolipemiantes, es relevante destacar los resultados de los análisis de subgrupos de los ensayos FOURIER y ODYSSEY41,42. En el primero, en pacientes con filtrado glomerular<59ml/min, evolocumab no reducía la incidencia del objetivo primario significativamente, y solo lo conseguía con el secundario. En el segundo, quizás por el menor descenso de cLDL, no había reducción significativa de eventos vasculares en estos pacientes.
ObesidadLa obesidad visceral y los depósitos ectópicos de grasa están íntimamente asociados a la dislipidemia aterogénica, un trastorno lipídico específico caracterizado por cambios cuantitativos y cualitativos de las lipoproteínas plasmáticas, impulsada principalmente por los efectos de la resistencia a la insulina y las adipocinas proinflamatorias43. La dislipidemia de la obesidad, caracterizada por concentraciones disminuidas de cHDL, hipertrigliceridemia y partículas pequeñas y densas de cLDL, es responsable en parte del elevado riesgo vascular residual de esta situación clínica. Este riesgo residual puede explicarse, al menos en parte, por la dislipidemia aterogénica característica de este grupo de pacientes. Por ello, parece que los pacientes con obesidad, incluso con niveles de cLDL en los niveles terapéuticos objetivo, tienen un riesgo vascular residual del 65 al 80%44. Por otra parte, las pequeñas partículas densas de cLDL, que también son componentes de la dislipidemia aterogénica, desempeñan un papel importante en el inicio y la progresión de la aterosclerosis45.
Paciente anciano/frágilLa enfermedad vascular aterosclerótica representa la principal causa de muerte y discapacidad en las personas mayores. Los ancianos y pacientes frágiles están escasamente representados en los ensayos clínicos, de ahí que hay escasa evidencia que apoye el beneficio del tratamiento hipolipemiante en ancianos para prevenir la enfermedad vascular arteriosclerótica. En población de edad avanzada, el inicio del tratamiento con estatinas en prevención primaria puede considerarse cuando el riesgo es muy alto y el objetivo cLDL<100mg/dl puede parecer razonable y debe hacerse con dosis bajas y escalonadas de estatinas, tal como recomiendan las guías. Las estatinas son fármacos generalmente bien tolerados, pero su uso en ancianos, especialmente en los frágiles o con pluripatología que toman muchos otros fármacos, requiere una evaluación cuidadosa que tenga en cuenta los síntomas musculares, las comorbilidades, el beneficio vital estimado y se recomienda un proceso de toma de decisiones compartidas entre médico y paciente. En caso de deterioro de la función renal o riesgo de interacciones farmacológicas, la dosis de estatinas debe titularse cuidadosamente6.
ConclusionesLas estrategias para un abordaje integral de las dislipidemias han cambiado radicalmente en los últimos años. La aparición de nuevos tratamientos hipolipemiantes nos permite conseguir con una mayor facilidad los objetivos de control lipídico que recomiendan las actuales guías de práctica clínica. Un correcto conocimiento de estas terapias y de los algoritmos de manejo en las diferentes situaciones clínicas que se encuentran en la práctica clínica diaria puede ayudar a implementar, mediante protocolos locales de actuación, medidas que permitan conseguir los objetivos pretendidos.
FinanciaciónSin financiación.
Declaración sobre el uso de inteligencia artificialNo se ha usado inteligencia artificial.
Contribución de los autoresD. Vivas y C. Escobar han contribuido de igual manera al manuscrito. Todos los autores cumplen con los siguientes requisitos: a) contribuyeron sustancialmente a la concepción y el diseño del artículo; b) redactaron el artículo o hicieron una revisión crítica de su contenido intelectual; c) dieron la aprobación final a la versión que se publicará, y d) accedieron a asumir responsabilidades sobre todos los aspectos del artículo y a investigar y resolver cualquier cuestión relacionada con la exactitud y veracidad de cualquier parte del trabajo.
Conflicto de interesesD. Vivas: honorarios por ponencias de Daiichi Sankyo, Amgen, Sanofi y Novartis; labores de consultoría para Daiichi Sankyo y Novartis. C. Escobar: honorarios por ponencias de Amgen, Almirall, Novartis, Sanofi, Daiichi-Sankyo y Viatris. A. Cordero: honorarios por ponencias de AstraZeneca, Amgen, Bristol-Myers Squibb, Ferrer, Boehringer Ingelheim, MSD, Daiichi Sankyo, Novartis, Novo Nordisk, Sanofi y Amarin; labores de consultoría para AstraZeneca, Ferrer, Sanofi, Amgen, Novartis, Lilly, Novo Nordisk y Amarin; pagos por testimonio de experto de Amgen, Daiichi-Sankyo y Novartis; apoyos para asistencia a reuniones o viajes de AstraZeneca, Amgen, Bristol-Myers Squibb, Ferrer, Boehringer Ingelheim, MSD, Daiichi-Sankyo, Novartis, Novo Nordisk, Sanofi y Amarin. R. Fernández-Olmo declara no tener conflictos de interés. A. Oterino: honorarios por ponencias de Daiichi Sankyo, Novartis, Amgen y Amarin. A. Blanco-Echevarría: honorarios por ponencias de Daiichi Sankyo, Amgen, Sanofi, Novo Nordisk y Novartis. M. Botana declara no tener conflictos de interés. D. Escribano: honorarios por ponencias de Daiichi Sankyo, Viatris, Servier, Almirall y Novartis. M.M. Freijo declara no tener conflictos de interés. P. Martínez-Losas: honorarios por ponencias de Daiichi Sankyo y Novartis. V. Pascual: honorarios por ponencias de Daiichi Sankyo, Amarin, Esteve, Ferrer, Servier y Viatris. B. Quiroga: honorarios por ponencias de Vifor Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Esteve, Sanofi-Genzyme, Otsuka; labores de consultoría para Vifor Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Esteve, Sanofi-Genzyme, Otsuka; apoyos para asistencia a reuniones o viajes de Vifor Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Esteve, Sanofi-Genzyme, Otsuka; participación en monitorización de eventos de seguridad o consejos asesores: Vifor Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Esteve, Sanofi-Genzyme, Otsuka. C. Sánchez-Peinador: declara no tener conflictos de interés. M. Torres-Fonseca: declara no tener conflictos de interés. R. Freixa-Pamias: honorarios por ponencias de Daiichi-Sankyo, Novartis, Sanofi, Amgen y Organon; consultoría para Daiichi-Sankyo y Novartis. V. Barrios: honorarios por ponencias de Amgen, Daiichi-Sankyo, Novartis, Sanofi y Viatris; consultoría para Amgen, Daiichi-Sankyo, Novartis y Viatris; apoyos para asistencia a reuniones y/o viajes de Amgen, Daiichi-Sankyo y Viatris. G. Barón-Esquivias: no declara conflictos de interés.