Este año ha estado marcado por la pandemia por coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2), que ha afectado nuestro modo de vida y de trabajo, además de focalizar una gran proporción de la publicación científica. Repasaremos las principales novedades en arritmias cardiacas y electrofisiología durante los últimos 12 meses, seleccionando en primer lugar los documentos de consenso más relevantes y las guías de práctica clínica de la Sociedad Europea de Cardiología y, posteriormente, aquellas publicaciones con mayor relevancia para el cardiólogo clínico.
This year has been marked by the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) breakthrough that has substantially changed the way we work and live, as well as focalizing a high percentage of the scientific publication. In this article we will review the main issues in the field of cardiac arrhythmias of the last 12 months, including consensus statements, the European Society of Cardiology guidelines, and the reports with the greatest relevance for the clinical cardiologist.
Durante los últimos 12 meses se han publicado varios documentos de consenso sobre arritmias de las principales asociaciones: la European Heart Rhythm Association (EHRA) y la Heart Rhythm Society (HRS).
Evaluación del riesgo en pacientes con arritmias cardiacasEl objetivo de este documento es ofrecer al cardiólogo clínico una herramienta para realizar una evaluación del riesgo, racional y basado en la evidencia, de diferentes cardiopatías y arritmias cardiacas. Destaca especialmente el valor de las diferentes pruebas diagnósticas para la estratificación del riesgo en las taquicardias ventriculares (TV)1.
Cómo evitar, diagnosticar y tratar las infecciones en dispositivos cardiacos implantablesLa infección de dispositivos implantables lleva asociado un incremento de la morbimortalidad, ingresos hospitalarios y un coste sanitario relevante, y se ha detectado una gran heterogeneidad en su manejo. Este documento está firmado también por la European Association for Cardio-Thoracic Surgery y ofrece unas recomendaciones de extraordinaria utilidad clínica2.
Ablación con catéter de taquicardias ventricularesEste documento complementa a las guías de práctica clínica más recientes sobre arritmias ventriculares. Se analizan pormenorizadamente las indicaciones de ablación desde el espectro de la extrasistolia ventricular hasta las taquicardias monomórficas y los desencadenantes de las TV polimórficas, así como aspectos más técnicos relacionados con la preparación y técnicas diagnósticas y terapéuticas en el laboratorio de electrofisiología3.
Tratamiento percutáneo del cierre de orejuelaEn este documento se analiza la organización de este procedimiento, especialmente con las unidades de imagen, se expone la evidencia de las indicaciones actuales y se añaden 2 situaciones clínicas nuevas: el paciente que tiene un ictus isquémico bajo anticoagulación y aquel tratado con aislamiento eléctrico de la orejuela durante un procedimiento de ablación de fibrilación auricular (FA)4.
Guías de la Sociedad Europea de Cardiología sobre fibrilación auricularLo más relevante de este documento5 es el tratamiento integrado de los pacientes con el esquema de actuación estructurado 4S, es decir, Stroke risk, Symptom severity, Severity of AF burden and Substrate severity, y el esquema de tratamiento abc, o anticoagulation, avoid stroke, better symptom control, and comorbidities/cardiovascular risk factors. En relación con la ablación de la FA, algunas situaciones clínicas han mejorado su nivel de recomendación:
- -
Pacientes con alta sospecha de miocardiopatía inducida por taquicardia para revertir la disfunción del ventrículo izquierdo, independientemente de los síntomas (clase I).
- -
Pacientes seleccionados con insuficiencia cardiaca (IC) y fracción de eyección del ventrículo izquierdo (FEVI) reducida para mejorar la supervivencia y reducir hospitalizaciones por IC (clase IIa).
- -
Pacientes con IC y función sistólica reducida con el objetivo de reducir síntomas, como tratamiento de primera elección, según decisión del paciente (clase I).
- -
Pacientes con bradicardia asociada, bien a la FA o bien a la pausa tras la conversión a ritmo sinusal, como alternativa al implante de marcapasos (clase IIa).
- -
Pacientes con FA, ante el fracaso del tratamiento con fármacos antiarrítmicos de tipo I o III asciende a clase I. En el caso de que el fracaso con el tratamiento farmacológico sea con bloqueadores beta se considera indicación de clase IIa.
- -
El aislamiento eléctrico de las venas pulmonares continúa siendo la piedra angular de la ablación con catéter y sube su recomendación a clase I, mientras que la ablación de otras dianas terapéuticas como áreas de bajo voltaje, rotores, potenciales fragmentados o líneas pasa a ser una recomendación clase IIb.
- -
La ablación concomitante del istmo cavotricuspídeo en pacientes con antecedentes de aleteo común y FA o aleteo de tipo IC baja de una recomendación IIa a IIb.
- -
La ablación de FA en pacientes de sexo femenino se debe indicar cuando sea preciso, de igual forma que en los varones. Hay evidencia de que la mayor tasa de complicaciones en la mujer está relacionada por la mayor prevalencia de factores de riesgo.
- -
La indicación de ablación de FA como primera opción terapéutica, por delante de los fármacos antiarrítmicos tiene una clase de recomendación IIa para las formas paroxísticas y IIb para las persistentes sin factores de riesgo mayores para recurrencia de FA.
- -
El sotalol pasa a ser una recomendación IIb en el tratamiento a largo plazo para la prevención de recurrencias de FA y se recomienda una monitorización estricta del intervalo QT si se inicia su uso ambulatoriamente.
- -
El uso de flecainida se debe acompañar de un bloqueante de nódulo auriculoventricular.
- -
Una aportación relevante de las guías es la invitación a que desaparezca el término lone atrial fibrillation (FA aislada o solitaria), ya que la FA casi siempre viene acompañada de factores asociados. Algunos de ellos son modificables, como la disfunción endotelial (enfermedad coronaria, hipertensión, diabetes, insuficiencia renal, tabaquismo, obesidad o inactividad física), inflamación (enfermedades agudas, enfermedades inflamatorias, sepsis), alteraciones del sistema nervioso autónomo (vagal o simpático como el estrés psicosocial, cafeína, alcohol o fármacos), estiramiento auricular, IC con función conservada, valvulopatías, enfermedad pulmonar obstructiva crónica, hipertiroidismo, exceso de actividad física y apnea del sueño, y otros no clasificables como la polución aire ambiental y la cirugía no cardiaca.
Por ello, estas guías se focalizan en los factores de riesgo y sustrato estructural concomitante de los pacientes con FA. Así, se considera que la identificación y el tratamiento de los factores de riesgo y enfermedades concomitantes debe formar parte del abordaje integral de pacientes con FA (clase I). La realización de actividad física y evitar el alcohol constituyen las principales actuaciones sobre el estilo de vida (clase IIa).
Publicaciones relevantesAnatomía cardiaca y bases morfológicas de las arritmias cardiacasLa descripción de ramificaciones de tejido especializado de conducción cardiaca, desde la rama derecha hasta la base del músculo papilar anterior, a través de la banda moderadora y hasta la cresta supraventricular e infundíbulo pulmonar constituye un hallazgo significativo para explicar la base morfológica de arritmias ventriculares, especialmente las originadas en el tracto de salida del ventrículo derecho. Esta localización abarca a un grupo de arritmias ventriculares, especialmente en el corazón sin cardiopatía estructural, como la TV idiopática del ventrículo derecho (la más frecuente dentro de las idiopáticas), el síndrome de Brugada, y se ha descrito como origen para disparadores que inician la fibrilación ventricular idiopática. Este artículo permite avanzar en el conocimiento de las bases de las arritmias ventriculares idiopáticas6.
Fibrilación auricularEl tratamiento integrado y estructurado de los pacientes con FA como una enfermedad crónica en la que se atiende el sustrato estructural tiene su mayor expresión en el análisis post hoc del estudio neerlandés que aleatorizó a más de 700 pacientes con FA de reciente diagnóstico a un tratamiento integral dirigido por enfermería y supervisado por un médico, o bien tratamiento estándar. Tras un seguimiento de 22 meses, se observó una reducción de la mortalidad total en el grupo del tratamiento integral de 3,7 vs. 8,1%; hazard ratio (HR) = 0,44; intervalo de confianza del 95% (IC95%), 0,23-0,85; p = 0,014, fundamentalmente por reducción de la mortalidad cardiovascular 1,1 vs. 3,9%; HR = 0,28; IC95%, 0,09-0,85; p = 0,0257. Además, se publica un estudio (AF-RISK)8 que analiza los factores determinantes de progresión de la FA en una cohorte de pacientes con FA de inicio reciente y seguidos durante un año. La tasa de progresión fue del 13%. A diferencia de la puntuación HATCH publicada en 2005, que analizó parámetros clínicos, en este estudio se identifican el volumen de la aurícula izquierda, la fracción aminoterminal del propéptido natriurético cerebral tipo B y el plasminogen activator-inhibitor 1(PAI-1), como los factores independientes de progresión8.
Cribado de FALa detección poblacional de la FA ha ganado mucho interés en el último año, basada en la evidencia aportada por las nuevas tecnologías. El estudio Apple Watch investigó si un algoritmo basado en la detección de pulso irregular permitía identificar FA. Entre los participantes que recibían una notificación, el 34% tenían FA en la tira del electrocardiograma y un 84% de las lecturas eran concordantes con FA verdadera9. El estudio Huawei Heart, utilizando una tecnología basada en fotopletismografía, permitió identificar FA con un valor predictivo positivo de 91,6%10.
Ablación con catéterSe han publicado los resultados del estudio CLOSE to CURE11, que analiza el efecto de la ablación sobre una población de FA paroxística de bajo riesgo a largo plazo (2 años), con un sistema de medida de la eficacia de las lesiones que incorpora potencia, fuerza de contacto y tiempo, y evalúa el resultado a través de la reducción de la carga arrítmica medida por un Holter insertable. Los pacientes redujeron su carga de 2,68 a 0% y la supervivencia libre de cualquier arritmia auricular fue del 87% al término del primer año y del 78% tras el segundo.
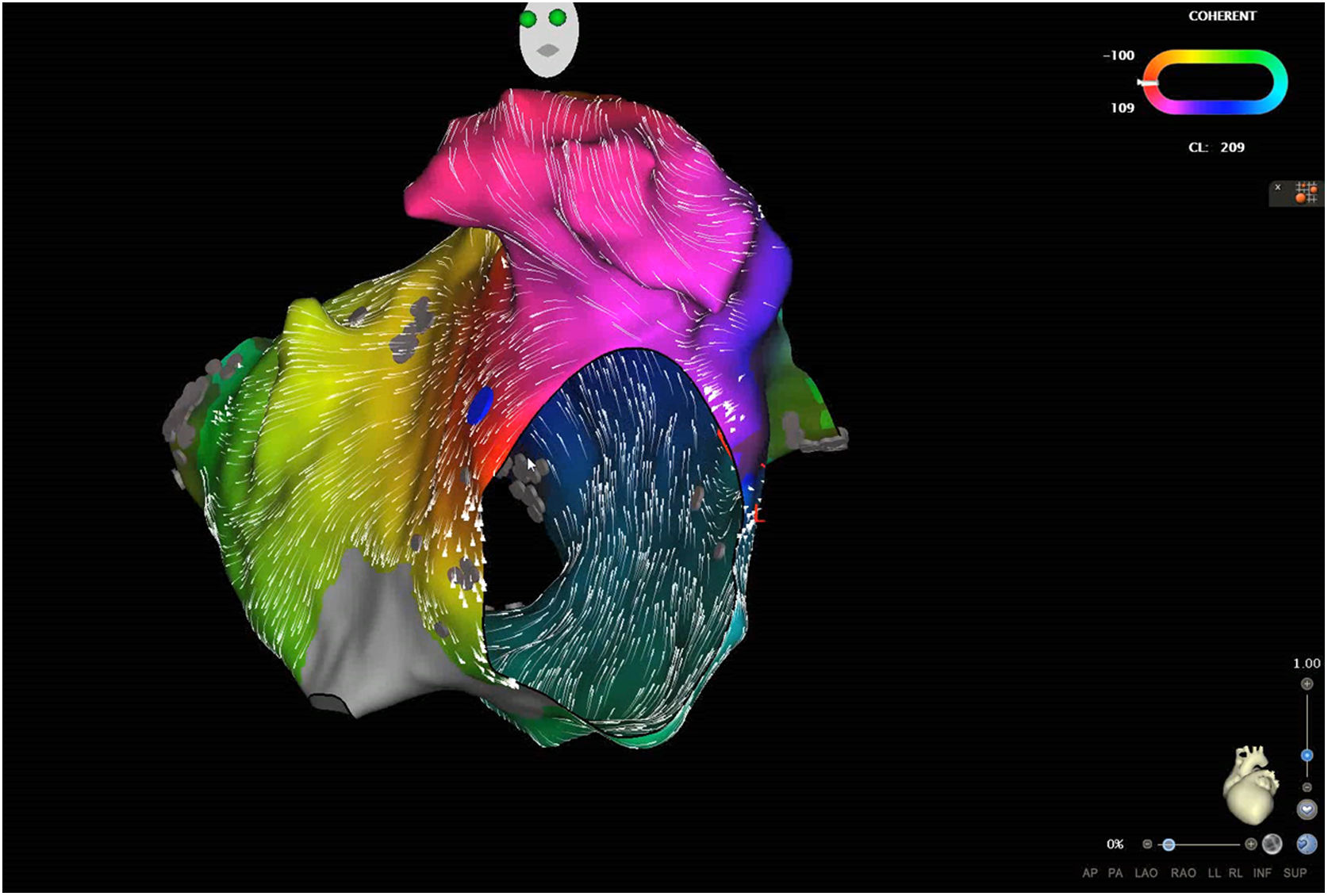
La técnica de ablación continúa mejorando, con sistemas de mapeo con catéteres de alta densidad que permiten estudiar más detalladamente las arritmias auriculares y programas específicos como el ripple map o COHERENT map (fig. 1), que permiten una identificación más precisa de sus mecanismos. El diseño de catéteres refrigerados con mayor número de sensores de temperatura en la punta en la interfase tisular permite conocer mejor la calidad de las lesiones, así como los nuevos balones de crioablación, que permiten reducir el tiempo de aplicación con la misma eficacia y con resultados clínicos semejantes a la radiofrecuencia. También hay que mencionar el empleo de alta potencia y corta duración de los pulsos de radiofrecuencia que en estudios preliminares ha demostrado su seguridad y probablemente permitirá acortar los procedimientos. Hay nuevas fuentes de energía, como la electroporación, que parece altamente efectiva y con baja tasa de complicaciones, y la radioterapia en el tratamiento de TV intratables está ganando mayor evidencia.
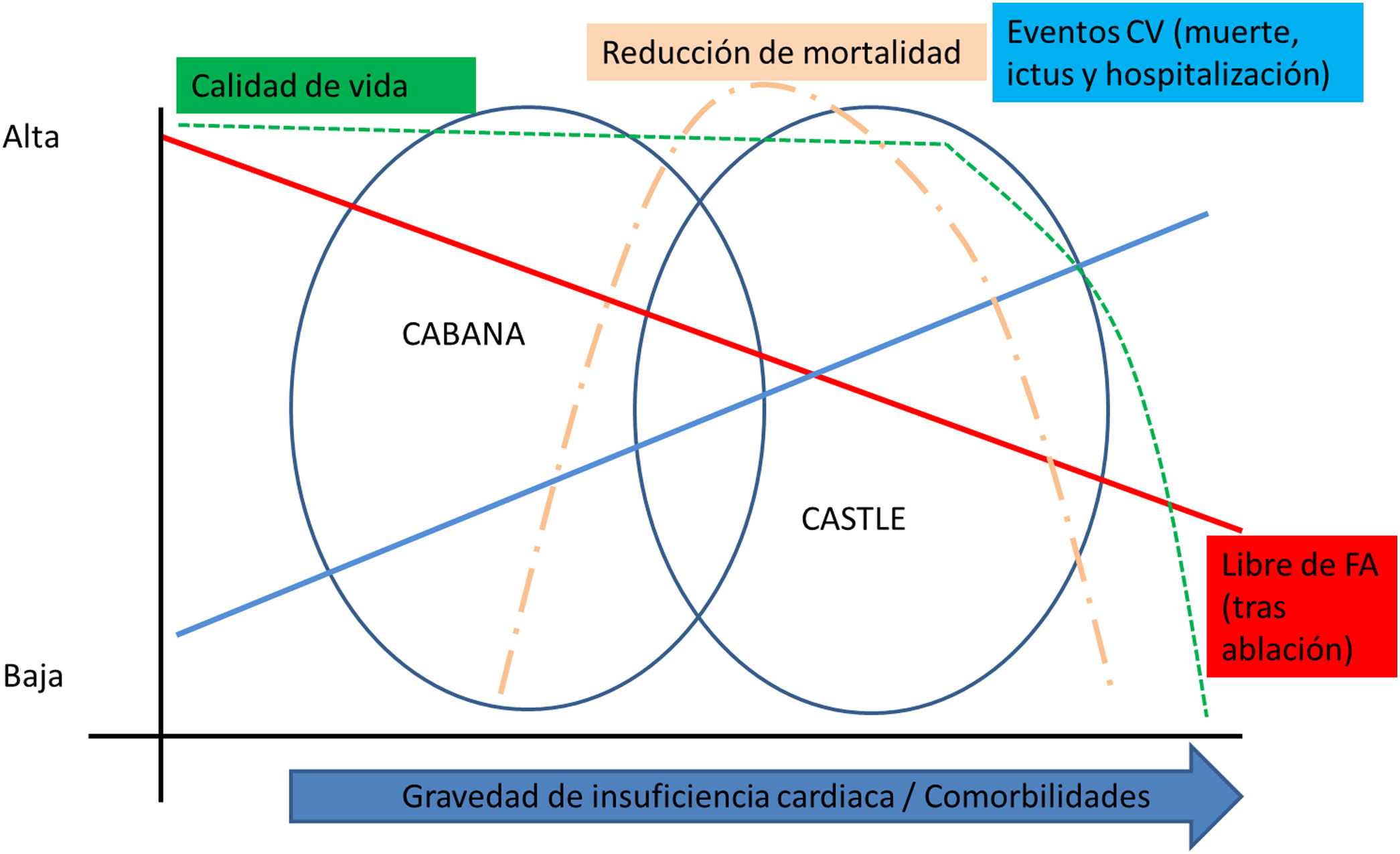
Tras el estudio CABANA12, en el que la ablación no demostró reducir la mortalidad total en el análisis por intención de tratar, se publica el registro nacional danés que recogió más de 25.000 pacientes a los que se les había realizado una primera cardioversión eléctrica entre 2003 y 2015. De ellos, se realizó ablación de FA a un 13,8%. Tras un seguimiento medio de 5 años y después de ajuste por múltiples variables, los pacientes tratados con ablación de la FA presentaron una reducción significativa en la mortalidad global (HR = 0,69), mortalidad cardiovascular (HR = 0,68) y en incidencia de IC (HR = 0,76) con respecto al grupo que no se trató con ablación. En este registro, se documenta una reducción de mortalidad y de IC en una población de FA persistente no seleccionada13.
Se han publicado también los datos de un registro administrativo estadounidense14 que clasificó a los pacientes con FA e IC tratados con ablación en función de los criterios de elegibilidad del estudio CASTLE15. El beneficio en la reducción de mortalidad y hospitalización por IC fue más moderado, con un HR = 0,82 en la cohorte elegible para CASTLE, pero no fue significativo en pacientes que presentaban algún criterio de exclusión. Este estudio es relevante porque refleja el beneficio en la vida real. En el estudio CASTLE, solo se incluyó el 10% de los pacientes inicialmente seleccionados (fig. 2).
Fibrilación auricular e ictusSe ha publicado un documento del grupo colaborativo internacional AF-SCREEN16 para homogeneizar la monitorización electrocardiográfica tras un ictus isquémico. Aproximadamente un 25% de los pacientes con un ictus isquémico desarrollan posteriormente FA, lo que puede ser una relación causal, un bystander, o bien inducida neurológicamente. Se considera que todo ictus isquémico debe monitorizarse durante 72 h, que prolongarán más si coexisten factores de alto riesgo de desarrollo de FA, como edad > 75 años, factores de riesgo cardiovascular (especialmente hipertensión arterial e IC), signos de miopatía atrial (diámetro de aurícula izquierda > 4,6 cm, ectopia supraventricular ≥ 480/24 h y ráfagas de taquicardia auricular > 20 latidos), biomarcadores (fracción aminoterminal del propéptido natriurético cerebral tipo B > 400 pg/ml) y determinadas etiologías del ictus como el ictus de origen desconocido o el de origen cardiaco diferente a FA16.
Un aspecto controvertido es si la ablación de la FA reduce la incidencia de ictus. Hay registros con resultados contradictorios13,17,18. El registro de FA chino incluyó a más de 4.500 pacientes tratados con ablación de FA entre 2011 y 2017, de los cuales, 3.149 suspendieron la anticoagulación oral (ACO) al cabo de 3 meses de la ablación (CHA2DS2VASc 2,3 frente a 2,7 en los que no se suspendió). Al cabo de 24 meses, la tasa de ictus fue de 0,54 por 100 pacientes-año entre los que no tomaban ACO y 0,56 por 100 pacientes-año entre los que sí tomaban ACO. En el análisis multivariante, el antecedente de ictus previo y la presencia de diabetes fueron factores independientes asociados a tromboembolia, pero la interrupción de la ACO no fue un factor asociado19. Las guías de práctica clínica vigentes recomiendan la ACO a largo plazo, según los factores de riesgo, y no contemplan la interrupción tras una ablación de FA con éxito.
Una de las publicaciones más relevantes respecto al riesgo de ictus en pacientes con FA es la que describe la interacción de la duración de FA y la puntuación CHA2DS2VASc en la valoración de la incidencia de ictus, que pone de manifiesto la importancia de la carga de FA, no solo en los síntomas, sino también en la valoración del riesgo de tromboembolia. En una base administrativa de más de 21.000 pacientes no anticoagulados, portadores de un dispositivo cardiaco implantable y en seguimiento remoto, se observó que el aumento en la duración de FA se asoció con un aumento en el riesgo de tromboembolia y se observó una interacción con el grado de la puntuación CHA2DS2VASc. Los pacientes con CHA2DS2VASc = 0 tenían una tasa de ictus baja, pero alcanzaba el 0,86% si la duración máxima diaria de FA era > 23,5 h; en el otro extremo, y más importante, para CHA2DS2VASc ≥ 5, en ausencia de FA, la tasa de tromboembolia era de 1,79%20.
Fibrilación auricular y factores de riesgoLa relación del alcohol con la FA es conocida, si bien el efecto de la abstinencia sobre la recurrencia de FA no está demostrado. En un estudio aleatorizado de 140 pacientes con FA e ingesta excesiva de alcohol, la reducción de la ingesta se asoció con una menor recurrencia de FA a los 6 meses, mayor tiempo hasta la recurrencia y menor carga de FA durante el seguimiento21.
El estudio RESPIRE evaluó la incidencia de apnea grave del sueño en una cohorte no seleccionada de pacientes portadores de marcapasos. Un tercio de los pacientes tenía apnea del sueño, y de ellos, el 25% FA. La búsqueda activa de factores de riesgo resulta imprescindible en el enfoque 4S de la FA22.
Por último, en relación con la FA, en el Congreso ESC 2020 se presentó el estudio EAST-AFNET 4, que analiza si el control de ritmo precoz en pacientes con FA de reciente comienzo es mejor que el tratamiento estándar en relación con un objetivo combinado de muerte cardiovascular, ictus, empeoramiento de IC o síndrome coronario agudo al cabo de 2 años de seguimiento. La tasa fue de 3,9% año en el grupo precoz y 5% año en el grupo estándar (HR = 0,79; IC95%, 0,66-0,94; p < 0,005), con reducciones significativas en mortalidad cardiovascular e ictus y sin diferencias en la hospitalización por IC o síndrome coronario agudo23.
Taquicardias ventricularesUno de los retos en pacientes con extrasistolia ventricular (EV) es identificar aquellos factores que predicen mal pronóstico en forma de disfunción sistólica del ventrículo izquierdo, o bien hospitalización por IC. Se publica una puntuación simple, la puntuación de riesgo ABC-VT, que identifica los siguientes factores de remodelado inverso del ventrículo izquierdo: eje superior de la EV (odds ratio [OR] = 2,7; un punto), carga de EV 10-20% (OR = 3,5; 2 puntos), carga EV > 20% (OR = 4,4; 3 puntos), intervalo de acoplamiento > 500 ms (OR = 4,7; 4 puntos) y TV no sostenida (OR = 5,3; 5 puntos)24. Esta puntuación se añade a la utilidad de la resonancia cardiaca en la identificación y cuantificación de la cicatriz y en el estudio electrofisiológico de inducibilidad de arritmias ventriculares (HR = 1,4) en la predicción de TV sostenidas en el seguimiento de pacientes con EV sin cardiopatía estructural25. Se publica también un algoritmo terapéutico simple para el tratamiento de la EV según 3 factores (síntomas, FEVI y carga arrítmica)26.
Una de las publicaciones más disruptivas es el documento de la HRS sobre evaluación, estratificación de riesgo y tratamiento de la miocardiopatía arritmogénica. Define miocardiopatía arritmogénica como un trastorno arritmogénico que afecta al músculo cardiaco y no secundario a isquemia, hipertensión o valvulopatía, y engloba enfermedades sistémicas como amiloidosis, sarcoidosis, miocarditis y enfermedad de Chagas y un gran número de miocardiopatías hereditarias. En la estratificación de riesgo, además de factores clínicos y FEVI, se tienen en cuenta mutaciones en genes como la filamina-C, lamina y fosfolambán27.
En relación con la ablación de TV, se publicó el estudio BERLIN TV, que aleatorizó pacientes con infarto previo, FEVI entre 30 y 50% y una TV sintomática que requirió implante de un desfibrilador, a una estrategia de ablación preventiva (tras el primer episodio y antes del implante del desfibrilador) o diferida (tras 3 episodios de choque por desfibrilador). No hubo diferencias significativas entre ambas estrategias en el objetivo principal (mortalidad global o ingreso por TV o IC) al cabo de un año de seguimiento, si bien en la estrategia preventiva hubo menos TV sostenida y terapias apropiadas28.
Respecto a los fármacos antiarrítmicos y riesgo arrítmico, destaca la evaluación del tratamiento con hidroxicloroquina, azitromicina, o ambas, en una población con enfermedad coronavírica de 2019 (COVID-19). Se definió una prolongación del intervalo QT corregido (QTc) crítica, aquella que alcanzaba un QTc máximo > 500 ms o un ΔQTc > 60 ms. Se observó en el 12% de la población tratada y esta prolongación fue mayor en la combinación de los fármacos que en ellos por separado, pero no se registró torsade de pointes29. Hay que destacar la duración limitada de estos tratamientos, que contrasta con la duración a largo plazo del tratamiento con hidroxicloroquina en las enfermedades reumatológicas.
DesfibriladoresUno de los estudios más relevantes en el campo de los desfibriladores es el estudio PRAETORIAN, que comparó el desfibrilador subcutáneo y el transvenoso en pacientes sin indicación para estimulación. No se observaron diferencias en la variable combinada de complicaciones relacionadas con el dispositivo y choques inapropiados entre ambos dispositivos30.
Finalmente, destacamos la comunicación de los resultados del estudio SAVE-ICD en el Congreso EHRA de 2020. Estudio de una cohorte de pacientes con FEVI < 35% e indicación del desfibrilador automático implantable en prevención primaria y el efecto de tratamiento con sacubitrilo-valsartán durante 6 meses. El incremento de la FEVI fue de 3,9 de media y se evitaría, teóricamente, el implante de desfibrilador en uno de cada 4 pacientes. La mayor limitación de este estudio es la ausencia de grupo control31.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.