En este artículo se resume la evidencia científica más relevante sobre estimulación cardiaca publicada en el último año, centrada en 2 temas que, por sus aportaciones, requieren atención especial: marcapasos sin cables y estimulación del sistema de conducción. Respecto a la estimulación sin cables, se revisa la información más reciente sobre seguridad y eficacia del dispositivo actual pero, sobre todo, se desarrollan los resultados de los estudios que analizan la posibilidad de mantener la sincronía auriculoventricular utilizando el acelerómetro de este marcapasos monocameral. En cuanto a la estimulación del sistema de conducción, se describen nuevos conocimientos sobre la utilidad de la estimulación hisiana y de la rama izquierda como técnicas alternativas o complementarias a la terapia de resincronización cardiaca convencional. También se reseñan datos recientes sobre aspectos anatómico- radiológicos de la región hisiana que, con toda seguridad, facilitarán este tipo de implantes.
This manuscript summarizes the most relevant scientific evidence published during the last year regarding cardiac pacing. Two particular topics are considered of utmost interest: leadless pacing and conduction system pacing. The most recent evidence about safety and efficacy of leadless pacing will be reviewed with a special focus in the possibility of maintenance of AV synchrony using the accelerometer of this single chamber pacemaker. With respect to conduction system pacing, the principal novelties in terms of the potential role of His bundle pacing and left bundle branch pacing as alternatives for conventional cardiac resynchronization therapy will be discussed as well as the recent description of critical anatomical and radiological information about the His bundle area which can help during the implant.
Son muchos los temas que se podrían incluir en este artículo de resumen sobre lo más destacado en estimulación cardiaca publicado en el último año, pero, por su relevancia, centraremos nuestra atención en 2 de ellos: la posibilidad de mantener la sincronía auriculoventricular (AV) con un marcapasos monocameral sin cables y la utilidad de la estimulación del sistema de conducción en el tratamiento de la insuficiencia cardiaca.
Sincronía auriculoventricular sin cablesLa estimulación sin cables ha intentado posicionarse como una alternativa a la estimulación transvenosa desde su comercialización. Hasta ahora una de sus mayores limitaciones era, sin duda, la imposibilidad de mantener la sincronía AV puesto que la única forma disponible de estimulación solo permitía detectar y estimular en ventrículo derecho (en modo VVI). A este respecto ha habido progresos relevantes en 2020 que por su novedad1, implementación reciente en la práctica clínica2 y previsión de futuro merecen un trato específico.
No obstante, para contextualizar la importancia de estos avances, hemos de conocer también la información más reciente sobre los motivos que han propiciado la creación de la estimulación sin cables, sus resultados con los dispositivos iniciales, monocamerales, así como la necesidad clínica del mantenimiento de la sincronía AV durante la estimulación cardiaca.
Estimulación sin cables en 2020: lo que sabemosLa tasa de complicaciones relacionadas con el implante de dispositivos de estimulación transvenosos se estima ente 4 y 12,5%3,4. Estas complicaciones incluyen problemas traumáticos (neumotórax, derrame pericárdico, taponamiento cardiaco); relacionados con la bolsa subcutánea del generador (hematomas, infecciones), con el electrodo (desplazamiento, fractura, endocarditis, obstrucción venosa) o con el funcionamiento del sistema, como mal funcionamiento del dispositivo en sí (alerta sanitaria) o por una programación inadecuada.
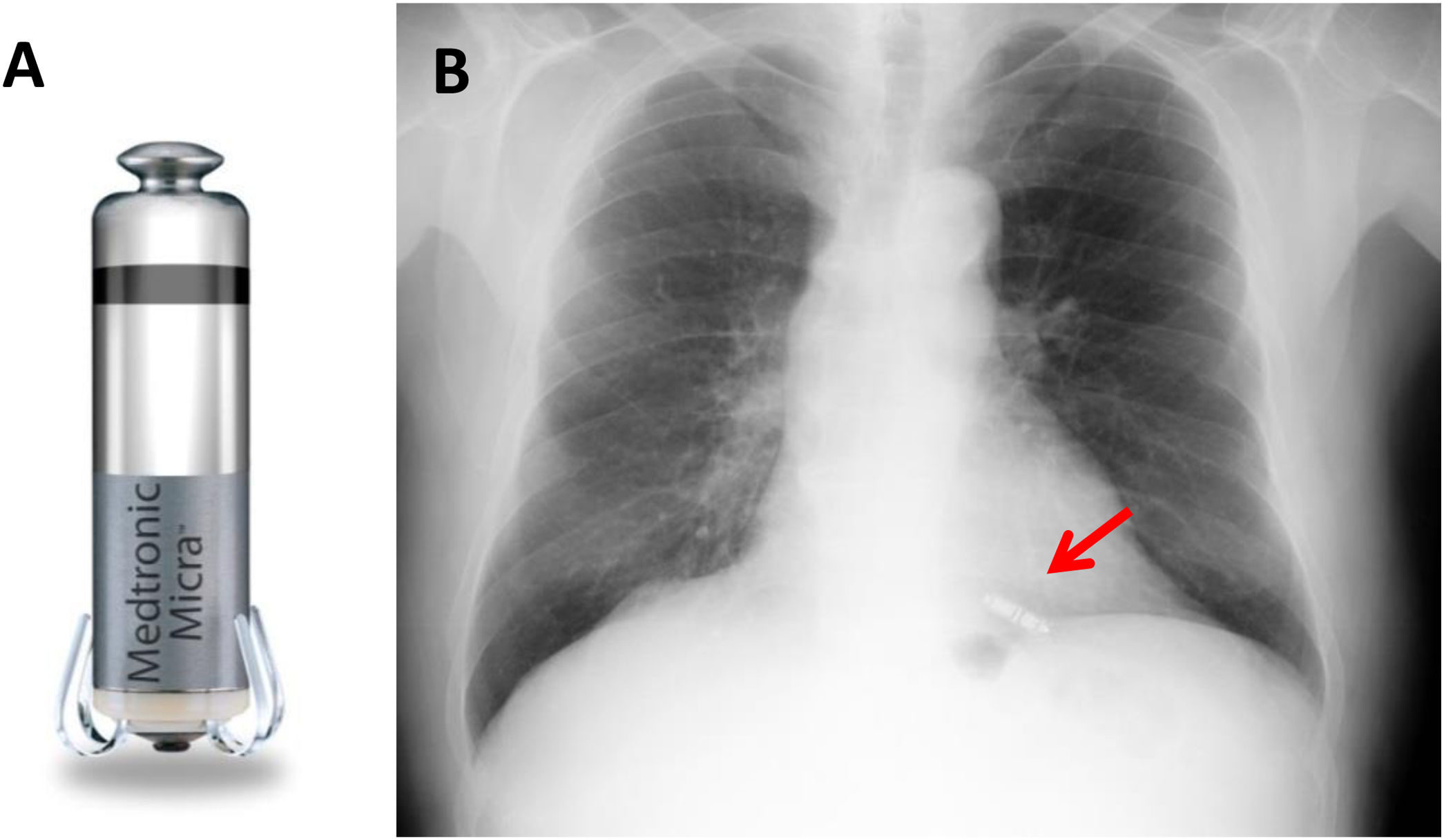
La estimulación sin cables surge con objeto de reducir las complicaciones relacionadas con el bolsillo del generador y con el electrodo de los marcapasos transvenosos. Inicialmente se comercializaron 2 dispositivos Micra (Medtronic, Estados Unidos) y Nanostim (St Jude, Estados Unidos), ambos monocamerales, con los que se realizaron estudios con unos resultados publicados muy favorables5,6; finalmente Nanostim se retiró por problemas relacionados con la batería, de forma que hoy en día se implanta únicamente el sistema Micra TPS (transcatheter pacing system) (fig. 1).
Con este dispositivo, El-Chami et al.7 comunican los resultados de rendimiento de Micra en el mundo real, comparándolo con los datos del registro inicial, y con un control histórico de marcapasos bicamerales transvenosos. Informan que el dispositivo se implantó con éxito en el 99% de los casos, con umbrales de estimulación bajos y estables en el momento del implante (0,6 V a 0,24 ms) y a lo largo de un seguimiento medio de 6,8 meses (< 2 V). Con respecto a la seguridad en el implante, con Micra encuentran una incidencia baja de complicaciones mayores (2,7%) y claramente inferior a la del grupo de marcapasos bicamerales transvenosos (7,6%) que utilizaron como control. Además, observan una reducción > 50% en la incidencia de derrame pericárdico durante el procedimiento con respecto a los datos del estudio de validación inicial de Micra6. Ante estos datos, los autores consideran que la estimulación sin cables con este sistema es segura y que reduciría las complicaciones relacionadas con el bolsillo y electrodo de los marcapasos transvenosos. No obstante, ponen de manifiesto la necesidad de un estudio aleatorizado para definir claramente los beneficios de la estimulación sin cables monocameral frente a la convencional.
En un estudio prospectivo no aleatorizado unicéntrico, se han publicado recientemente datos similares respecto a seguridad y eficacia en pacientes nonagenarios8. El Amrani et al. evalúan la eficacia y seguridad de Micra en mayores de 70 años con indicación de marcapasos monocameral, e incluyen a 129 pacientes; el 31,8% de ellos superaba los 90 años y los restantes tenían una media de edad de 84 años. El implante fue bien tolerado y se realizó con éxito en el 97,6% de los nonagenarios y en los demás en un 98,9%. Los parámetros de estimulación fueron adecuados en ambos grupos, mayoritariamente inferiores a 1 voltio a 0,24 ms, tanto en el implante como durante el seguimiento. Se contabilizó un 2,3% de complicaciones mayores relacionadas con el implante, todas ellas en el grupo de menos de 90 años. No se observaron dislocaciones, infecciones ni muertes relacionadas con Micra.
Vistos los buenos resultados en cuanto a seguridad y eficacia, y a falta de un estudio aleatorizado que los corrobore9, hay que recordar que actualmente la estimulación sin cables solo permite una estimulación monocameral (en modo VVI). Por este motivo, del total de los pacientes que precisen estimulación antibradicardia, solo aproximadamente un 14%, serían candidatos a este modo de estimulación y, por tanto, al implante de este tipo de dispositivo10. Esto es así por la importancia de mantener la sincronía AV para reducir la morbilidad e incluso en algunos casos, la mortalidad de los pacientes subsidiarios de un marcapasos como terapia antibradicardia11,12.
Sincronía AV con marcapasos sin cables monocameralMicra, además de permitir una estimulación en modo VVI, dispone de un acelerómetro que cuando se activa, genera una respuesta en frecuencia. Basándose en su funcionamiento específico, que utiliza los 3 ejes espaciales, los ingenieros crearon un programa que permite al dispositivo la detección mecánica de la contracción auricular y sincroniza con ella la estimulación ventricular, cuando el paciente está en ritmo sinusal1,10. El marcapasos identifica 4 señales mecánicas durante el ciclo cardiaco (fig. 2): A1 y A2 que corresponden al cierre de las válvulas mitral y tricúspide o pulmonar y aórtica, respectivamente; A3 que señala la detección del llenado pasivo ventricular y A4, la sístole auricular. La señal A3 es la última que el dispositivo identifica como relacionada con el ventrículo y la clasifica como VE (ventricular end marker) en su canal de marcas. A continuación detectaría la contracción auricular, que señala como AM (atrial mechanical marker) y a partir de ella con un intervalo programable, el dispositivo estimularía el ventrículo, la espiga estimulada se identifica como VP (ventricular pacing). Todo esto ocurrirá si en el rango de frecuencia programada no se detecta actividad intrínseca ventricular. Se consigue así una estimulación en modo VDD con un marcapasos monocameral.
Funcionamiento de acelerómetro de Micra para mantener la sincronía AV. Se observan las señales del electrocardiograma y canal de marcas, la detectada por el acelerómetro y la utilizada por el acelerómetro (acelerómetro rectificado) para la detección de la contracción auricular (similar a un electrocardiograma intracavitario). A1) Inicio de sístole ventricular (cierre de válvulas mitral y tricúspide). A2) Fin de sístole ventricular (cierre de válvulas aórtica y pulmonar). A3) Llenado pasivo ventricular (onda E en eco-Doppler). A4) Sístole auricular (onda A en eco-Doppler).
AM (atrial mechanical marker): Marcador que indica al dispositivo que ha detectado la contracción mecánica auricular (A4). ECG: electrocardiograma; VE (ventricular end marker): fin de las señales relacionadas con el ventrículo (A1-A3); VP (ventricular pacing): estimulación ventricular.
La viabilidad y funcionamiento de este algoritmo se evaluó inicialmente en los estudios MASS (Micra Accelerometer Sensor Subestudy), MASS2 y MARVEL (Mitral Atrial Tracking Using A Ventricular Accelerometer), y se ha publicado recientemente10. En los 3 estudios se implementaba temporalmente el software específico en pacientes ya portadores de marcapasos sin cables. Los resultados de MASS y MASS 2 permitieron confirmar la capacidad de detección de la contracción auricular con el acelerómetro. Posteriormente, el estudio MARVEL evaluó de forma prospectiva, multicéntrica y no aleatorizada la capacidad del algoritmo para mantener la sincronía AV en 65 pacientes en ritmo sinusal y portadores de Micra por bloqueo AV. Los resultados obtenidos mostraron que, durante la activación del algoritmo, se conseguía un 87% de sincronía AV. En el caso de que los pacientes tuvieran ritmo intrínseco, la sincronía en reposo fue de 94% y si tenían bloqueo AV avanzado, de 80%. En estos últimos se observó además que la sincronía era significativamente superior con el algoritmo activado frente a la programación en modo VVI (37,5%). Durante el tiempo que el algoritmo permanecía activado, no se notificaron eventos adversos como pausas o taquicardia mediada por marcapasos. Ante estos hallazgos, se concluyó que la detección auricular con el acelerómetro de Micra era viable y, en reposo, capaz de mejorar la sincronía AV, cuando se activa de forma temporal una aplicación en fase de perfeccionamiento en pacientes ya portadores de un marcapasos sin cables.
Con lo aprendido en el estudio MARVEL, este software evolucionó hacia su optimización, sobre todo en cuanto a programación automatizada y perfeccionamiento de los algoritmos de cambio de modo, para adaptarse mejor a los cambios de ritmo y actividades del paciente, por lo que se puso en marcha un nuevo estudio, el MARVEL 2, cuyos resultados se han publicado recientemente1. Se incluyó a 75 pacientes con Micra en los que también se descargaba el programa temporalmente, permitiendo su programación en VDD durante la activación del algoritmo. En los casos en los que el ritmo predominante era un bloqueo AV avanzado con función sinusal normal (52%), se evaluó la eficacia del algoritmo para conseguir una sincronía AV > 70%, y se observó que, en reposo, este objetivo se conseguía en un 95% cuando el modo VDD estaba activado frente a un 0% si el modo programado era VVI. Además, se constató un 84,8% de sincronía AV en cualquier posición o durante actividad en VDD, mientras que en VVI fue del 26,8%, y se observó que la sincronía AV era excelente en reposo, > 70% en sedestación y bipedestación, y peor a frecuencias sinusales elevadas por la superposición de las señales mecánicas que detectaba el dispositivo.
Como en el estudio previo, en ninguno de los 75 pacientes se detectaron pausas o episodios de taquicardia mediada por marcapasos durante la activación del algoritmo.
En las reflexiones finales de la publicación, los autores hacen hincapié sobre la gran utilidad del algoritmo para mantener la sincronía AV si se compara con la programación en VVI. Sin embargo, consideran que estos hallazgos deberían confirmarse en un estudio aleatorizado con un tamaño muestral más amplio y con la programación VDD de forma continuada. Para conseguir este último punto, señalan como limitación básica en el momento de la inscripción, el elevado consumo de corriente de drenaje que con la descarga temporal del programa en modo VDD tenían los dispositivos del estudio, por lo que recomiendan su implementación durante la fabricación de un nuevo marcapasos sin cables.
Ya se ha comercializado un dispositivo con estas características, el Micra AV, que ya se ha implantado con éxito recientemente2. En las figuras de este artículo de Martínez-Sande et al., se ilustra el funcionamiento agudo del dispositivo y se señala la utilidad del mismo en pacientes con elevado riesgo de complicaciones asociadas con un implante transvenoso, con función sinusal conservada y que no requieran sincronización AV a frecuencias sinusales elevadas.
Por tanto, en 2020 la estimulación sin cables supone una alternativa segura y eficaz en pacientes con necesidad de estimulación antibradicardia que hayan presentado complicaciones relacionadas con la bolsa o el electrodo con un marcapasos transvenoso o tengan alto riesgo de sufrirlas y sean subsidiarios de estimulación monocameral. La comercialización del Micra AV proporciona un avance más en el desarrollo de esta tecnología, que amplía su escenario de aplicación. Esperamos que, en un futuro no muy lejano, se confirmen sus beneficios con estudios específicos y continúe evolucionando hasta permitirnos disponer de las mismas posibilidades que con la estimulación transvenosa, e incluso conseguir su sincronización con el desfibrilador subcutáneo.
Estimulación del sistema de conducciónEn los últimos años se ha renovado el interés por la estimulación del sistema de conducción. A la estimulación hisiana (EH) se le ha unido más recientemente una nueva técnica, la estimulación de la rama izquierda (ERI). Ambas han demostrado su viabilidad y seguridad, al menos a corto y medio plazo, en diversas situaciones como la enfermedad del nódulo sinusal o los trastornos en la conducción auriculoventricular. Aunque ambas técnicas son complementarias, es cierto que varios estudios muestran que la ERI muestra en general mejores parámetros eléctricos (umbral de estimulación y detección) que la EH tanto de forma aguda como en el seguimiento. El interés y la información científica generados en torno a estas nuevas modalidades de estimulación son muy elevados, por lo que trataremos de resumir a continuación las novedades más relevantes al respecto aparecidas durante 2020.
Uno de los aspectos más interesantes es el posible papel de la estimulación del sistema de conducción como alternativa o complemento a la estimulación biventricular con el objetivo de obtener una terapia de resincronización cardiaca (TRC). El grupo del Hospital Juan Ramón Jiménez de Huelva, pionero en la utilización de la EH como TRC, ha publicado recientemente una serie de 48 pacientes con indicación convencional de TRC (fracción de eyección del ventrículo izquierdo [FEVI] < 35%, bloqueo de rama izquierda del haz de His [BCRIHH] con duración del complejo QRS > 130 ms) en los que se intentó realizar EH13. Mediante la EH fueron capaces de conseguir la resincronización cardiaca en el 75% de los casos (36 de 48 pacientes). En los 12 pacientes restantes se realizó una TRC convencional mediante el implante de un cable de estimulación en el seno coronario (en 3 de ellos se conseguía corregir el BRIHH mediante EH pero no se pudo fijar el cable de forma estable y en los 9 restantes no se conseguía corregir el BCRIHH). Destaca que la mediana de la FEVI aumentó desde un 30% en la evaluación basal antes del implante hasta el 51% tras un mes de seguimiento y que la mitad de los pacientes experimentaron un incremento de la FEVI > 20%.
La ERI también se ha incorporado más recientemente como una nueva alternativa a la estimulación biventricular clásica y a la EH para conseguir la TRC. Wu et al.14 han realizado un estudio observacional en el que comparan estas 3 modalidades de TRC en pacientes con FEVI ≤ 40% y BCRIHH típico. Incluyeron a 137 pacientes (49 con EH, 32 con ERI y 54 con estimulación biventricular). Las 2 modalidades de estimulación del sistema de conducción mostraron una reducción significativa de la anchura del QRS estimulado respecto a la estimulación biventricular (100,7 ± 15,3 ms, 110,8 ± 11,1 ms y 135,4 ± 20,2 ms, respectivamente). El hallazgo más destacable es que tanto la EH como la ERI mostraron un incremento de la FEVI significativamente mayor en comparación con la estimulación biventricular a un año de seguimiento (+ 23,9, + 24 y + 16,7% para EH, ERI y estimulación biventricular, respectivamente) con unos porcentajes de pacientes que normalizaban la FEVI al año de seguimiento del 74,4, 70 y 44,9%, respectivamente. La mejoría en la clase funcional de la New York Heart Association (NYHA) fue también significativamente mayor con la EH y la ERI en comparación con la estimulación biventricular. La comparación directa entre la EH y la ERI muestra que ambas son completamente equiparables en cuanto a la mejoría obtenida en la FEVI y en la clase funcional, aunque la ERI mostró mejores umbrales de estimulación y mejores parámetros de detección de la onda R que la EH.
En otro estudio observacional multicéntrico se ha evaluado también la ERI como TRC en 63 pacientes con miocardiopatía dilatada no isquémica y BCRIHH15. La tasa de éxito del implante, definida como la capacidad para corregir el BCRIHH mediante la ERI, fue del 97% (61 de 63 pacientes) y se obtuvo una reducción significativa del QRS (de 169 ± 16 ms basalmente a 118 ± 12 ms, p < 0,001). Con un año de seguimiento, la FEVI mejoró significativamente de una media de 33 ± 8% a un 55 ± 10%, p < 0,001, y se obtuvo también una reducción significativa del volumen telesistólico del ventrículo izquierdo, así como una mejoría de la clase funcional de la NYHA, que pasó de 2,8 ± 0,6 basalmente a un 1,4 ± 0,6 al año de seguimiento. Cabe destacar que hasta el 75% de los pacientes normalizaron su FEVI al año de seguimiento (FEVI ≥ 50%).
Por último, durante el 2020 se han realizado avances muy importantes en el conocimiento de la anatomía del sistema de conducción aplicables a las nuevas técnicas de estimulación. Cabrera et al. han descrito con detalle la anatomía del sistema de conducción, así como sus relaciones con las estructuras tanto auriculares como ventriculares del hemicardio derecho16. Para ello han utilizado 41 corazones normales obtenidos de donantes, adecuadamente diseccionados para delimitar la localización y el curso del sistema de conducción AV. Al mismo tiempo, y con el objetivo de correlacionar los hallazgos anatómicos e histológicos con las imágenes fluoroscópicas obtenidas en el laboratorio de electrofisiología durante el implante de cables de estimulación en el sistema de conducción, se realizó una angiografía auricular en 60 pacientes sin cardiopatía estructural utilizando un catéter de referencia situado en la región hisiana (en el lugar en el que se obtenía la mayor deflexión hisiana), pudiendo delimitar de esta manera el triángulo de Koch. Entre los resultados obtenidos destaca que la mayor deflexión hisiana no siempre se corresponde con el vértice del triángulo de Koch (sí lo hace en el 61,7% de los casos) y que existen variaciones importantes en cuanto a la localización del nódulo compacto dentro del triángulo de Koch y al lugar de transición entre el nodo AV y el haz de His. La penetración en el cuerpo fibroso central ocurría con una localización superior respecto al triángulo de Koch en el 58,5% de los corazones estudiados, mientras que era inferior en el 41,5% restante. El lugar de penetración respecto a las cavidades cardiacas derechas también variaba, y ocurría en la porción auricular del triángulo en el 53,7% de los casos, en la zona de la valva septal de la válvula tricúspide en el 31,7% y en la porción ventricular del septo membranoso en el 14,6% restante. Por último, también se encontraron diferencias importantes en cuanto a la longitud del septo membranoso, y en el 58,5% de los especímenes analizados no se pudo identificar un componente interventricular del mismo. Estos hallazgos anatómicos son relevantes a la hora de conseguir la estimulación de los distintos componentes del sistema de conducción, así como para explicar las dificultades que podemos encontrar durante el implante.
Como vemos, la información referente a la estimulación del sistema de conducción continúa creciendo y muestra su seguridad y viabilidad situaciones más complejas, como la TRC. Aunque se trata de hallazgos prometedores, prácticamente la totalidad de los datos disponibles proviene de estudios observacionales con un bajo número de pacientes incluidos y con seguimientos a corto y a medio plazo. Se necesitan ensayos clínicos aleatorizados que permitan corroborar estos hallazgos iniciales y que comparen las distintas modalidades de estimulación del sistema de conducción respecto a la estimulación biventricular convencional. De este modo se podrá establecer de forma adecuada si la estimulación del sistema de conducción (EH o ERI) supone un complemento o una verdadera alternativa a la estimulación biventricular convencional para la TRC. El conocimiento preciso de la anatomía del sistema de conducción resulta crucial en todo este proceso.
Conflicto de interesesÓscar Cano Pérez ha recibido honorarios de consultoría de Medtronic. El resto de los autores declara no tener ningún conflicto de intereses.