La miocarditis es una complicación cardiovascular importante de la COVID-19, enfermedad producida por el coronavirus de tipo 2 (SARS-CoV-2), causante del síndrome respiratorio agudo grave. Se ha observado que los pacientes hospitalizados y con enfermedades cardiacas preexistentes presentan mayor riesgo en el desarrollo de esta complicación. Presenta un predominio en los pacientes de sexo masculino, de los que los más afectados corresponden a las poblaciones adulta mayor de 50 años y pediátrica. Sin embargo, no se conocen por completo su incidencia y prevalencia. Esta enfermedad se origina por lesiones directas e indirectas provocadas por la infección del SARS-CoV-2 al miocardiocito y a otras células. Las manifestaciones clínicas varían desde leves, como la fatiga y la disnea, hasta graves, como el shock cardiogénico. Las pruebas para la detección de esta enfermedad son de laboratorio, de imágenes e histológicas. En este artículo realizamos una breve revisión de la miocarditis por SARS-CoV-2 en la epidemiología, fisiopatología, clínica, diagnóstico y tratamiento, así como de la miocarditis por vacunación.
Myocarditis is an important cardiovascular complication of COVID-19, a disease caused by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). It has been observed that hospitalized patients with pre-existing cardiac disease are at higher risk for the development of this complication. It is predominantly male, with the most affected population being adults over 50 years of age and pediatrics; however, its incidence and prevalence are not completely known. This disease is caused by direct and indirect lesions caused by SARS-CoV-2 infection to the myocardiocyte and other cells. Clinical manifestations vary from mild, such as fatigue and dyspnea, to severe, such as cardiogenic shock. Tests for the detection of this pathology are laboratory, imaging and histological. In this article we briefly review SARS-CoV-2 myocarditis in epidemiology, pathophysiology, clinic, diagnosis, treatment, as well as vaccination myocarditis.
En diciembre de 2019, un nuevo coronavirus originó un brote de infección aguda del tracto respiratorio en la ciudad de Wuhan, provincia de Hubei en China, que se propagó rápidamente a nivel mundial1. Los coronavirus pueden diferir en 4géneros: α, β, δ y γ2,3. El análisis filogenético y taxonómico demostró que el genoma del nuevo coronavirus es miembro del género β-coronavirus. Posteriormente, el comité internacional de taxonomía de virus propuso el nombre de coronavirus de tipo 2 causante del síndrome respiratorio agudo grave (SARS-CoV-2)2,4. El 11 de febrero de 2020, la Organización Mundial de la Salud nombró a esta nueva enfermedad COVID-19 y el 11 de marzo fue declarada la pandemia4.
La COVID-19 tuvo repercusión en todos los grupos etarios y étnicos5. Se observa predominio por el sexo masculino y una mayor gravedad clínica conforme aumenta la edad6, con una tasa de decesos que supera los 6 millones7. Además, presenta una relación significativa con trastornos cardiovasculares, como enfermedades cerebrovasculares, arritmias, cardiopatía isquémica y no isquémica, pericarditis, insuficiencia cardiaca, enfermedad tromboembólica y miocarditis, que aumenta el índice de morbimortalidad en estos pacientes8.
El SARS-CoV-2 tiene una estructura compuesta de ácido ribonucleico (ARN) monocatenario9. Ingresa en el organismo mediante las mucosas nasal, oral o conjuntiva10. Este virus es capaz de mediar su unión con el receptor de la enzima convertidora de angiotensina II (ECA2), presente en la membrana de las células epiteliales cilíndricas ciliadas del tracto respiratorio y de los neumocitos de tipo ii, a través de su proteína S (spike protein) y después permitir su acceso10,11.
Las manifestaciones clínicas observadas son principalmente respiratorias y abarcan desde una forma leve hasta un síndrome de dificultad respiratoria aguda12. Sin embargo, existen diversas manifestaciones extrapulmonares, lo que indica que el virus no solo afecta al epitelio pulmonar, sino que presenta un tropismo tisular en otros órganos. De esa manera, el SARS-CoV-2 utiliza el tracto respiratorio como sitio inicial de replicación para luego propagarse a otros órganos que expresan el receptor de ECA2, como el sistema nervioso central (bulbo olfatorio), renal (podocitos) y cardiovascular (miocardiocitos)13. El miocardio expresa grandes cantidades del receptor de ECA2, lo que predispone a complicaciones cardiovasculares de importancia, como la miocarditis14. Esto ha causado una importante preocupación entre los médicos y en la opinión pública sobre estos procesos inflamatorios15.
La miocarditis es la inflamación del músculo cardiaco secundaria a procesos infecciosos, autoinmunes e idiopáticos16. En Estados Unidos y otros países desarrollados, la causa principal es viral, con el virus Coxsackie B3 como el más frecuente; sin embargo, el parvovirus B19 y el herpes virus 6 se detectan cada vez más como agentes principales de miocarditis. Otro agente viral que se ha encontrado es el ARN de SARS-CoV-2 mediante biopsia endomiocárdica (BEM)17,18. La miocarditis viral es causa común de miocardiopatía dilatada: tiende a presentar una evolución hacia la insuficiencia cardiaca y, en adultos jóvenes menores de 40 años, es una causa importante de muerte cardiaca súbita16,19,20. En la tabla 1 se resumen los aspectos más importantes.
Descripción general de la epidemiología, fisiopatología, clínica, diagnóstico, tratamiento y miocarditis por vacunación
| Epidemiología• Incidencia: 0,01-7,7% en pacientes hospitalizados• Mayor incidencia en el sexo masculino• Pacientes más afectados: adultos mayores de 50 años y niños• Mortalidad estimada del 7% | Diagnóstico• Pruebas serológicas: troponinas, PCR, LDH y recuento de leucocitos• Pruebas de imágenes: ecocardiografía transtorácica, resonancia magnética cardiaca• Pruebas histopatológicas: biopsia endomiocárdica |
| Fisiopatología• SARS-CoV-2 une su proteína S al receptor ECA2 del miocardiocito• Lesión miocárdica inducida por células inflamatorias• Citotoxicidad mediada por linfocitos T CD8+• Tormenta de citocinas y trombosis contribuyen al desarrollo de la miocarditis | Tratamiento• El enfoque debe ser individualizado• Existen varios medicamentos propuestos, como los glucocorticoides, colchicina, tocilizumab y anakinra, pero se necesitan más estudios para demostrar su eficacia |
| Clínica: clasificación clinicopatológica:• Aguda: disnea u ortopnea• Crónica: disfunción cardiaca persistente• Fulminante: arritmias, insuficiencia cardiaca aguda y shock cardiogénico | Miocarditis por vacunación• Vacunas con tecnología ARNm: Pfizer-BioNTech y Moderna• Incidencia: 20-30 casos por millón de administraciones• Mayor incidencia en hombres adolescentes y adultos jóvenes entre 12 ya 29 años |
ARNm: ácido ribonucleico mensajero; ECA2: enzima convertidora de angiotensina II; LDH: lactato deshidrogenasa; PCR: proteína c reactiva; proteína S: proteína spike; RM: resonancia magnética cardiaca; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo grave.
Para la presente revisión bibliográfica se ha utilizado la siguiente estrategia de búsqueda en PubMed, incluyendo los artículos publicados en los últimos 3 años: myocarditis AND (SARS-CoV-2 OR COVID-19).
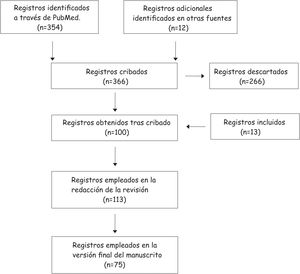
Se identificaron 354 estudios, además se obtuvieron 12 registros adicionales de otras fuentes, por lo que se obtuvo un total de 366 documentos.
Se seleccionaron estudios de revisiones narrativas, sistemáticas, metaanálisis y notificación de casos. Tras el cribado se descartaron 266 documentos. De los 100 restantes se incluyeron 13 registros. Se inició la redacción con 113 manuscritos. Finalmente, la revisión empleó 75 referencias. En la figura 1 se muestra el diagrama que resume la búsqueda y cribado.
EpidemiologíaEl SARS-CoV-2 que produce la enfermedad de la COVID-19 tuvo repercusiones importantes en la salud de las diferentes regiones del mundo, por la gran cantidad de casos confirmados y muertes.
En una investigación se evidenció que la morbimortalidad de la COVID-19 fue mayor en hombres que en mujeres en todos los grupos etarios. Asimismo, se observó que la gravedad clínica de la enfermedad aumenta con la edad6. Por lo tanto, tiene una presentación clínica más leve y resultados más favorables en niños que en adultos21. A fecha 22 de noviembre de 2022, había más de 600 millones de casos confirmados de COVID-19 en todo el mundo, con más de 6 millones de muertes7.
Una investigación realizada en Estados Unidos reveló que después de los primeros 30 días de infección, el paciente con COVID-19 tenía un mayor riesgo de presentar trastornos cardiovasculares, tales como enfermedades cerebrovasculares, arritmias, cardiopatía isquémica y no isquémica, pericarditis, insuficiencia cardiaca, enfermedad tromboembólica y miocarditis8. La gravedad de la neumonía por COVID-19, presencia de enfermedad cardiaca previa, estados de inmunosupresión y uso de terapias cardiotóxicas son factores de riesgo para el desarrollo de trastornos cardiovasculares22.
La incidencia de la miocarditis fue de 6,1 por 100.000 en hombres y de 4,4 por 100.000 en mujeres entre los 35 y 39 años, con una proporción de 1,5:1 y 1,7:1, respectivamente23,24. La mortalidad fue del 0,2 por 100.000 en hombres en comparación con el 0,1 por 100.000 en mujeres23. Además, la miocarditis representa del 5 al 22% de las muertes cardiacas súbitas en pacientes jóvenes25.
La miocarditis por SARS-CoV-2 afecta predominantemente al sexo masculino, con mayor incidencia en los mayores de 50 años y en los niños menores de 16 años26. Según estudios retrospectivos, la incidencia oscila entre el 0,01 y el 7,7% en pacientes hospitalizados27. Asimismo, produce una mortalidad aproximada del 7%28. Sin embargo, con estos datos aún no se conoce por completo la incidencia y prevalencia de la miocarditis por SARS-CoV-2, por lo que permanece en estudio.
FisiopatologíaMecanismo de fusión de membranasEl SARS-CoV-2 une su proteína S al receptor ECA2 del miocardiocito29; la subunidad S1 de la proteína S a través de su dominio RBD reconoce al receptor ECA2. A continuación, la proteasa transmembrana serina 2 (TMPRSS2), que se coexpresa con la ECA2 en la membrana del miocardiocito30, se escinde en el sitio del corte proteolítico entre las subunidades S1/S2 de la proteína S y luego separa directamente a la subunidad S2 en S2’. Todo ello promueve el reordenamiento estructural del dominio RBD para la unión al receptor de ECA2. Esto permite que haya un cambio en la conformación de la subunidad S2, que contiene el péptido de fusión, el cual es insertado en la membrana de la célula diana2. Posteriormente, hay una interacción entre las regiones de la subunidad S2, la repetición heptada 1 y la repetición heptada 231; esta interacción forma el complejo 6HB, que permite la fusión de la membrana viral con la membrana del miocardiocito, con la siguiente infiltración viral2.
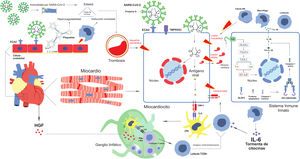
Se establece en algunos estudios previos que el mecanismo de la lesión miocárdica no está completamente definido. Sin embargo, se plantea la combinación o la acción independiente de 2mecanismos: lesión celular directa y lesiones celulares indirectas, como la muerte celular inmunomediada, la tormenta de citocinas y la trombosis32-34 (fig. 2).
Posibles mecanismos fisiopatológicos de la miocarditis por SARS-CoV-2.
C-Met: receptor de c-Met; CMH-I/II: complejo mayor de histocompatibilidad I/II; CPA: célula presentadora de antígeno; ECA2: enzima convertidora de angiotensina II; FVW: factor de Von Willebrand; Gp Ib: glucoproteína Ib; HGF: factor de crecimiento de hepatocitos; IL-1B: interleucina 1 beta; IL-6: interleucina 6; Nf-kB: factor nuclear kappa beta; NK: natural killer; NLRP3: molécula sensora; proteína S: proteína spike; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo grave; TCR: receptor de células T; TLR: receptores tipo toll; TMPRSS2: proteasa transmembrana serina 2.
La lesión cardiaca directa se produce por la infiltración del SARS-CoV-2 en los miocardiocitos35. Los miocardiocitos lesionados liberan proteínas, como la miosina cardiaca, y esta es captada por receptores del tipo toll de las células del sistema inmune innato27,34; estos receptores activan mecanismos de señalización intracelular, como la vía IRAKs, TRAF6, TAK1, P38 y JNK, los cuales terminan activando el factor nuclear kappa β (Nf-κB), que induce la producción de prointerleucina 1B (Pro IL-1B) a nivel nuclear. La formación y activación del inflamosoma están dadas por la molécula sensora NLRP3, proteína adaptadora y caspasa 1 inactivada. Una vez activado, el inflamosoma NLRP3 permite la conversión de Pro IL-1B en IL-1B a través de la caspasa 1 activada36,37. La IL-1B es una potente citocina inflamatoria responsable del reclutamiento de células inmunitarias, como células natural killer, macrófagos o linfocitos T en el miocardio, que provocan lesión miocárdica27,34.
Lesiones indirectas. Mecanismo mediado por el sistema inmuneEl SARS-CoV-2 infecta el miocardiocito. Una vez dentro, presenta los antígenos virales a través del complejo mayor de histocompatibilidad de clase I. Estos antígenos son reconocidos por las células presentadoras de antígenos (dendríticas), que procesan y presentan el antígeno del SARS-CoV-2 a los linfocitos T naives en los ganglios linfáticos. Luego los linfocitos reciben los antígenos a través del receptor de células T. Por otra parte, el parénquima cardiaco produce factor de crecimiento de hepatocitos, los cuales llegan a sus receptores c-Met ubicados en la superficie celular de los linfocitos T naives e inducen cardiotropismo11,38. Los linfocitos naives se diferencian a linfocitos T CD8+ y migran hacia los miocardiocitos por la inducción de los antígenos virales y el cardiotropismo y, al llegar al miocardio, producen inflamación por citotoxicidad mediada por células11.
Tormenta de citocinasLa combinación de lesión celular directa y citotoxicidad de células T dirigida al miocardio puede verse potenciada por el síndrome de liberación de citocinas o tormenta de citocinas6,39. Este síndrome se produce a consecuencia de la infección del SARS-CoV-2 de las células epiteliales cilíndricas ciliadas del tracto respiratorio y de los neumocitos tipo II. Provoca una respuesta proinflamatoria y la secreción de interleucina 6 (IL-6)40 por las células del sistema inmune innato, como los macrófagos41, lo que incrementa la diferenciación y producción de células T citotóxicas40.
La IL-6 es el mediador central de la tormenta de citocinas, que activa los linfocitos T y potencia la liberación de citocinas inflamatorias. Estas, a su vez, estimulan a más linfocitos T. Se forma así un ciclo de activación de la respuesta inmune, con la consecuente lesión miocárdica42. Además, estimula la producción de otras citocinas y promueve la fuga vascular, lo que forma el edema intersticial39. La IL-6 es un importante predictor de gravedad y mortalidad en pacientes con infección por SARS-CoV-243,44.
La tormenta de citocinas con aumento de IL-6 conlleva un estado de hipoxia, hipoxemia, inflamación crónica y angiogénesis44.
Mecanismo mediado por trombosisLas células endoteliales ubicadas en la túnica íntima de los vasos coronarios presentan el receptor de ECA234,45. El SARS-CoV-2 infecta estas células, lo que promueve la migración de macrófagos, que terminan lesionando el endotelio en un intento de evitar la propagación del virus. Además, activan el sistema de complemento, lo cual forma el complejo de ataque de membrana e incrementa aún más la lesión (disfunción endotelial)46,47. Los cuerpos de Weibel-Palade, ante la lesión del endotelio, liberan factor de Von Willebrand (FVW)48, que se polimeriza y se adhiere a las plaquetas y al colágeno subendotelial, activando así la agregación plaquetaria49, lo que conlleva un estado de hipercoagulabilidad50. El estado de inmovilidad por SARS-CoV-2 puede conducir a estasis; el proceso inflamatorio, la viremia y el síndrome de tormenta de citocinas inducen, asimismo, un estado de hipercoagulabilidad. De esta manera, se completa la tríada de Virchow, que promueve el proceso de trombosis51. La trombosis produce isquemia miocárdica, que podría exacerbar el proceso de miocarditis46.
Manifestaciones clínicasLas manifestaciones clínicas de la miocarditis por SARS-CoV-2 pueden presentarse de diferente manera según su compromiso y gravedad.
La miocarditis se clasifica en aguda, crónica o fulminante52. En la forma aguda se manifiesta disnea u ortopnea, con una resolución de alrededor del 50% de los casos en un plazo de entre 2 y 4 semanas. En la forma crónica se observa disfunción cardiaca persistente, que puede progresar a una miocardiopatía dilatada53. En la miocarditis fulminante se evidencia una elevada morbimortalidad54 debido a que se asocia a trastornos de la conducción, insuficiencia cardiaca aguda y shock cardiogénico52.
En la miocarditis por SARS-CoV-2, la manifestación clínica se considera leve cuando incluye fatiga y disnea55; moderada, cuando se observa la presencia de palpitaciones, elevación de la presión arterial, dolor y opresión torácica56. La presentación grave, por su parte, puede incluir derrame pericárdico, edema de miocardio, hipertensión pulmonar, disfunción diastólica56, arritmias, taquicardia, insuficiencia cardiaca aguda, shock cardiogénico y muerte súbita cardiaca55.
La miocarditis precoz suele manifestarse a las pocas horas o días de la exposición a los agentes etiológicos. En cambio, la denominada miocarditis tardía puede manifestarse varios días o semanas después de la infección por SARS-CoV-257.
Todos los casos publicados anteriormente de miocarditis por SARS-CoV-2 ocurrieron en la primera semana posterior a los síntomas iniciales de infección por COVID-19, excepto 2 casos en los que se detectó miocarditis clínica tardía58.
DiagnósticoPruebas serológicasSe ha observado un aumento de la proteína C reactiva (PCR), el lactato deshidrogenasa (LDH) y el recuento de glóbulos blancos en pacientes con miocarditis por SARS-CoV-2. Sin embargo, a pesar de su sensibilidad, estas pruebas no son específicas, puesto que sus valores también se elevan en procesos inflamatorios sistémicos40.
La prueba de troponinas presenta mayor especificidad que las pruebas serológicas anteriores40. Por lo tanto, se debe realizar dosaje de troponinas basales I/T y fracción aminoterminal del propéptido natriurético cerebral (tipo B) ante la sospecha de un paciente con miocarditis. No obstante, un nivel de troponina normal no excluye el diagnóstico de miocarditis por SARS-CoV-255.
Pruebas de imagenLa ecocardiografía transtorácica es la prueba de imagen de primera línea para la evaluación de la miocarditis asociada a COVID-19 recomendada por la Sociedad Europea de Cardiología, debido a que es una herramienta ampliamente disponible, portátil y de bajo coste59.
La resonancia magnética (RM) cardiaca es el método de referencia (gold standard) de las pruebas de imagen, debido a que permite caracterizar los hallazgos patológicos como el edema, la necrosis y la fibrosis en el tejido miocárdico. A pesar de ello, tiene algunas desventajas, que incluyen la poca disponibilidad, el coste elevado y aspectos relacionados con el paciente, como la alergia al contraste59. El diagnóstico de miocarditis por RM cardiaca se confirma mediante los criterios de consenso de Lake Louise60: deben darse al menos 2de los 3criterios establecidos, ya que estos tienen una sensibilidad del 76% y una especificidad del 96% en los pacientes con miocarditis61.
Pruebas histopatológicasLa BEM es una herramienta esencial para el diagnóstico, investigación y tratamiento de enfermedades miocárdicas62. La BEM en muchos estudios es considerada el gold standard para el diagnóstico definitivo de miocarditis por COVID-1915,53,63. Si bien es muy específica, la sensibilidad informada para la miocarditis diagnosticada está entre el 10% y el 22%64. La baja sensibilidad se atribuye considerando la posibilidad limitada de muestreo miocárdico63.
En la BEM se requieren los criterios de Dallas, que incluyen la presencia de infiltrados inflamatorios con necrosis de miocardiocitos de causa no isquémica y edema intersticial40, y se define por la presencia65 de >14 leucocitos/mm3, >4 monocitos/mm3 y 7 linfocitos T CD3+/mm3. Sin embargo, estos hallazgos no son propios de la infección por SARS-CoV-2 y pueden estar presentes en casos de miocarditis secundaria a otras causas. A pesar de todo ello, el diagnóstico histológico rara vez presenta un impacto significativo para decidir el tratamiento.
TratamientoLa terapéutica de la miocarditis por SARS-CoV-2 se ha ido modificando con el avance de los estudios; por ello, no es estandarizada y el enfoque debe ser individualizado. En una revisión sistemática de Sawalha et al., expusieron que el manejo de glucocorticoides en pacientes con miocarditis por SARS-CoV-2 obtuvo una respuesta muy favorable. Sin embargo, esta revisión fue realizada sobre 14 casos registrados, por lo que carece de fiabilidad66. En otro estudio se observó que el uso de glucocorticoides depende de la inmunidad del huésped y conlleva un retraso en la eliminación del ARN mensajero (ARNm) viral, por lo tanto, no se recomienda en pacientes con presentación clínica leve de COVID-1967.
La miocarditis por SARS-CoV-2 se ve potenciada por la tormenta de citocinas, por lo cual se proponen varios medicamentos, entre ellos, la colchicina, debido a sus propiedades antiinflamatorias y, posiblemente, antivirales. En una revisión sistemática de Shangavi et al. se evidenció que la colchicina presenta resultados variables y no la recomiendan como parte del tratamiento hasta que más estudios demuestren su eficacia68. Otro fármaco estudiado es el tocilizumab, antagonista de la IL-6. Un metaanálisis reveló resultados prometedores en la reducción de la mortalidad en pacientes con COVID-19, pero su uso en el tratamiento de la miocarditis por SARS-CoV-2 es discutible66,69.
La IL-1B es una citocina encargada de reclutar células inflamatorias, como los macrófagos, y contribuir en el mecanismo fisiopatológico de la miocarditis. Debido a ello, estudios de ensayos mencionan el papel de la anakinra, puesto que su mecanismo de acción consiste en bloquear la actividad tanto de la IL-1α como de la IL-1β. Estos ensayos han completado la fase de aleatorización, pero aún están a la espera de resultados completos70.
En cuanto a los pacientes que presentan insuficiencia cardiaca hemodinámicamente estable, deberán ser tratados con diuréticos, inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina y bloqueadores β-adrenérgicos. En pacientes con shock cardiogénico se requiere el uso de agentes inotrópicos, como la dobutamina. Este tratamiento debe proporcionarse en una unidad de cuidados intensivos con instalaciones de apoyo mecánico respiratorio y cardiopulmonar. No existen protocolos específicos para pacientes con arritmias y trastornos de la conducción en el grupo con miocarditis71.
Miocarditis por vacunaciónAnte el estado de emergencia por la COVID-19, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una autorización para el uso emergente de la vacuna Pfizer-BioNTech (ARNm BNT162b2) y posteriormente autorizó 2 vacunas más: la de Moderna (ARNm-1273) y la de Janssen/Johnson (vector viral tradicional). Se observó la presencia de miocarditis después del uso de vacunas con tecnología ARNm72. La incidencia de la miocarditis por vacunación se estima en 20-30 casos por millón de administraciones73, con predominio de hombres adolescentes y adultos jóvenes entre 12 y 29 años72; la mayoría de los casos se registraron después de la administración de la segunda dosis de la vacuna, con inicio de las primeras manifestaciones clínicas alrededor de los 3,5 días74.
Los mecanismos de la miocarditis por vacunación no están aún esclarecidos, pero se postulan 2hipótesis que incluyen en primera instancia el mimetismo molecular. Esto indica la gran cantidad de epítopos compartidos entre la proteína S del SARS-CoV-2 y los autoantígenos tisulares, como la actina f y la miosina α. La otra hipótesis señala que la miocarditis se desencadena por reactividad cruzada entre los componentes del ARNm de la vacuna y los receptores de ARN, lo que conduce a una sobreactivación del sistema inmune innato, que desencadena una excesiva liberación de citocinas73.
La manifestación clínica más informada fue el dolor torácico, seguido de fiebre y dificultad respiratoria, con una presentación que va desde una forma subclínica hasta formas graves, como arritmias cardiacas, insuficiencia cardiaca y, en casos raros, shock cardiogénico. El curso clínico suele ser leve y autolimitado, con recuperación completa de los pacientes en cuestión de días, pero en casos de gravedad clínica puede estar asociado a comorbilidades y su tratamiento debe ser inmediato72,75. Para el diagnóstico, la RM cardiaca desempeña un rol muy importante. Los hallazgos encontrados en la miocarditis después de la vacunación son similares a los de la miocarditis por otras causas, pero la gravedad y las anomalías suelen ser más leves. En la RM cardiaca se observan hallazgos típicos, como la presencia de realce tardío con gadolinio subepicárdico y edema colocalizador en la pared lateral inferior basal72.
Con estos datos se observa que la incidencia general de miocarditis por vacunación es baja. Sin embargo, los médicos deben considerar la miocarditis por vacunación como un posible diagnóstico, principalmente ante pacientes varones adolescentes y adultos jóvenes con antecedentes de administración de vacunas y que presenten hallazgos sugestivos de miocarditis.
ConclusionesEl daño que el SARS-CoV-2 causa al tejido cardiaco, al producir miocarditis, se convirtió en una inquietud en la comunidad médica a inicios de la pandemia de la COVID-19. Gracias a la continua investigación de los científicos, hoy se conoce más sobre su fisiopatología y diagnóstico, pero, a pesar de todos los datos disponibles, siguen sin esclarecerse los mecanismos fisiopatológicos completos que promueven el desarrollo de esta enfermedad.
FinanciaciónEsta investigación no ha recibido ayudas específicas de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autoresN. L. Cahuapaza Gutiérrez ha realizado la búsqueda bibliográfica y la redacción del manuscrito y T. S. Campos Escalante ha contribuido en la concepción inicial del manuscrito, así como en la revisión intelectual y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.