Hace más de 100 años de las publicaciones seminales de James B. Herrick1 en las que se sentaron las primeras evidencias en humanos respecto al papel decisivo de la obstrucción trombótica de las arterias coronarias sobre la fisiopatología del infarto de miocardio (IM), así como del hecho de que esta patología no tenía por qué implicar necesariamente, como hasta entonces existía la creencia, la muerte inmediata de los pacientes. Desde entonces, se han conseguido hitos impensables en el conocimiento y el manejo de esta entidad. Fue crucial de cara a la reducción de la mortalidad aguda tras un IM la introducción durante el último tercio del siglo pasado del uso rutinario de la reperfusión coronaria precoz, primero mediante fibrinólisis y posteriormente de manera percutánea.
No obstante, a pesar de la reperfusión de la arteria coronaria epicárdica, el deterioro de la perfusión miocárdica persiste en un número considerable de pacientes (30-60% de los casos). Este fenómeno se denomina obstrucción microvascular (OMV)2,3. Los primeros hallazgos fueron comunicados en modelos experimentales por Krug en los años 60 y el concepto fue definido por Kloner en los años 704.
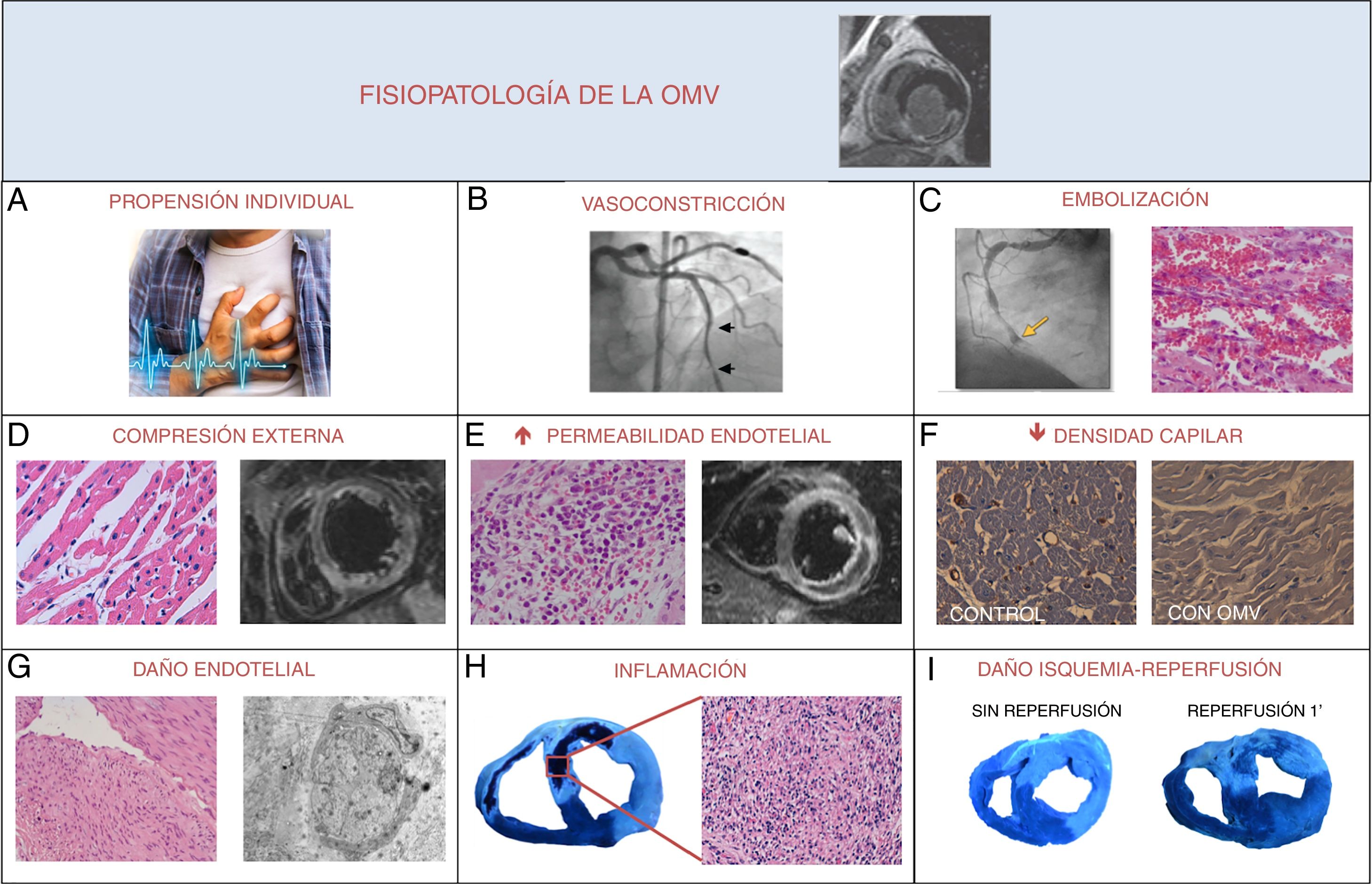
El fenómeno de OMV presenta una fisiopatología compleja todavía no completamente entendida, que viene determinada por varios mecanismos que actúan tanto simultánea como secuencialmente2,3. En la figura 1 se muestra un resumen de los principales procesos fisiopatológicos que desempeñan un papel crucial en el daño microvascular tras un IM.
Mecanismos implicados en la fisiopatología de la obstrucción microvascular (OMV) tras un infarto de miocardio. A) Propensión individual. Presencia de una gran área de miocardio en riesgo (infartos anteriores extensos, clínica de insuficiencia cardiaca) o de una microcirculación previamente dañada (diabéticos, pacientes con retraso en la reperfusión). B) Vasoconstricción. Tanto la isquemia como, posteriormente, el potencial daño asociado a la reperfusión ocasionan la activación del endotelio. En consecuencia, se producirá una desregulación del balance de producción de vasoconstrictores y vasodilatadores en favor de los primeros, contribuyendo así a la reducción de la perfusión miocárdica. C) Embolización. La microembolización debida a pequeños fragmentos de material embólico, restos de la placa friable y agregados plaquetarios e inflamatorios que pueden ocluir la microvasculatura subyacente. D) Compresión externa. La hemorragia y especialmente el edema miocárdico van a producir una compresión externa de los pequeños vasos que, en consecuencia, reducirán la perfusión microvascular. E) Aumento de la permeabilidad endotelial. El daño por reperfusión incluye la hinchazón brusca y la disrupción de las células endoteliales. Esto, junto a la llegada masiva de neutrófilos, plaquetas y hematíes con la reperfusión, puede provocar la obstrucción de los microcapilares y la extravasación de estos tipos celulares al miocardio. F) Disminución de la densidad capilar. Pérdida cuantitativa real del número de pequeños vasos en la zona en riesgo. G) Daño endotelial. Tras un periodo prolongado de isquemia, se produce un daño funcional y estructural desde la arteria epicárdica hasta los capilares coronarios, que incluye la edematización de las células endoteliales, la pérdida de vesículas pinocíticas y la marginación de la cromatina. Estos fenómenos pueden ser exacerbados por el estrés hemodinámico y oxidativo provocado por la reperfusión. H) Inflamación. La desregulación aguda de la respuesta inflamatoria en el contexto del infarto de miocardio puede conllevar como efecto indeseable un aumento innecesario del daño estructural que puede afectar a la microcirculación. I) Daño por isquemia-reperfusión. Si bien la reperfusión precoz es completamente necesaria, paradójicamente conlleva un estrés hemodinámico y oxidativo para los capilares coronarios.
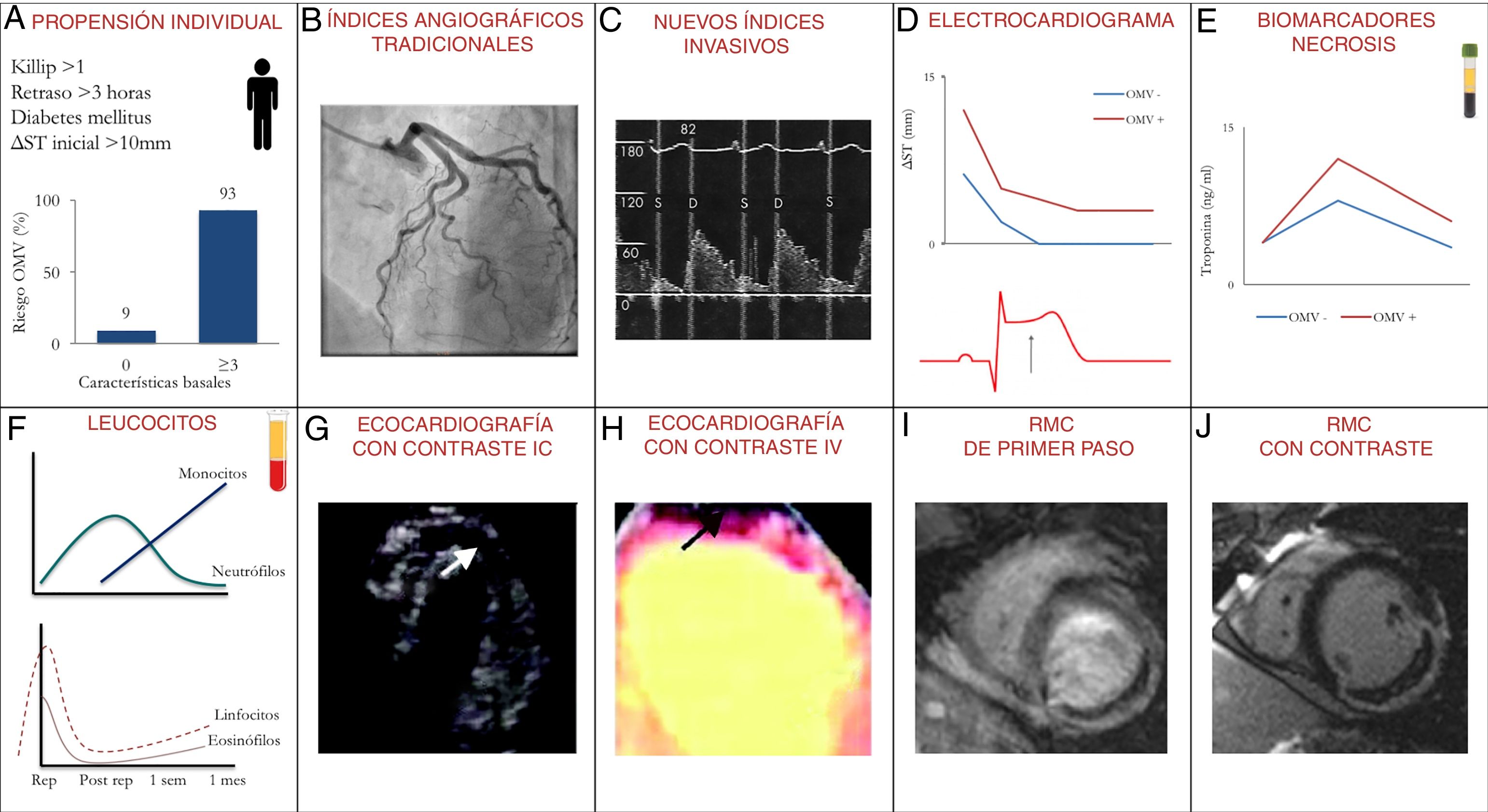
Ya en el momento de la presentación, determinadas características basales del paciente son de gran valor para predecir el riesgo de producirse una OMV. Nuestro grupo desarrolló una escala que, incluyendo 4 variables disponibles en el momento de la presentación (clase Killip > 1, retraso en la reperfusión > 3h, diabetes mellitus y sumatorio de ST en el electrocardiograma inicial > 10mm), se asociaba estrechamente al riesgo de desarrollar OMV (9% si ninguno estaba presente, 93% si 3 o más estaban presentes)5.
Índices angiográficos como la presencia de oclusión completa y la enfermedad de la arteria descendente anterior proximal informan de predisposición al daño microvascular. Tras el tratamiento de reperfusión, la velocidad de relleno de la arteria del infarto y la captación de contraste por el miocardio han sido ampliamente utilizados en la valoración de la perfusión miocárdica tras la reperfusión, aunque son índices muy sujetos a variabilidad interobservador. Recientemente, se han desarrollado aproximaciones de perfil más fisiológico basadas en el flujo o en la resistencia. La opinión generalizada es que se trata de índices muy prometedores para la valoración precoz de la presencia y magnitud de OMV, pero será precisa una validación mucho más amplia2,3,6.
También existen herramientas de disponibilidad universal, como el electrocardiograma, que nos informan del resultado de las terapias de reperfusión a nivel microvascular. Si la oclusión coronaria epicárdica se ha resuelto, la presencia de elevación residual del segmento ST en las derivaciones del infarto es un potente predictor de OMV. Asimismo el uso de biomarcadores de necrosis (especialmente la troponina) y del recuento leucocitario se ha asociado a la extensión de la OMV6,7.
Los primeros progresos importantes en OMV a nivel clínico fueron posibles gracias al estudio de la perfusión miocárdica mediante ecocardiografía transtorácica e inyección intracoronaria de contraste ecográfico. La limitación de esta técnica era su carácter invasivo y su baja disponibilidad. Por ello se pasó al estudio de la perfusión miocárdica post-IM mediante ecocardiografía con inyección intravenosa de contraste2,3,6.
En este contexto, la incorporación de la resonancia magnética cardiaca (RMC) al estudio del paciente con IM fue decisiva. Mediante la inyección intravenosa del contraste gadolinio es posible estudiar con RMC el estado de la microcirculación2,3,6. Esta técnica se ha convertido en la más fiable para conocer las implicaciones estructurales y clínicas de la OMV (fig. 2).
Métodos diagnósticos de la obstrucción microvascular (OMV) en pacientes con infarto de miocardio (IM). A) Propensión individual. Las características basales del paciente van a ser decisivas para predecir el riesgo de OMV, entre ellas, la magnitud de los cambios electrocardiográficos, la localización anterior del IM, la presencia de insuficiencia cardiaca, los antecedentes de diabetes o el retraso hasta la reperfusión. B) Índices angiográficos tradicionales. La presencia de oclusión completa (Thrombolysis in Myocardial Infarction [TIMI] = 0) y la enfermedad de la arteria descendente anterior proximal informan de predisposición al daño microvascular. Tras la reperfusión, la velocidad de relleno de la arteria del infarto (índices TIMI y TIMI Frame Count) y la captación de contraste por el miocardio (índices TIMI Myocardial Perfusion Grade y Myocardial Blush Grade). C) Nuevos índices invasivos. Se trata de aproximaciones de perfil más fisiológico basadas en el flujo (como la reserva de velocidad del flujo coronario, el tiempo de deceleración diastólico de la velocidad del flujo coronario o la presencia de inversión sistólica del flujo) o basadas en la resistencia (como los índices de resistencia microvascular o de presión coronaria a flujo cero). D) Electrocardiograma. La presencia de elevación residual del segmento ST en las derivaciones del infarto y la elevación del ST en derivaciones con onda Q durante el esfuerzo (en ausencia de isquemia residual). E) Biomarcadores. La elevación importante y temprana de los marcadores de necrosis (especialmente la troponina) se asocia a una OMV más extensa. F) Leucocitos. En presencia de OMV se observa un incremento grave mediado por células de la inmunidad innata (neutrófilos y monocitos); sin embargo, se detecta una depleción de células de la inmunidad adaptativa y efectora (linfocitos y eosinófilos). G) Ecocardiografía con contraste intracoronario (IC). Esta técnica permitió observar de manera inmediata tras la reperfusión que incluso tras restablecer un flujo TIMI 3 en la arteria responsable podían quedar zonas con OMV. H) Ecocardiografía con contraste intravenoso (IV). Las implicaciones de esta técnica son las mismas que con la inyección IC; su uso es mucho más accesible, aunque evidentemente la calidad de la imagen y la reproducibilidad son menores. I) Resonancia magnética cardiaca (RMC) de primer paso de contraste. Si durante el primer paso del contraste gadolinio (primer minuto tras la inyección) hay un retraso en la llegada a la zona del infarto, esto es indicativo de daño microvascular. Este índice ha sido criticado por su excesiva sensibilidad, ya que aparece alterado en la mayoría de los pacientes. J) RMC con captación tardía de contraste. Tras unos 10 min de la inyección, el contraste queda retenido en la zona del infarto, delimitando con exactitud la zona necrótica que aparece realzada. Si el centro de esta zona infartada (hiperrealzada) no capta contraste (queda negra), indica un daño microvascular muy grave con consecuencias deletéreas en términos de remodelado y pronóstico.
Actualmente, no hay duda de que en infartos con grandes áreas de miocardio en riesgo el principal factor que va a marcar el daño estructural resultante y la supervivencia de los pacientes, junto con la extensión de la necrosis, es la magnitud de la OMV.
En este sentido, nuestro grupo y otros autores han demostrado, ya en la era de la reperfusión generalizada, la alta prevalencia de la OMV, así como sus efectos estructurales deletéreos en forma de infartos más extensos, mayor depresión de la función sistólica, menor recuperación contráctil, más remodelado adverso o existencia de trombos ventriculares8,9. La OMV ha demostrado ser un factor asociado de manera potente a todos estos hallazgos, que a su vez implican un elevado riesgo de eventos tras un IM10-13.
La constatación del impacto negativo estructural de la OMV rápidamente se trasladó hacia un interés en explorar las implicaciones pronósticas. Tanto en registros prospectivos como en metanálisis de estudios que han utilizado la RMC, la presencia de OMV se ha revelado como un marcador pronóstico de eventos graves tras un IM. En un reciente metanálisis el riesgo a 2 años de muerte, reinfarto o insuficiencia cardiaca fue del 24% en pacientes con OMV frente al 7% en aquellos sin OMV; la presencia de OMV se manifestó como el factor pronóstico más potente y multiplicó de manera independiente por 3,7 el riesgo de eventos10.
Es esperanzador conocer que con la reperfusión precoz tras el IM y un tratamiento médico óptimo la tendencia actual en la mayoría de los casos es hacia el remodelado inverso (beneficioso). Incluso en infartos extensos, si se evita la OMV, la tendencia es muy parecida. Sin embargo, los casos en los que coexisten necrosis y OMV extensas son los que presentan un daño estructural más grave y muestran una evolución clínica más sombría8.
Oportunidades de prevención y tratamientoSe ha demostrado que, en ausencia de colaterales previas, si la arteria coronaria permanece cerrada la necrosis es transmural y completa. Siguiendo este paradigma, se ha observado una reducción importante de la mortalidad aguda tras IM gracias a las terapias de reperfusión precoz. Sin embargo, en un contexto de daño por isquemia-reperfusión, del que la OMV forma parte, la recanalización de la arteria coronaria puede conllevar un aumento del daño miocárdico y microvascular esperable. Se están realizando grandes esfuerzos en evaluar nuevas terapias que, como coadyuvantes de la reperfusión precoz, pudieran minimizar aún más el tamaño del infarto y de la OMV, mejorando así el pronóstico de los pacientes.
La tabla 1 resume algunas de las opciones terapéuticas que han demostrado cierto efecto positivo en el manejo de la OMV en base a los mecanismos fisiopatológicos subyacentes.
Esquema resumen de las opciones terapéuticas y de prevención de la obstrucción microvascular tras un infarto de miocardio según el mecanismo fisiopatológico al que van destinadas
| Mecanismos fisiopatológicos | Opciones de prevención y tratamiento |
|---|---|
| Propensión individual de cada paciente | – Prevención primaria (dieta, estilo de vida, tratamiento médico) para disminuir la incidencia de la cardiopatía isquémica, y del IM en general y de la OMV en particularReperfusión efectiva precoz: mejor opción para reducir la OMV |
| Daño por isquemia-reperfusión | – Poscondicionamiento isquémico: efecto controvertido sobre la OMV en estudios experimentales y clínicos. Ensayos clínicos pendientes de resultados– Condicionamiento remoto: efectividad no demostrada en ensayos clínicos grandes– Terapias no farmacológicas (hiperoxemia e hipotermia) y farmacológicas (péptido natriurético auricular, atorvastatina, ciclosporina A, exenatida y terapia con glucosa-insulina-potasio): resultados positivos en modelos experimentales pero resultados neutros en ensayos clínicos– Tratamiento intravenoso con metoprolol: estudios experimentales y clínicos preliminares esperanzadores (menor tamaño de infarto, menos OMV, mejores fracción de eyección y strain miocárdico). Ensayos clínicos pendientes de resultados |
| Inflamación | – Tratamiento con corticoides e inhibidores de neutrófilos (anti-CD11/CD18) y del complemento (anti-C5, pexelizumab): resultados neutros en ensayos clínicos |
| Anormalidades del endotelio | – Bloqueo de endotelina-A: disminución de la OMV en modelos experimentales, no demostrado en ensayos clínicos |
| Disminución de la densidad capilar | – Terapias dirigidas a potenciar la angiogénesis y el bloqueo de factores antiangiogénicos en la OMV establecida: No explorado |
| Aumento de la permeabilidad endotelial | – Terapias dirigidas a reducir la permeabilidad endotelial: no explorado |
| Compresión externa | – Terapias dirigidas a reducir el edema y la hemorragia ya establecidos: no explorado |
| Embolización | – Trombectomía y tromboaspiración: efectividad no demostrada en grandes ensayos clínicos– Antitrombóticos y antiagregantes sistémicos: efecto directo sobre la prevención o la reducción de la OMV establecida no demostrado |
| Vasoconstricción | – Adenosina, verapamilo, dilitiazem, nitroprusiato (administración durante la angioplastia primaria): mejora en el flujo angiográfico, efectividad clínica y sobre la OMV no demostrada |
IM: infarto de miocardio; OMV: obstrucción microvascular.
Es importante conocer la dinámica temporal de evolución de la OMV para entender las potenciales oportunidades de prevención y tratamiento. Sabemos que al iniciarse el IM la isquemia severa previa a la reperfusión se relaciona con una disminución del número de pequeños vasos; esta pérdida se acentúa de manera abrupta con la reperfusión, alcanza su máximo tras unos días y se recupera espontánea y paulatinamente en las semanas siguientes14. Sin duda, la pérdida de pequeños vasos durante la isquemia aguda debe de combatirse con una reducción óptima del tiempo desde el inicio del dolor al hinchado de balón. Han de seguir implementándose todas las medidas logísticas para que este periodo sea mínimo. Un segundo momento crítico es la reperfusión: en este punto se produce un incremento masivo de la pérdida de pequeños vasos y se establecen de manera macroscópica las grandes áreas de OMV15. Finalmente, una vez superada la fase aguda, cómo abordar la OMV residual y si realmente debemos hacerlo es una incógnita. De manera interesante, la onda de OMV muestra un avance más lento que la de necrosis y puede durar hasta varios días en alcanzar el máximo daño. Esto nos ofrece una potencial ventana temporal terapéutica más prolongada que las escasas 4-6h de que disponemos para salvar miocardio. Nuestro propio organismo, a diferencia de la regeneración miocárdica, pone rápidamente en marcha mecanismos muy efectivos de angiogénesis que tienden a reparar en unas semanas la pérdida de microcirculación. En estudios experimentales y clínicos se ha observado un incremento de factores proangiogénicos en fases hiperagudas del IM, incluso antes de la reperfusión de la arteria epicárdica14.
En resumen, la mayoría de los estudios que han analizado nuevas terapias coadyuvantes a la reperfusión se han centrado en estrategias encaminadas a reducir el tamaño del infarto pero pocos trabajos han analizado específicamente la repercusión en la OMV. En general, se han obtenido resultados positivos usando diferentes aproximaciones en modelos experimentales muy controlados. Algunos estudios aportan resultados favorables en grupos reducidos de pacientes mediante análisis de objetivos subrogados pero poco concluyentes en cuanto a eventos clínicos. Hasta la actualidad, ninguna de las terapias evaluadas ha trascendido del ámbito de la investigación al uso clínico rutinario.
Perspectivas futurasDe cara al futuro, si queremos avanzar hacia la reducción de la OMV en el IM, las 3 ideas centrales han de ser prevención, consolidación de lo conseguido e investigación.
Las medidas de prevención primaria y educación en la población deben ser la base para reducir la incidencia de nuevos eventos coronarios. Sin duda, esta es la manera más efectiva para reducir el coste económico y social de la cardiopatía isquémica y en concreto del IM y la OMV.
A nivel asistencial, es esencial consolidar el gran progreso realizado, esto es, mantener y expandir el uso generalizado de la reperfusión coronaria de manera precoz. Esta es probablemente la manera más efectiva de reducir el tamaño del infarto y de prevenir o minimizar la OMV.
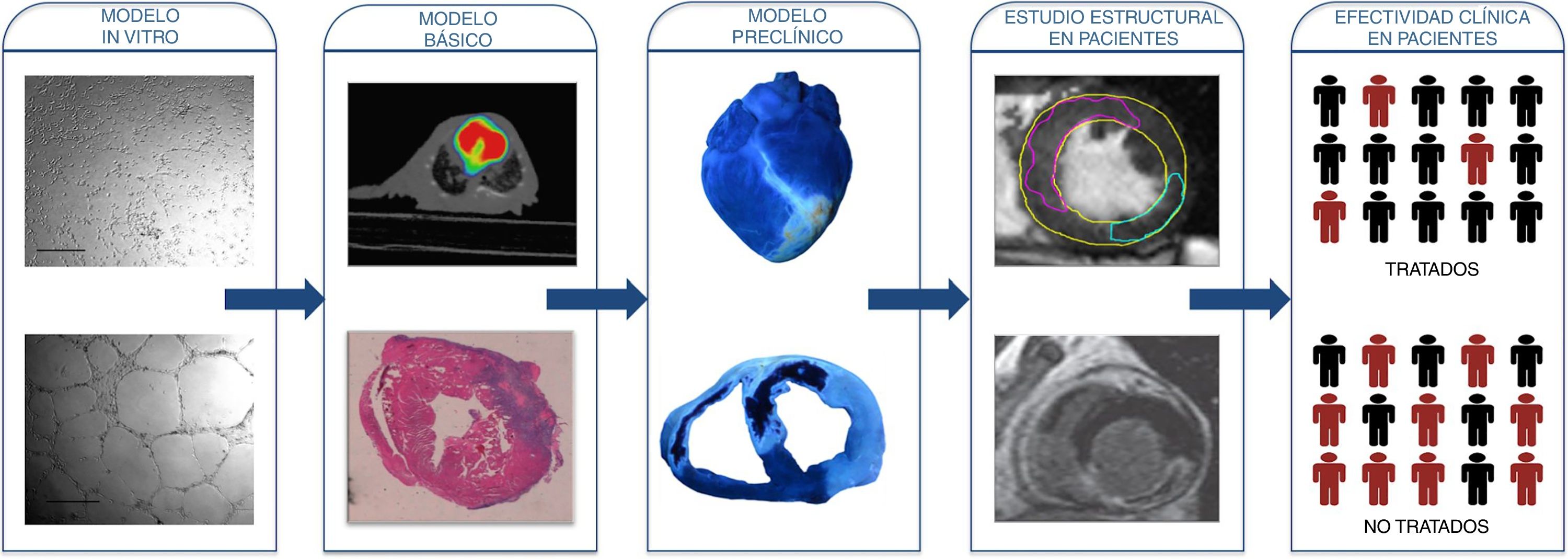
Sin duda, seguirá siendo necesario un importante esfuerzo de investigación para continuar avanzando en el conocimiento y manejo de la OMV. En nuestra opinión, es conveniente iniciar las líneas de investigación en este ámbito mediante el uso de modelos celulares in vitro y de modelos experimentales muy básicos (murino), donde las condiciones sean homogéneas y muy controladas. A continuación, se han de comprobar los resultados en modelos experimentales más cercanos a la práctica clínica (modelo porcino). Finalmente, si una vez superada la investigación básica la idea merece ser analizada en pacientes, se debería empezar por ensayos clínicos enfocados a analizar un eventual beneficio estructural (con la RMC como técnica de imagen de referencia) y con pacientes de perfil muy similar. Probablemente, de cara a dotar de homogeneidad a la investigación, este tipo de estudios incluiría a pacientes con infarto anterior por enfermedad proximal, sin cardiopatía previa, con un tiempo de isquemia no muy corto. Si tras estos ensayos clínicos iniciales la nueva terapia se sigue mostrando efectiva, su uso generalizado aún no sería recomendable; sería el momento de validarla en grandes ensayos clínicos multicéntricos con inclusión consecutiva de pacientes y centrados en la prevención de eventos clínicos mayores (muerte, infarto e insuficiencia cardiaca) (fig. 3).
Este proceso, aunque largo y duro, es el único que nos permitirá superar los conocidos como «valles de la muerte» de la investigación traslacional y aplicar alguna de las grandes ideas obtenidas en la investigación básica al beneficio rutinario de nuestros pacientes en términos de reducción de la OMV.
ConclusionesLa OMV constituye un elemento central en la fisiopatología del IM, ya que su presencia tras la reperfusión condiciona un daño estructural severo y un peor pronóstico clínico. Para su detección, la RMC es la técnica de referencia. A nivel epidemiológico, es clave insistir en la prevención primaria como medida de futuro más rentable en la prevención del IM y de la OMV. A nivel asistencial, a pesar de que, paradójicamente, la reperfusión desempeña un papel en el desarrollo de la OMV, actualmente este es un peaje necesario y la medida más efectiva para minimizar el daño microvascular. Se han investigado múltiples medidas como adyuvantes a la reperfusión para reducir la OMV; más allá de resultados esperanzadores en estudios experimentales o preliminares, ninguna de ellas ha trascendido a la clínica. Por último, debemos poner especial atención a la tendencia fisiológica que muestra nuestro organismo, a diferencia de lo que ocurre con el tejido miocárdico, hacia la reparación espontánea de la microcirculación tras el daño inicial. Un adecuado entendimiento y modulación de este fenómeno podría en el futuro representar una excelente oportunidad terapéutica.
FinanciaciónEl presente estudio fue financiado por el Instituto de Salud Carlos III y cofinanciado por los fondos FEDER (subvenciones PIE15/00013, PI17/01836 y CIBERCV16/11/00486), España.
Conflicto de interesesNinguno.







![Métodos diagnósticos de la obstrucción microvascular (OMV) en pacientes con infarto de miocardio (IM). A) Propensión individual. Las características basales del paciente van a ser decisivas para predecir el riesgo de OMV, entre ellas, la magnitud de los cambios electrocardiográficos, la localización anterior del IM, la presencia de insuficiencia cardiaca, los antecedentes de diabetes o el retraso hasta la reperfusión. B) Índices angiográficos tradicionales. La presencia de oclusión completa (Thrombolysis in Myocardial Infarction [TIMI] = 0) y la enfermedad de la arteria descendente anterior proximal informan de predisposición al daño microvascular. Tras la reperfusión, la velocidad de relleno de la arteria del infarto (índices TIMI y TIMI Frame Count) y la captación de contraste por el miocardio (índices TIMI Myocardial Perfusion Grade y Myocardial Blush Grade). C) Nuevos índices invasivos. Se trata de aproximaciones de perfil más fisiológico basadas en el flujo (como la reserva de velocidad del flujo coronario, el tiempo de deceleración diastólico de la velocidad del flujo coronario o la presencia de inversión sistólica del flujo) o basadas en la resistencia (como los índices de resistencia microvascular o de presión coronaria a flujo cero). D) Electrocardiograma. La presencia de elevación residual del segmento ST en las derivaciones del infarto y la elevación del ST en derivaciones con onda Q durante el esfuerzo (en ausencia de isquemia residual). E) Biomarcadores. La elevación importante y temprana de los marcadores de necrosis (especialmente la troponina) se asocia a una OMV más extensa. F) Leucocitos. En presencia de OMV se observa un incremento grave mediado por células de la inmunidad innata (neutrófilos y monocitos); sin embargo, se detecta una depleción de células de la inmunidad adaptativa y efectora (linfocitos y eosinófilos). G) Ecocardiografía con contraste intracoronario (IC). Esta técnica permitió observar de manera inmediata tras la reperfusión que incluso tras restablecer un flujo TIMI 3 en la arteria responsable podían quedar zonas con OMV. H) Ecocardiografía con contraste intravenoso (IV). Las implicaciones de esta técnica son las mismas que con la inyección IC; su uso es mucho más accesible, aunque evidentemente la calidad de la imagen y la reproducibilidad son menores. I) Resonancia magnética cardiaca (RMC) de primer paso de contraste. Si durante el primer paso del contraste gadolinio (primer minuto tras la inyección) hay un retraso en la llegada a la zona del infarto, esto es indicativo de daño microvascular. Este índice ha sido criticado por su excesiva sensibilidad, ya que aparece alterado en la mayoría de los pacientes. J) RMC con captación tardía de contraste. Tras unos 10 min de la inyección, el contraste queda retenido en la zona del infarto, delimitando con exactitud la zona necrótica que aparece realzada. Si el centro de esta zona infartada (hiperrealzada) no capta contraste (queda negra), indica un daño microvascular muy grave con consecuencias deletéreas en términos de remodelado y pronóstico. Métodos diagnósticos de la obstrucción microvascular (OMV) en pacientes con infarto de miocardio (IM). A) Propensión individual. Las características basales del paciente van a ser decisivas para predecir el riesgo de OMV, entre ellas, la magnitud de los cambios electrocardiográficos, la localización anterior del IM, la presencia de insuficiencia cardiaca, los antecedentes de diabetes o el retraso hasta la reperfusión. B) Índices angiográficos tradicionales. La presencia de oclusión completa (Thrombolysis in Myocardial Infarction [TIMI] = 0) y la enfermedad de la arteria descendente anterior proximal informan de predisposición al daño microvascular. Tras la reperfusión, la velocidad de relleno de la arteria del infarto (índices TIMI y TIMI Frame Count) y la captación de contraste por el miocardio (índices TIMI Myocardial Perfusion Grade y Myocardial Blush Grade). C) Nuevos índices invasivos. Se trata de aproximaciones de perfil más fisiológico basadas en el flujo (como la reserva de velocidad del flujo coronario, el tiempo de deceleración diastólico de la velocidad del flujo coronario o la presencia de inversión sistólica del flujo) o basadas en la resistencia (como los índices de resistencia microvascular o de presión coronaria a flujo cero). D) Electrocardiograma. La presencia de elevación residual del segmento ST en las derivaciones del infarto y la elevación del ST en derivaciones con onda Q durante el esfuerzo (en ausencia de isquemia residual). E) Biomarcadores. La elevación importante y temprana de los marcadores de necrosis (especialmente la troponina) se asocia a una OMV más extensa. F) Leucocitos. En presencia de OMV se observa un incremento grave mediado por células de la inmunidad innata (neutrófilos y monocitos); sin embargo, se detecta una depleción de células de la inmunidad adaptativa y efectora (linfocitos y eosinófilos). G) Ecocardiografía con contraste intracoronario (IC). Esta técnica permitió observar de manera inmediata tras la reperfusión que incluso tras restablecer un flujo TIMI 3 en la arteria responsable podían quedar zonas con OMV. H) Ecocardiografía con contraste intravenoso (IV). Las implicaciones de esta técnica son las mismas que con la inyección IC; su uso es mucho más accesible, aunque evidentemente la calidad de la imagen y la reproducibilidad son menores. I) Resonancia magnética cardiaca (RMC) de primer paso de contraste. Si durante el primer paso del contraste gadolinio (primer minuto tras la inyección) hay un retraso en la llegada a la zona del infarto, esto es indicativo de daño microvascular. Este índice ha sido criticado por su excesiva sensibilidad, ya que aparece alterado en la mayoría de los pacientes. J) RMC con captación tardía de contraste. Tras unos 10 min de la inyección, el contraste queda retenido en la zona del infarto, delimitando con exactitud la zona necrótica que aparece realzada. Si el centro de esta zona infartada (hiperrealzada) no capta contraste (queda negra), indica un daño microvascular muy grave con consecuencias deletéreas en términos de remodelado y pronóstico.](https://static.elsevier.es/multimedia/26051532/0000005400000002/v2_201906220939/S2605153219300305/v2_201906220939/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97tFqh1kTBJPZC4W/at16EQ=)




