Existe evidencia de mayor incidencia de cáncer en pacientes con insuficiencia cardiaca (IC), aunque no hay estudios específicos en la IC con fracción de eyección reducida (ICFEr).
MétodosAnalizamos la evolución y la incidencia de cáncer en pacientes con ICFEr seguidos prospectivamente en una unidad de IC de un hospital no terciario.
ResultadosSe ha seguido a 485 pacientes sin diagnóstico previo de cáncer (mediana de seguimiento 54meses; edad media 66,5±12,5años; varones 79,2%), identificándose 50 nuevos casos de cáncer correspondientes a una tasa de incidencia de 21,5 casos por 1000 personas por año (intervalo de confianza del 95% [IC95%] 20,2-22,6) y una incidencia acumulada de 1.288,6 casos por 100000 personas por año. Comparados con los pacientes sin cáncer, los afectados son más añosos (71,4 frente a 66,0años, p=0,004), presentan más comorbilidad y un origen isquémico de la cardiomiopatía más frecuente (60% frente al 44,4%, p<0,001). En el análisis multivariable ser portador de desfibrilador automático implantable (DAI), tener enfermedad pulmonar obstructiva crónica (EPOC) y el aumento de edad fueron predictores del desarrollo de cáncer. La supervivencia fue menor en los pacientes con cáncer (58% frente al 26,2%, mediana de supervivencia de 57,1±2,2 frente a 78,5±2,2meses; log-rank χ2 16,01; p<0,001) con una mediana de supervivencia desde el diagnóstico del cáncer hasta la muerte de 24,0±6,5meses.
ConclusionesLa incidencia de cáncer en los pacientes con ICFEr es elevada. Su desarrollo está asociado a una mayor edad, ser portador de DAI y a la EPOC.
Evidence linking heart failure (HF) with a higher incidence of cancer has been suggested previously. However, there are no studies that only include patients with HF and reduced ejection fraction (HFrEF).
MethodsTo assess outcomes and incidence of cancer in patients with HFrEF followed prospectively in the HF Unit of a Spanish hospital.
ResultsThe study included a total of 485 patients with HFrEF and with no previous diagnosis of cancer were followed-up (median 54months, 79.2% men, mean age 66.5±12.5years [median 69]). A total of 50 new cases of cancer were identified, corresponding to an incidence rate of 21.5 per 1000 persons per year [95% confidence interval (CI) 20.2-22.6] and a cumulative incidence of 1288.6 cases per 100 000 persons per year. Compared with patients that do not have cancer in the follow-up, they are older (71.4 vs 66.0years, P=.004), an ischaemic origin of cardiomyopathy is more frequent (60% vs 44.4%, P<.001), and have more comorbidity. Chronic obstructive pulmonary disease (COPD), increasing age, and being a carrier of an implantable cardioverter defibrillator (ICD), were predictors of developing cancer in the multivariate analysis. Survival was lower in patients with a diagnosis of cancer (58% vs 26.2%, survival median of 57.1±2.2 vs 78.5±2.2months, respectively; log rank test χ2; 16.01; P<.001) with a survival median from cancer diagnosis to death of 24.0±6.5months.
ConclusionsIncidence of cancer in patients with HFrEF is high. Its development is associated with COPD, increasing age and being an ICD carrier.
En los últimos años, varios estudios poblacionales han descrito una mayor incidencia de cáncer en pacientes con insuficiencia cardiaca (IC)1-3. Sin embargo, estos estudios no diferencian entre IC con fracción de eyección conservada o IC con fracción de eyección reducida (ICFEr), lo que puede ser relevante, ya que ambas condiciones parecen ser dos entidades clínicas diferentes4. También se desconoce si realmente existe una relación causal entre la ICFEr y la incidencia de cáncer, o simplemente existe un sesgo de oportunidad de diagnóstico frente a la población general, al ser cada vez mayores la prevalencia y la supervivencia de los pacientes con ICFEr y existir un seguimiento más regular de estos pacientes que posibilita una mayor probabilidad de detectar la enfermedad maligna5. Sin embargo, también es cierto que el cáncer y la IC comparten tanto factores de riesgo como vías fisiopatológicas comunes6 (ya sean conocidas, como la inflamación o el estrés oxidativo7, o todavía por definir, como la secreción de factores de crecimiento tumorales8) que podrían contribuir a su desarrollo. Por todo ello, desde distintas sociedades científicas se ha hecho un llamamiento para una mejor caracterización de la relación de ambas enfermedades5. Con nuestro trabajo pretendemos analizar y caracterizar la incidencia de cáncer en pacientes con ICFEr seguidos prospectivamente en una unidad de IC de un hospital no terciario.
MétodosDiseño del estudioEn este estudio se analiza la evolución de los pacientes afectados de ICFEr seguidos de manera prospectiva en la unidad de IC del Hospital Mancha Centro, en Alcázar de San Juan (Ciudad Real), en función de la incidencia de cáncer durante el seguimiento. En el estudio se ha incluido a todos los pacientes seguidos consecutivamente en la unidad desde su implementación el 1 de enero de 2010 hasta el 31 de diciembre de 2018. El criterio para recibir seguimiento en la unidad es presentar IC sintomática por disfunción sistólica significativa del ventrículo izquierdo (definida como una fracción de eyección medida por ecocardiografía transtorácica igual o menor al 40%) tras una primera descompensación de IC que motive visita a urgencias hospitalarias o ingreso. Nuestra unidad pertenece a un hospital no terciario que atiende a una población de 234.283habitantes9 y está formada por dos cardiólogos y una enfermera dedicados a tiempo parcial a la atención de estos pacientes.
La principal variable de valoración fue la incidencia de nuevos casos de cáncer. Se consideró cáncer todo diagnóstico de tumor maligno, a excepción de los de piel de origen no melanocítico. Se tomaron en consideración para el análisis solo los diagnósticos realizados durante el periodo de tiempo citado, excluyendo del análisis a los pacientes que presentaban el diagnóstico de cáncer antes de ser seguidos en la unidad de IC o en los que la IC fuese secundaria a la toxicidad de la quimioterapia empleada como tratamiento del cáncer. En el seguimiento también se recogieron datos de mortalidad total y mortalidad relacionada con IC, y se clasificó como no disponibles a los pacientes perdidos para el seguimiento. Todos los eventos fueron identificados a partir de la historia clínica digitalizada de cada paciente, donde se recogen todos los actos clínicos acontecidos en cualquier punto de atención del servicio de salud de Castilla-La Mancha.
Análisis estadísticoEl análisis estadístico se ha llevado a cabo con el programa estadístico SPSS18.0 y STATA14.2. Las variables cuantitativas se expresan como media ±desviación estándar (o mediana, cuando es apropiado) y las cualitativas, como porcentajes. Las comparaciones entre las variables categóricas se realizaron mediante la prueba de la χ2 de Pearson y para las variables continuas la prueba de la t de Student. El análisis de supervivencia se ha llevado a cabo con el método de Kaplan-Meier. En el análisis de la incidencia de neoplasias durante el seguimiento se ha tomado en consideración que su desarrollo podía verse afectado por la muerte del paciente y, por consiguiente, las técnicas habituales de análisis de tiempo para evaluar su incidencia y predictores habrían podido inducir un posible sesgo por la presencia de eventos competitivos, por lo que para evitarlos se llevó a cabo un análisis de riesgos competitivos según la metodología recomendada por Fine y Gray10,11. Los resultados del análisis multivariante se presentan como hazard ratio de subdistribución (sHR) con sus correspondientes intervalos de confianza del 95% [IC95%]. Se ha considerado significativa una p<0,05.
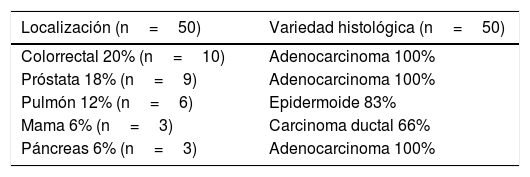
ResultadosDurante el periodo descrito en nuestra unidad se ha seguido a 485 pacientes sin diagnóstico previo de cáncer (mediana de seguimiento 50meses) con una edad media de 66,5±12,5años (mediana 69, rango 23-91), siendo varones el 79,3%. En total, 50 nuevos casos de cáncer se diagnosticaron durante el seguimiento, que corresponden a una tasa de incidencia de 21,5 casos por 1.000 personas por año (IC95%: 20,2-22,6) y una incidencia acumulada de 1.288.6 casos por 100.000 personas por año. La mediana de tiempo desde el diagnóstico de IC al de cáncer fue de 48meses (rango intercuartílico 24-72). Desde el punto de vista histopatológico, el adenocarcinoma fue el tipo de cáncer más frecuentemente diagnosticado, principalmente de localización colorrectal y de próstata, aunque en localización pulmonar la mayoría de las neoplasias detectadas fueron epidermoides (tabla 1). En cuanto al grado de progresión de la neoplasia, al diagnóstico el 55% de ellas estaban en estadioiv, 13 8% en estadioiii y el porcentaje restante en estadios iniciales.
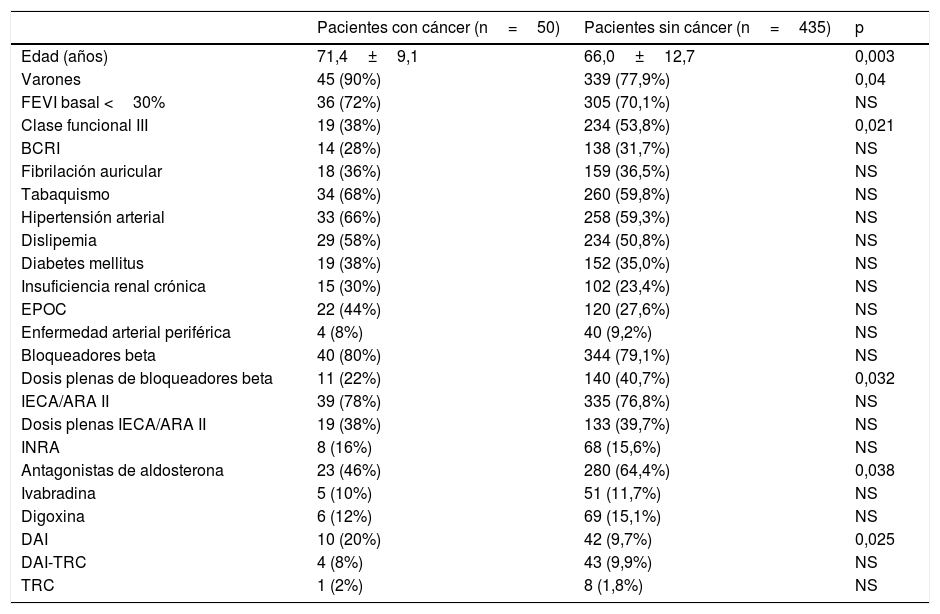
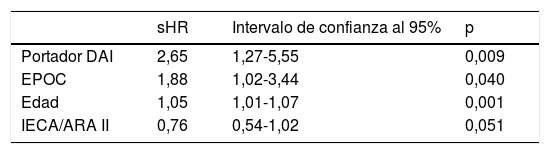
Las características basales de la muestra se describen en la tabla 2, existiendo diferencias entre los pacientes en función del diagnóstico de cáncer. Los pacientes afectados de cáncer eran principalmente hombres (90%) y, comparados con los que no estaban afectados, eran más añosos (71,4 frente a 66,0años, p=0,003), tenían un origen isquémico de la cardiomiopatía más frecuente (60% frente al 44,4%, p<0,001) y presentaban más comorbilidad (tabaquismo 68,7% frente al 59,8%, p=0,04; hipertensión arterial 66,5% frente al 59,3%, p=0,03; insuficiencia renal crónica 30,0% frente al 23,4%, p=0,05, y EPOC 44,1% frente al 27,6%, p <0,001). No hubo diferencias en cuanto a la clase funcional, la fracción de eyección y la tasa de bloqueo completo de rama izquierda. En cuanto al tratamiento específico para la ICFEr, hubo el mismo porcentaje de uso de los diferentes fármacos en ambos grupos salvo los antagonistas de la aldosterona, que se utilizaron más en los pacientes que no desarrollaron cáncer. El número de implantes de dispositivos electrónicos (desfibrilador automático implantable/terapia de resincronización cardiaca [DAI/TRC]) fue mayor en los pacientes que desarrollaron cáncer en el seguimiento. De hecho, en el análisis multivariante ser portador de DAI fue un predictor independiente de una mayor incidencia de cáncer, como el aumento de edad y tener EPOC (tabla 3).
Características basales y pautas de tratamiento
| Pacientes con cáncer (n=50) | Pacientes sin cáncer (n=435) | p | |
|---|---|---|---|
| Edad (años) | 71,4±9,1 | 66,0±12,7 | 0,003 |
| Varones | 45 (90%) | 339 (77,9%) | 0,04 |
| FEVI basal <30% | 36 (72%) | 305 (70,1%) | NS |
| Clase funcional III | 19 (38%) | 234 (53,8%) | 0,021 |
| BCRI | 14 (28%) | 138 (31,7%) | NS |
| Fibrilación auricular | 18 (36%) | 159 (36,5%) | NS |
| Tabaquismo | 34 (68%) | 260 (59,8%) | NS |
| Hipertensión arterial | 33 (66%) | 258 (59,3%) | NS |
| Dislipemia | 29 (58%) | 234 (50,8%) | NS |
| Diabetes mellitus | 19 (38%) | 152 (35,0%) | NS |
| Insuficiencia renal crónica | 15 (30%) | 102 (23,4%) | NS |
| EPOC | 22 (44%) | 120 (27,6%) | NS |
| Enfermedad arterial periférica | 4 (8%) | 40 (9,2%) | NS |
| Bloqueadores beta | 40 (80%) | 344 (79,1%) | NS |
| Dosis plenas de bloqueadores beta | 11 (22%) | 140 (40,7%) | 0,032 |
| IECA/ARA II | 39 (78%) | 335 (76,8%) | NS |
| Dosis plenas IECA/ARA II | 19 (38%) | 133 (39,7%) | NS |
| INRA | 8 (16%) | 68 (15,6%) | NS |
| Antagonistas de aldosterona | 23 (46%) | 280 (64,4%) | 0,038 |
| Ivabradina | 5 (10%) | 51 (11,7%) | NS |
| Digoxina | 6 (12%) | 69 (15,1%) | NS |
| DAI | 10 (20%) | 42 (9,7%) | 0,025 |
| DAI-TRC | 4 (8%) | 43 (9,9%) | NS |
| TRC | 1 (2%) | 8 (1,8%) | NS |
ARA II: antagonistas del receptor de angiotensina; BCRI: bloqueo completo de rama izquierda; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima convertidora de la angiotensina; INRA: inhibidores de neprilisin receptor de angiotensina; TRC: terapia de resincronización cardiaca.
Variables asociadas a desarrollo de cáncer en el análisis multivariante
| sHR | Intervalo de confianza al 95% | p | |
|---|---|---|---|
| Portador DAI | 2,65 | 1,27-5,55 | 0,009 |
| EPOC | 1,88 | 1,02-3,44 | 0,040 |
| Edad | 1,05 | 1,01-1,07 | 0,001 |
| IECA/ARA II | 0,76 | 0,54-1,02 | 0,051 |
ARA II: antagonistas del receptor de angiotensina; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidores de la enzima convertidora de la angiotensina; sHR: hazard ratio de subdistribución.
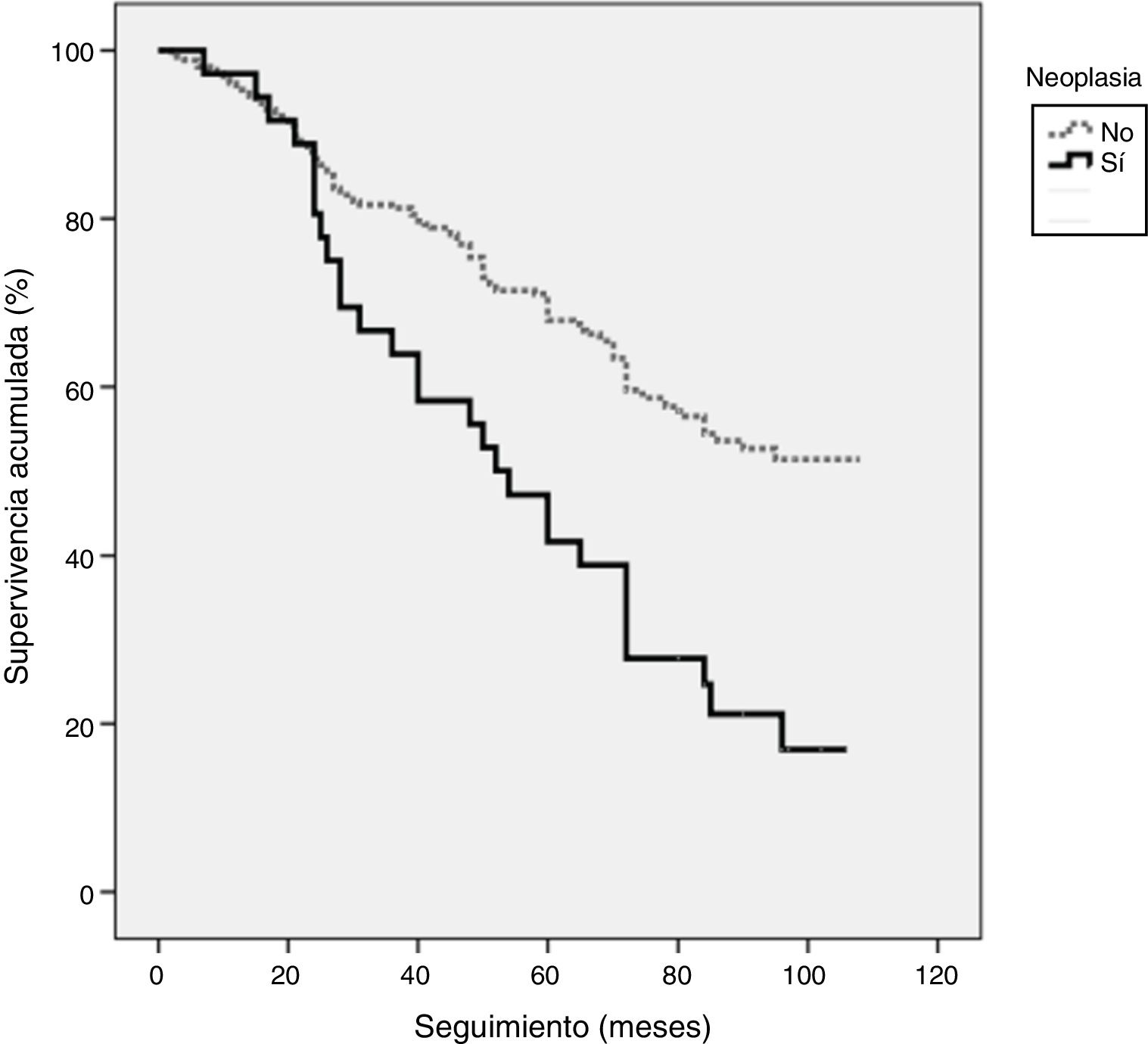
En la evolución, 15 pacientes (3,1%) perdieron el seguimiento y 143 (29,5%) fallecieron. La mortalidad total fue mayor en los pacientes con cáncer (58% frente al 26,2%, p<0,001), con una mediana de supervivencia de 57,1±2,2 frente a 78,5±2,2meses, respectivamente; log-rank χ2 16,01, p<0,001 (fig. 1). En los pacientes afectados de cáncer la mediana de supervivencia desde el diagnóstico de la enfermad maligna hasta la muerte fue de 24,0±6,5meses. Respecto a la etiología, la principal causa de muerte en el grupo de pacientes con diagnóstico de cáncer fue la propia neoplasia (81,9% de los casos), mientras que en el grupo de pacientes libres de enfermedad fueron principalmente secundarias a la IC (IC terminal/refractaria en el 42,1% de los casos y muerte súbita cardiaca en el 16,6%) (tabla 4).
Supervivencia acumulada representada mediante curvas de Kaplan-Meier del total de la muestra en función del diagnóstico de cáncer. Mediana de supervivencia en pacientes con cáncer 57,1±2,2meses (IC95%: 46,8-67,4) frente a 78,5±2,2meses (IC95%: 74,1-82,9) en pacientes sin cáncer. Log-rank χ2 16,01 (p<0,001) para la diferencia de mortalidad entre los 2 grupos.
Causas de mortalidad
| Etiología | Pacientes con cáncer (n=29) | Pacientes sin cáncer (n=114) | p |
|---|---|---|---|
| IC terminal/refractaria | 2 (6,9%) | 48 (42,1%) | <0,001 |
| MSC | 1 (3,4%) | 19 (16,6%) | <0,001 |
| Ictus | 1 (3,4%) | 9 (7,9%) | <0,001 |
| Neoplásica | 24 (81,9%) | 0 (0,0%) | |
| Infecciosa | 1 (3,4%) | 15 (13,5%) | <0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; MSC: muerte súbita cardiaca.
Nuestro trabajo describe la incidencia de cáncer en pacientes con ICFEr a partir de una cohorte de pacientes seguidos de manera prospectiva en una unidad de IC de un hospital no terciario. En nuestro trabajo dicha incidencia es similar a la descrita previamente5, con la salvedad de que en trabajos anteriores se incluyeron pacientes tanto con ICFEr como con IC con fracción de eyección preservada4. En el trabajo de Banke et al.1, donde se analiza de manera retrospectiva la incidencia de cáncer en 9.307 pacientes con IC incluidos en el registro danés de IC, el 89,3% presentaban fracción de eyección del ventrículo izquierdo <45%, sin especificarse el grado de disfunción sistólica ni el tiempo de evolución o estado evolutivo de la IC. La misma incidencia y riesgo de desarrollar cáncer ha sido descrita en un trabajo con 596 americanos afectados de IC2, de los cuales solo se recoge la información relativa a la fracción de eyección del ventrículo izquierdo en 368, y de estos, solo el 56% presentaban una fracción de eyección del ventrículo izquierdo <50%. Al igual que en estos trabajos, la incidencia de cáncer documentada en nuestros pacientes con ICFEr es superior a la de la población general; según se describe en el registro español de cáncer publicado en el último informe sobre la situación del cáncer en España12, la incidencia acumulada en la población general española es de 714,4 casos por 100.000 personas/año frente a los 1.288,6 casos por 100.000 personas/año de nuestra cohorte. Pese a la imposibilidad de realizar una comparación directa entre las dos poblaciones, al no ser dos muestras pareadas y aleatorizadas, con las consiguientes limitaciones para extraer una conclusión válida que eso conlleva, sí parece existir un riesgo aumentado de desarrollo de cáncer en pacientes con ICFEr frente a la población general.
En nuestro estudio el incremento de edad, la presencia de EPOC y ser portador de DAI se han detectado como predictores de desarrollo de cáncer. Previamente también se ha descrito una asociación entre diferentes factores de riesgo cardiovascular, como el tabaquismo y la presencia de comorbilidades como la cardiopatía isquémica, la enfermedad renal crónica o la propia EPOC y el desarrollo de cáncer en pacientes con IC, aunque sin definirse con seguridad si son realmente predictores de riesgo para el desarrollo de la neoplasia o simplemente factores de riesgo asociados a ambas enfermedades, al compartir vías fisiopatológicas comunes como la inflamación y el estrés oxidativo6-8. Igualmente, existe mucha controversia sobre la posible asociación patogénica de los tratamientos que se usan en la IC (especialmente con los fármacos bloqueantes del sistema renina-angiotensina13) y el cáncer, dados los resultados contradictorios de diferentes estudios observacionales y metaanálisis de ensayos con dichos fármacos en pacientes con diferentes patologías cardiovasculares5. En nuestro análisis, con el uso de inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensinaii (IECA/ARAII) hubo una tendencia no significativa a una menor incidencia de cáncer, siendo neutro el efecto del resto de fármacos, lo que apoyaría teorías propuestas previamente en las que se postula un efecto protector de estos fármacos frente al desarrollo de cáncer al bloquear el receptor de angiotensina tipoi, receptor cuya activación, a su vez, estimula la activación celular, la angiogénesis y la inflamación14.
La evolución de los pacientes que desarrollan cáncer de nuestra muestra, al igual que lo descrito previamente5, es más desfavorable, con una supervivencia menor que el resto de los pacientes con IC. En este sentido, aun siendo un hallazgo débil, dado el riesgo proporcional detectado, es llamativo que hubiera una asociación predictora de desarrollo de cáncer en los pacientes portadores de dispositivos electrónicos, un hallazgo difícil de interpretar y que quizá podría vincular una peor evolución clínica de la ICFEr con una mayor incidencia de neoplasias, ya que estos dispositivos suelen indicarse en caso de no mejoría clínica bajo tratamiento médico y, por lo tanto, es un hallazgo que podría tenerse en cuenta a la hora de plantear futuros estudios de investigación y explorar posibles mecanismos fisiopatológicos comunes entre fases avanzadas de la ICFEr y el cáncer8. Por otro lado, al igual que ocurría con la incidencia de las neoplasias, la comparación directa de la mortalidad y el pronóstico del cáncer en nuestra población frente a la mortalidad por cáncer descrita en la población general12 está limitada, al ser dos muestras diferentes, por lo que no se pueden extraer conclusiones al respecto.
Desde el punto de vista oncológico, es significativa la mayor incidencia de adenocarcinomas frente a otros tipos de tumores en nuestra muestra. Previamente se ha descrito la asociación de la IC con más incidencia de prácticamente todos los tumores sólidos, aunque sin precisar la variedad histopatológica de ellos, por lo que nuestros hallazgos —en caso de confirmarse en estudios con muestras más amplias— podrían ser la base para abrir nuevas hipótesis de trabajo sobre mecanismos patogénicos de la IC involucrados en el desarrollo de cáncer sobre el epitelio glandular. También es llamativa la baja supervivencia de los pacientes con cáncer una vez se detecta la enfermedad, lo que se podría explicar por la alta tasa de diagnósticos de la enfermedad en estadios evolutivos avanzados, tanto de la IC como del propio cáncer. En este sentido, la mayoría de pacientes a los que se detectó la neoplasia fallecieron por la propia enfermedad maligna, al contrario de lo que ocurre con el resto de los pacientes seguidos en la unidad, que lo hicieron por causas cardiovasculares o por la propia IC. Aunque nuestro análisis de mortalidad presenta la limitación de no poder discriminar entre la competitividad temporal y la posible relación exacta entre una causa de muerte (cardiovascular o relacionada con la IC) frente a otra (de origen no cardiovascular) y su relación causal exacta con el cáncer, esta alta mortalidad en el grupo de pacientes con cáncer nos ofrece otro dato más sobre el ya conocido peso pronóstico de la pluripatología y la comorbilidad en los pacientes con ICFEr, y pone de manifiesto la importancia de intentar detectarla y tratarla correctamente de la manera más precoz posible15. De la misma manera, esta observación sería contraria a hipótesis planteadas en publicaciones previas que asociaban una mayor incidencia de cáncer en pacientes con IC con el «oportunismo diagnóstico», al estar estos pacientes sometidos a un seguimiento más estrecho del que se realiza a la población general5. Además, al igual que en el trabajo de Banke et al.1, la mediana de tiempo entre el inicio de la IC y el diagnóstico del cáncer es de 4años, lo que indica un riesgo persistente para el desarrollo del cáncer una vez superada la primera fase de seguimiento de estos pacientes, donde se lleva a cabo una evaluación diagnóstica más intensiva y se realizan más visitas médicas para titular la medicación.
Por otro lado, los autores somos conscientes de las limitaciones que presenta nuestro trabajo, y resaltamos que el objetivo del mismo es meramente descriptivo. Las más importantes de esas limitaciones son las secundarias al tamaño muestral relativamente pequeño presentado y las intrínsecas a un estudio observacional realizado en un único centro y en una unidad de IC manejada únicamente por cardiólogos, con el sesgo de selección que eso conlleva a la hora de incluir pacientes en el registro, así como que, al ser descriptivo el objetivo del estudio, carecemos de información para poder extraer conclusiones sobre mecanismos involucrados en el desarrollo del cáncer y en la mortalidad. De hecho, el análisis estadístico de la mortalidad carece de los ajustes necesarios para compensar los efectos de una variable como la incidencia de cáncer, que puede variar a lo largo del tiempo. Del mismo modo, los datos de la evolución deben tenerse en cuenta desde el momento en que los pacientes fueron incluidos en el seguimiento, que es cuando debutaron con IC clínica, por lo que desconocemos el tiempo de evolución y las características de la enfermedad durante el periodo subclínico. En este sentido, y en relación con la incidencia de cáncer, al inicio del seguimiento de los pacientes sin diagnóstico previo de cáncer no se realizó ningún tipo de cribado diagnóstico que pudiera haber permitido detectar la enfermedad en ese momento, por lo que es posible que la incidencia durante el seguimiento pueda estar sobreestimada. Igualmente, carecemos de un grupo comparador de las mismas características demográficas que nuestra muestra para evaluar con más precisión su evolución y pronóstico. Por último, queremos remarcar limitaciones metodológicas intrínsecas a un hospital no terciario, como carecer de información seriada de biomarcadores relacionados tanto con la IC como con la enfermedad oncológica, motivo por el cual no se han incluido en el análisis.
ConclusionesLa incidencia de cáncer en los pacientes con ICFEr es elevada, y su desarrollo se asocia a una mayor edad, ser portador de DAI y la EPOC. Investigaciones futuras deberán confirmar su historia natural, definir los mecanismos patogénicos asociadas a su mayor incidencia en la ICFEr y establecer potenciales dianas terapéuticas para su tratamiento.
Es conocida una mayor incidencia de cáncer en pacientes con IC, aunque todavía no se ha caracterizado su relación fisiopatológica exacta y si existen diferencias epidemiológicas según la función sistólica ventricular izquierda. Igualmente, parece que los pacientes afectados de IC que desarrollan cáncer tienen peor pronóstico, pero tampoco es bien conocida su relación temporal y la influencia en el pronóstico de una enfermedad sobre otra.
¿Qué novedades aporta?Nuestro trabajo confirma que existe más incidencia de cáncer en pacientes con ICFEr que en la población general. Además, describimos que este mayor diagnóstico se observa principalmente en estadios avanzados de la IC, algo contrario a hipótesis previas en las que se especula sobre un posible sesgo de oportunismo en el diagnóstico al ser seguidos más activamente los pacientes con IC que la población general. Por último, nuestro trabajo, a diferencia de trabajos previos, muestra que la principal variedad histopatológica de cáncer asociada con la ICFEr son los adenocarcinomas.
Los autores declaran no tener ningún conflicto de intereses.
Queremos agradecer la colaboración para la realización del cálculo estadístico a Ángel Arias y José María Tenías, compañeros del departamento de investigación, docencia y formación de nuestro centro.