La hipotensión arterial es el efecto secundario más frecuente del sacubitrilo/valsartán (SV), lo que puede dificultar su uso en la práctica clínica. Nuestro objetivo fue analizar el impacto de la presión arterial sistólica (PAS) en el tratamiento y pronóstico de los pacientes con insuficiencia cardiaca.
MétodosRegistro prospectivo y multicéntrico de pacientes ambulatorios que iniciaron tratamiento con SV. Se agrupó a los pacientes en función de la PAS basal y se analizaron las características iniciales, las dosis de SV y los eventos durante el seguimiento.
ResultadosSe incluyó a 427 pacientes, 129 (30,2%) con una PAS <110mmHg, 174 (40,7%) entre 110 y 130mmHg y 124 (29%) ≥ 130mmHg. Se realizó un seguimiento de 7±1 meses, donde la hipotensión arterial fue el efecto adverso más frecuente (26,2%, 20,2% y 22,4% respectivamente; p = 0,562), independientemente de la PAS basal. Los pacientes con PAS inicial más baja alcanzaron dosis más bajas de SV al final del seguimiento (dosis máxima: 12,1%, 27,6% y 25,8%; p = 0,05), sin diferencias en la suspensión de tratamiento (15,5%, 8,1% y 11,3%; p = 0,09) ni en la aparición de eventos clínicos adversos (28,9%, 23,6% y 27,1%; p = 0,482). La PAS inicial no se asoció de forma independiente con la mortalidad (HR = 0,77; IC95%, 0,33-1,80).
ConclusionesLa hipotensión arterial es el efecto adverso más frecuente en pacientes con insuficiencia cardiaca tratados con SV en vida real. La PAS inicial se asocia a la dosis alcanzada pero no a la tasa de retirada de SV ni al pronóstico.
Arterial hypotension is the most common side effect of sacubitril/valsartan (SV), making it difficult to manage in clinical practice. Our objective was to analyze the impact of systolic blood pressure (SBP) on heart failure patients’ management and prognosis.
MethodsA prospective registry of outpatients who began treatment with SV was performed. Patients were classified according to baseline SBP. Baseline characteristics, SV doses, and clinical events were analyzed during follow-up.
ResultsA total of 427 patients were included, 129 (30.2%) with a SBP <110mmHg, 174 (40.7%) between 110 and 130mmHg, and 124 (29%) ≥ 130mmHg. A follow-up of 7±1 months was performed. Arterial hypotension was the most frequent adverse effect (26.2%, 20.2%, and 22.4% respectively; P = .562), regardless of baseline SBP. Patients with a lower baseline SBP achieved lower doses of SV at the end of follow-up (maximum dose: 12.1%, 27.6%, and 25.8%, P = .05). No differences were observed in the withadrawal of treatment (15.5%, 8.1% and 11.3%, P = .09) or in the appearance of adverse clinical events (28.9%, 23.6%, and 27.1%; P = .482) based on the initial SBP. Baseline SBP was not independently associated with mortality (HR, 0.77; 95%CI, 0.33-1.80).
ConclusionsArterial hypotension is the most frequent adverse effect in patients with heart failure treated with SV in real life. The initial SBP is associated with the dose achieved but not with the rate of SV withdrawal or prognosis.
La insuficiencia cardiaca (IC) es un síndrome clínico con una elevada morbimortalidad, aunque su pronóstico ha mejorado con la aparición de nuevos fármacos y dispositivos1. Uno de los fármacos que se han incorporado al algoritmo terapéutico de la IC con fracción de eyección reducida (ICFEr) es el sacubitrilo/valsartán (SV) que demostró en el ensayo PARADIGM-HF (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure) una reducción del 20% del objetivo combinado de muerte cardiovascular e ingreso por IC frente a enalapril en pacientes sintomáticos con ICFEr2.
El SV es un fármaco dual que inhibe la neprilisina, encargada de la degradación de los péptidos natriuréticos, y el receptor de la angiotensina II. Debido a su efecto vasodilatador, el efecto secundario más frecuentemente asociado a su uso es la hipotensión arterial (HA), que, si bien no supone una mayor tasa de retirada del fármaco2, puede dificultar su manejo en la práctica clínica y aumentar las consultas médicas. El inicio del fármaco en pacientes con presión arterial sistólica (PAS) por encima de 100mmHg y la titulación progresiva en pacientes con riesgo de HA, han demostrado ser estrategias que permiten mantener el tratamiento, incluso tras un episodio de descompensación3–5. Por otro lado, los pacientes con cifras bajas de PAS no se han incluido en los ensayos clínicos y la suspensión de SV en la vida real se ha relacionado con una mayor mortalidad6,7.
Nuestro objetivo fue estudiar el impacto de la PAS basal en el tratamiento y el pronóstico de los pacientes tratados con SV.
MétodosRegistro observacional prospectivo y multicéntrico llevado a cabo en 10 hospitales de la Comunidad de Madrid que incluyó de manera secuencial a los pacientes mayores de 18 años que empezaron tratamiento con SV en la práctica clínica de manera ambulatoria entre octubre de 2016 y marzo de 2017. La prescripción de SV se hizo siguiendo las recomendaciones de las guías de práctica clínica8. Los criterios de exclusión fueron: inicio del tratamiento durante el ingreso hospitalario y el rechazo a firmar el consentimiento informado. El seguimiento de los pacientes se realizó durante una media de 7 meses mediante visitas rutinarias en consulta o a través de contacto telefónico.
Los pacientes se clasificaron en función de las cifras de PAS basal: <110mmHg; ≥ 110 y <130mmHg; y ≥ 130mmHg. Los puntos de corte se establecieron con el objetivo de conseguir una distribución homogénea de cada uno de los grupos y basándose en trabajos con un mayor tamaño muestral5. Para cada categoría se evaluaron las siguientes variables: a) edad y sexo; b) factores de riesgo cardiovascular: hipertensión arterial, diabetes, cardiopatía isquémica; c) fracción de eyección del ventrículo izquierdo estimada mediante el método Simpson y clase funcional de la New York Heart Association; d) presión arterial y frecuencia cardiaca; e) parámetros de laboratorio en el momento de la inclusión: creatinina, tasa de filtrado glomerular estimado, potasio y la porción de la fracción aminoterminal del propéptido natriurético cerebral (tipo B); f) tratamiento previo: inhibidores de la enzima de conversión de la angiotensina (IECA), antagonistas del receptor de la angiotensina II (ARA-II), bloqueadores beta, antagonistas del receptor mineralocorticoide, desfibrilador automático implantable y terapia de resincronización cardiaca; g) ingresos en los 6 meses previos; h) parámetros al final del registro: fracción de eyección del ventrículo izquierdo, presión arterial, frecuencia cardiaca, creatinina sérica, tasa de filtrado glomerular estimado, fracción aminoterminal del propéptido natriurético cerebral (tipo B), clase funcional de la New York Heart Association. Durante el seguimiento se recogió la aparición de eventos adversos: a) fallecimiento por cualquier causa y por causa cardiovascular y hospitalización; b) efectos adversos relacionados con SV (establecidos en PARADIGM-HF y TITRATION)2,5: HA (PAS ≤ 95mmHg o PAS sintomática); hiperpotasemia (potasio> 5,5 mEq/l); deterioro de la función renal (enfermedad renal terminal, disminución de ≥ 50% de la tasa de filtrado glomerular estimado basal o tasa de filtrado glomerular estimado <30ml/min); y angioedema; c) aspectos relacionados con el ajuste de la dosis: dosis de inicio, dosis máxima tolerada y suspensión del fármaco. La modificación de la dosis o la suspensión de SV se llevaron a cabo según el criterio del médico tratante, los protocolos locales y las recomendaciones clínicas2,8.
Este estudio cumple con la Declaración de Helsinki y se aprobó por los comités de Ética e Investigación Clínica de los hospitales participantes. Todos los participantes firmaron el consentimiento informado para su inclusión en el estudio.
Análisis estadísticoLas variables cuantitativas se muestran como media±desviación estándar (o mediana y rango intercuartílico), y las categoriales como frecuencia y porcentajes. Las variables cuantitativas continuas se compararon utilizando el test de la t de Student (comparativa de medias de 2 grupos) y ANOVA (más de 2 grupos), o el test de Wilcoxon para datos no paramétricos. Para la comparación de las variables categoriales se utilizó el test de χ2 (comparativa de 2 variables) o el test exacto de Fisher (cuando las frecuencias teóricas incluyen frecuencias <5) y McNemar para los datos emparejados. Se utilizó la corrección de Bonferroni para las comparaciones múltiples. Se estableció un nivel de significación estadística de 0,05 (bilateral) para todos los test estadísticos.
El análisis de supervivencia se realizó según el método Kaplan-Meier. Se realizó un modelo de regresión de riesgos proporcionales de Cox para analizar los predictores independientes de mortalidad en el seguimiento. Tanto el modelo de regresión logística como el de Cox se ajustaron en función de: edad, sexo, historia de cardiopatía isquémica, tratamiento previo con IECA/ARA-II, bloqueadores beta o antagonistas del receptor mineralocorticoide, tasa de filtrado glomerular estimado antes del tratamiento, PAS al inicio del estudio y la continuidad con SV. Las variables se seleccionaron entre las que tenían una mayor repercusión clínica y las que tuvieron una mayor significación en el análisis univariado. Para ello se utilizó el modelo de inclusión y exclusión secuencial, con un corte de inclusión de p <0,05 y exclusión p> 0,1. El análisis se realizó con STATA 14.0 (Stata Corporation, College Station, TX, Estados Unidos).
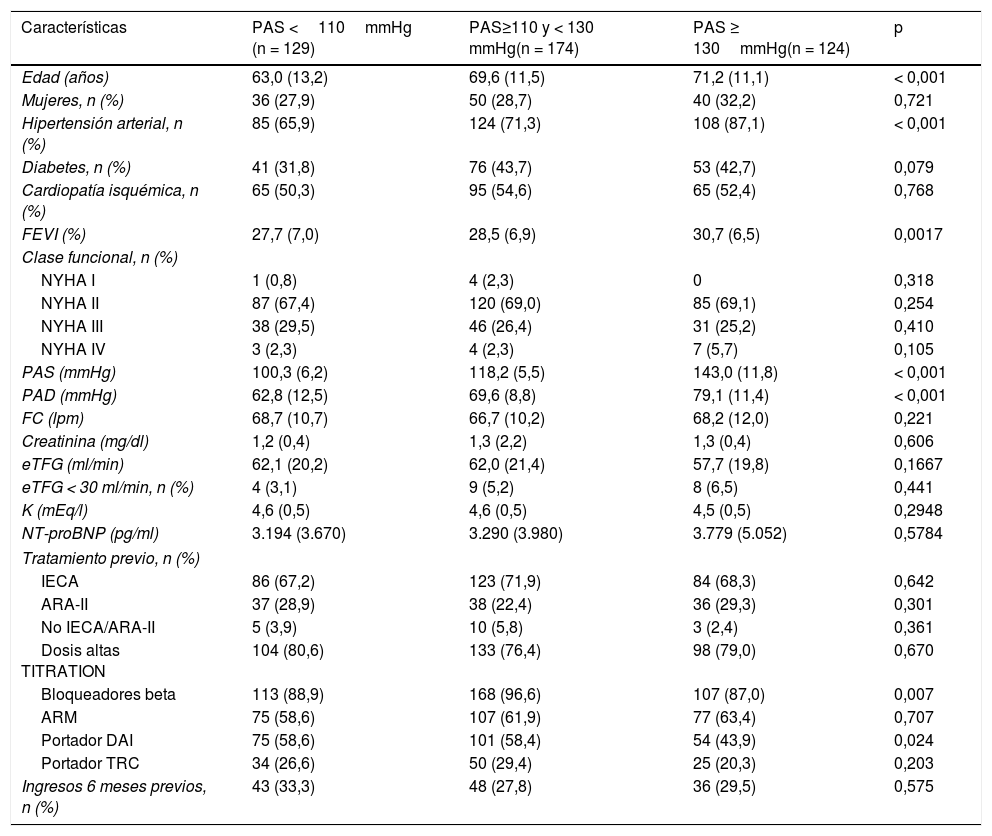
ResultadosSe incluyó a 427 pacientes (edad media 68,1±12,4 años; 29,5% mujeres). De ellos, 129 tenían una PAS inicial <110mmHg (30,2%); 174 entre 110 y 130mmHg (40,7%), y ≥ 130mmHg 124 (29%). Como se muestra en la tabla 1, los pacientes con cifras de PAS más elevadas al inicio del registro eran más mayores, con historia de hipertensión arterial y una fracción de eyección del ventrículo izquierdo basal más elevada. Sin embargo, tenían una menor tasa de uso de bloqueadores beta y con menor frecuencia eran portadores de desfibrilador automático implantable. La mayoría de los pacientes estaban en clase funcional de la New York Heart Association II al inicio del registro, independientemente de la PAS inicial. Se observó una mejoría de la clase funcional en todos los grupos al final del seguimiento, especialmente en los que tenían una PAS basal más elevada, que a su vez alcanzaron dosis mayores al final del seguimiento (tabla 2).
Características de los pacientes que iniciaron tratamiento con sacubitrilo/valsartán en función de la presión arterial basal
| Características | PAS <110mmHg (n = 129) | PAS≥110 y < 130 mmHg(n = 174) | PAS ≥ 130mmHg(n = 124) | p |
|---|---|---|---|---|
| Edad (años) | 63,0 (13,2) | 69,6 (11,5) | 71,2 (11,1) | < 0,001 |
| Mujeres, n (%) | 36 (27,9) | 50 (28,7) | 40 (32,2) | 0,721 |
| Hipertensión arterial, n (%) | 85 (65,9) | 124 (71,3) | 108 (87,1) | < 0,001 |
| Diabetes, n (%) | 41 (31,8) | 76 (43,7) | 53 (42,7) | 0,079 |
| Cardiopatía isquémica, n (%) | 65 (50,3) | 95 (54,6) | 65 (52,4) | 0,768 |
| FEVI (%) | 27,7 (7,0) | 28,5 (6,9) | 30,7 (6,5) | 0,0017 |
| Clase funcional, n (%) | ||||
| NYHA I | 1 (0,8) | 4 (2,3) | 0 | 0,318 |
| NYHA II | 87 (67,4) | 120 (69,0) | 85 (69,1) | 0,254 |
| NYHA III | 38 (29,5) | 46 (26,4) | 31 (25,2) | 0,410 |
| NYHA IV | 3 (2,3) | 4 (2,3) | 7 (5,7) | 0,105 |
| PAS (mmHg) | 100,3 (6,2) | 118,2 (5,5) | 143,0 (11,8) | < 0,001 |
| PAD (mmHg) | 62,8 (12,5) | 69,6 (8,8) | 79,1 (11,4) | < 0,001 |
| FC (lpm) | 68,7 (10,7) | 66,7 (10,2) | 68,2 (12,0) | 0,221 |
| Creatinina (mg/dl) | 1,2 (0,4) | 1,3 (2,2) | 1,3 (0,4) | 0,606 |
| eTFG (ml/min) | 62,1 (20,2) | 62,0 (21,4) | 57,7 (19,8) | 0,1667 |
| eTFG < 30 ml/min, n (%) | 4 (3,1) | 9 (5,2) | 8 (6,5) | 0,441 |
| K (mEq/l) | 4,6 (0,5) | 4,6 (0,5) | 4,5 (0,5) | 0,2948 |
| NT-proBNP (pg/ml) | 3.194 (3.670) | 3.290 (3.980) | 3.779 (5.052) | 0,5784 |
| Tratamiento previo, n (%) | ||||
| IECA | 86 (67,2) | 123 (71,9) | 84 (68,3) | 0,642 |
| ARA-II | 37 (28,9) | 38 (22,4) | 36 (29,3) | 0,301 |
| No IECA/ARA-II | 5 (3,9) | 10 (5,8) | 3 (2,4) | 0,361 |
| Dosis altas TITRATION | 104 (80,6) | 133 (76,4) | 98 (79,0) | 0,670 |
| Bloqueadores beta | 113 (88,9) | 168 (96,6) | 107 (87,0) | 0,007 |
| ARM | 75 (58,6) | 107 (61,9) | 77 (63,4) | 0,707 |
| Portador DAI | 75 (58,6) | 101 (58,4) | 54 (43,9) | 0,024 |
| Portador TRC | 34 (26,6) | 50 (29,4) | 25 (20,3) | 0,203 |
| Ingresos 6 meses previos, n (%) | 43 (33,3) | 48 (27,8) | 36 (29,5) | 0,575 |
ARA-II: antagonista del receptor de la angiotensina II; ARM: antagonista del receptor mineralocorticoide; DAI: desfibrilador automático implantable; eTFG: tasa de filtrado glomerular estimado; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; lpm: latidos por minuto; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); NYHA: New York Heart Association; PAD: tensión arterial diastólica; PAS: presión arterial sistólica; TRC: terapia de resincronización cardiaca.
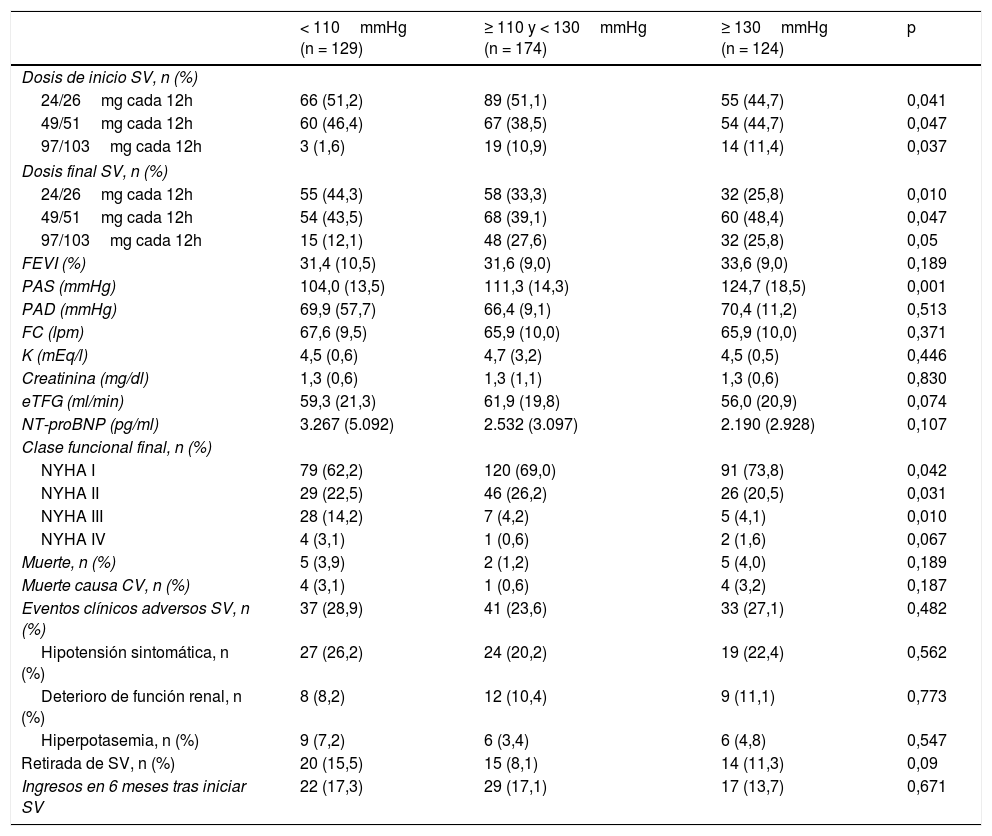
Características de los pacientes al final del seguimiento en función de la presión arterial basal
| < 110mmHg (n = 129) | ≥ 110 y < 130mmHg (n = 174) | ≥ 130mmHg (n = 124) | p | |
|---|---|---|---|---|
| Dosis de inicio SV, n (%) | ||||
| 24/26mg cada 12h | 66 (51,2) | 89 (51,1) | 55 (44,7) | 0,041 |
| 49/51mg cada 12h | 60 (46,4) | 67 (38,5) | 54 (44,7) | 0,047 |
| 97/103mg cada 12h | 3 (1,6) | 19 (10,9) | 14 (11,4) | 0,037 |
| Dosis final SV, n (%) | ||||
| 24/26mg cada 12h | 55 (44,3) | 58 (33,3) | 32 (25,8) | 0,010 |
| 49/51mg cada 12h | 54 (43,5) | 68 (39,1) | 60 (48,4) | 0,047 |
| 97/103mg cada 12h | 15 (12,1) | 48 (27,6) | 32 (25,8) | 0,05 |
| FEVI (%) | 31,4 (10,5) | 31,6 (9,0) | 33,6 (9,0) | 0,189 |
| PAS (mmHg) | 104,0 (13,5) | 111,3 (14,3) | 124,7 (18,5) | 0,001 |
| PAD (mmHg) | 69,9 (57,7) | 66,4 (9,1) | 70,4 (11,2) | 0,513 |
| FC (lpm) | 67,6 (9,5) | 65,9 (10,0) | 65,9 (10,0) | 0,371 |
| K (mEq/l) | 4,5 (0,6) | 4,7 (3,2) | 4,5 (0,5) | 0,446 |
| Creatinina (mg/dl) | 1,3 (0,6) | 1,3 (1,1) | 1,3 (0,6) | 0,830 |
| eTFG (ml/min) | 59,3 (21,3) | 61,9 (19,8) | 56,0 (20,9) | 0,074 |
| NT-proBNP (pg/ml) | 3.267 (5.092) | 2.532 (3.097) | 2.190 (2.928) | 0,107 |
| Clase funcional final, n (%) | ||||
| NYHA I | 79 (62,2) | 120 (69,0) | 91 (73,8) | 0,042 |
| NYHA II | 29 (22,5) | 46 (26,2) | 26 (20,5) | 0,031 |
| NYHA III | 28 (14,2) | 7 (4,2) | 5 (4,1) | 0,010 |
| NYHA IV | 4 (3,1) | 1 (0,6) | 2 (1,6) | 0,067 |
| Muerte, n (%) | 5 (3,9) | 2 (1,2) | 5 (4,0) | 0,189 |
| Muerte causa CV, n (%) | 4 (3,1) | 1 (0,6) | 4 (3,2) | 0,187 |
| Eventos clínicos adversos SV, n (%) | 37 (28,9) | 41 (23,6) | 33 (27,1) | 0,482 |
| Hipotensión sintomática, n (%) | 27 (26,2) | 24 (20,2) | 19 (22,4) | 0,562 |
| Deterioro de función renal, n (%) | 8 (8,2) | 12 (10,4) | 9 (11,1) | 0,773 |
| Hiperpotasemia, n (%) | 9 (7,2) | 6 (3,4) | 6 (4,8) | 0,547 |
| Retirada de SV, n (%) | 20 (15,5) | 15 (8,1) | 14 (11,3) | 0,09 |
| Ingresos en 6 meses tras iniciar SV | 22 (17,3) | 29 (17,1) | 17 (13,7) | 0,671 |
CV: cardiovascular; eTFG: tasa de filtrado glomerular estimado; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; K: potasio; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SV: sacubitrilo/valsartán.
Se registraron efectos adversos en 111 pacientes (26,0%), sin diferencias en función de la PAS basal (tabla 2). Aunque la HA fue el efecto adverso más frecuente (16,4%), especialmente en pacientes con PAS inicial más baja, no hubo diferencias significativas entre los grupos. La suspensión de SV ocurrió en el 11,5% de los pacientes, sin diferencias significativas entre grupos.
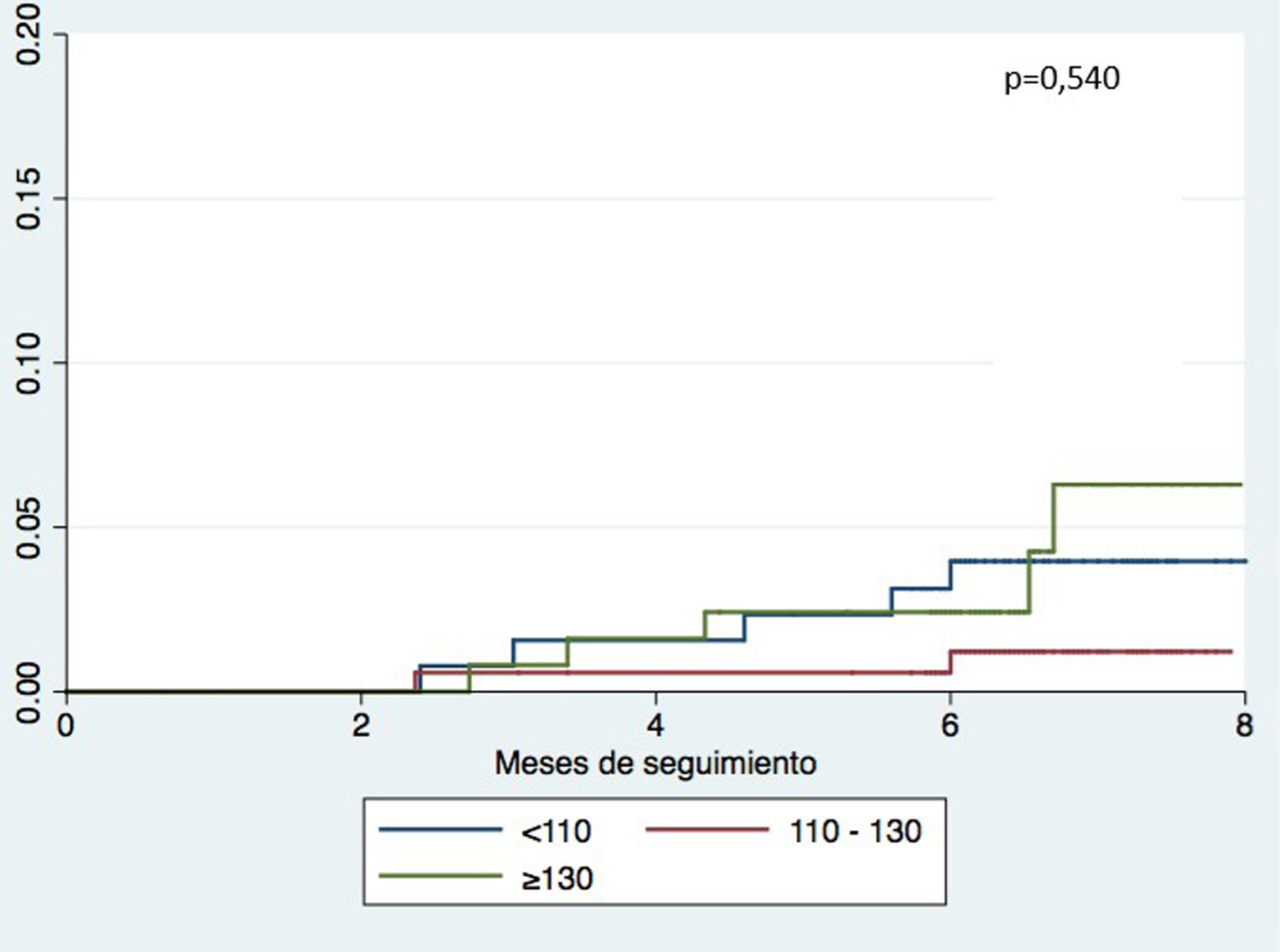
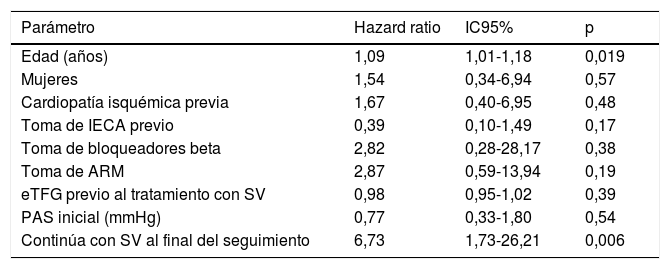
En el análisis multivariado (tabla 3), la PAS inicial no predijo un peor pronóstico (hazard ratio =0,77; intervalo de confianza del 95%, 0,33-1,80; p = 0,54) (fig. 1).
Análisis multivariado de los predictores de mortalidad
| Parámetro | Hazard ratio | IC95% | p |
|---|---|---|---|
| Edad (años) | 1,09 | 1,01-1,18 | 0,019 |
| Mujeres | 1,54 | 0,34-6,94 | 0,57 |
| Cardiopatía isquémica previa | 1,67 | 0,40-6,95 | 0,48 |
| Toma de IECA previo | 0,39 | 0,10-1,49 | 0,17 |
| Toma de bloqueadores beta | 2,82 | 0,28-28,17 | 0,38 |
| Toma de ARM | 2,87 | 0,59-13,94 | 0,19 |
| eTFG previo al tratamiento con SV | 0,98 | 0,95-1,02 | 0,39 |
| PAS inicial (mmHg) | 0,77 | 0,33-1,80 | 0,54 |
| Continúa con SV al final del seguimiento | 6,73 | 1,73-26,21 | 0,006 |
ARM: antagonista del receptor mineralocorticoide; eTFG: tasa de filtrado glomerular estimado; IC95%: intervalo de confianza del 95%; IECA: inhibidor de la enzima de conversión de la angiotensina; PAS: presión arterial sistólica; SV: sacubitrilo/valsartán.
Nuestros datos muestran que, en la vida real, la HA es el efecto adverso más frecuente en pacientes tratados con SV, pero la frecuencia de su aparición no depende de las cifras basales de la PAS. La PAS inicial sí se asoció a la dosis del fármaco alcanzada al final del seguimiento, pero no de forma significativa a la tasa de retirada del SV ni al pronóstico.
La tasa de HA en nuestro registro (16%) fue similar a la encontrada en el ensayo fundamental PARADIGM-HF (14%), aunque los pacientes incluidos en PARADIGM-HF estaban seleccionados y tenían que superar una fase de preinclusión en la que se mostrase que toleraban tanto enalapril como el SV2. Por otro lado, el inicio del SV en la vida real se hace con dosis más bajas que en los ensayos clínicos y ajustado a la situación clínica del paciente y en concreto a la PAS basal. Este hecho es clave para explicar que no hayamos encontrado tasas de HA distintas en función del grupo de la PAS basal.
La aparición de HA en pacientes con ICFEr se debe a diversos factores, como la evolución de la propia enfermedad y el uso concomitante de otros fármacos que reducen la presión arterial4,5,9. En el caso del SV, la HA se explica por su mecanismo de acción dual, que bloquea el sistema renina-angiotensina-aldosterona y estimula la actividad de sustancias vasoactivas con efecto vasodilatador. Por este motivo, la titulación progresiva, tal y como se demostró en el ensayo TITRATION, permite optimizar el tratamiento farmacológico5.
La HA también se ha relacionado con el uso de otros fármacos empleados en la ICFEr. En el ensayo Studies of Left Ventricular Dysfunction (SOLVD) el 15% de los pacientes tratados con enalapril presentaron HA, frente al 7% del grupo placebo10. En el estudio The Carvedilol and ACE-Inhibitor Remodelling Mild Heart Failure Evaluation (CARMEN), se observó una tasa de HA del 11%11.
Existen algunos parámetros que permiten identificar a los pacientes con mayor riesgo de HA, como la edad avanzada, la PAS inicial más baja, el ajuste de dosis a dosis altas, el uso de antagonistas del receptor mineralocorticoide y ser portador de un desfibrilador automático implantable2,12,13. Nuestra población tiene varias de estas características con más frecuencia que la incluida en el PARADIGM-HF, como que aquellos con PAS más baja son más jóvenes y llevan menos antagonistas del receptor mineralocorticoide, aunque los resultados de nuestro trabajo avalan la seguridad del uso del SV en práctica clínica habitual. Además, esta seguridad se ha confirmado recientemente en vida real en un estudio en pacientes ingresados tras una descompensación, que presentaron una tasa de HA similar (15%)3,14.
En los pacientes con PAS inicial más baja es más difícil alcanzar dosis objetivo de SV durante el ajuste de dosis, aunque en nuestro estudio casi la mitad de los pacientes con PAS basal <110mmHg alcanzaron una dosis intermedia. Los ensayos Assessment of Treatment with Lisinopril and Survival (ATLAS) y The Heart failure Endpoint evaluation of Angiotensin II Antagonist Losartan (HEAAL) sugirieron cierto beneficio del uso de dosis altas de IECA/ARA-II frente a las dosis bajas12,13. Sin embargo, los registros en la vida real demuestran que solo el 28% de los pacientes con ICFEr alcanzan dosis objetivo de IECA y que entre el 23 y el 48% no reciben tratamiento con IECA/ARA-II debido a la presencia de HA15.
En los pacientes con mayor riesgo de HA, hay diferentes estrategias para conseguir mantener o ajustar dosis del SV. Entre ellas destacan: la reducción de la dosis de diuréticos (que incluye el uso de régimen flexible) y de otros vasodilatadores8,16, el inicio a las dosis adecuadas de SV, el inicio en el ámbito ambulatorio14, o una estrategia de titulación lenta5. En nuestro estudio, solo el 25% de los pacientes alcanzaron dosis objetivo de SV, aunque la tasa de suspensión del fármaco en este grupo fue baja (11%). Las razones para no alcanzar dosis máximas son diversas, incluyendo la inercia terapéutica, las preferencias del paciente y la aparición de eventos adversos que impidan el ajuste de dosis, sobre todo la HA. Sin embargo, la reducción de la dosis de SV es una estrategia válida para mantener el tratamiento, que permite identificar a los pacientes con mayor riesgo de presentar eventos. En estos pacientes, el mantenimiento de dosis bajas del SV es más beneficioso que el uso de dosis bajas de IECA o la suspensión de los inhibidores del eje9,17.
Aunque la HA es el efecto secundario más frecuentemente asociado al uso de SV en diferentes escenarios2,6,14, tanto en el PARADIGM-HF como en nuestro trabajo se demuestra que este efecto adverso habitualmente no conlleva la retirada del fármaco. Algunos estudios han demostrado que los pacientes con cifras más bajas de PAS tienen una mayor mortalidad18. Sin embargo, en un subanálisis del PARADIGM-HF, se observó que la relación entre la PAS y la aparición de eventos tenía una relación en forma de U, con un punto de corte en 120mmHg4. En nuestro estudio, la PAS basal no predijo la mortalidad, por lo que esta relación puede verse influenciada por el infratratamiento de estos pacientes más que por las propias cifras de PAS o el estado avanzado de la enfermedad. Por otro lado, la suspensión de SV por cualquier causa se asoció a una mayor mortalidad en otros análisis de nuestra cohorte6,7,14, de ahí la importancia de intentar mantener el tratamiento ante la aparición de eventos adversos como la HA.
LimitacionesNuestro estudio tiene algunas limitaciones. En primer lugar, se trata de un estudio no aleatorizado. En segundo lugar, no se dispone de información sobre la adherencia y modificaciones de los fármacos distintos a SV durante la titulación y al final del seguimiento. Por último, nuestro estudio se realizó en los primeros meses de comercialización de SV en España, en la que la experiencia con el fármaco era reducida. En cualquier caso, dicho escenario avala aún más su seguridad en la práctica clínica.
ConclusionesEl SV es un fármaco seguro en la práctica clínica. La HA es su efecto secundario más frecuente, y la PAS inicial se asocia a la dosis alcanzada pero no a la tasa de retirada de SV ni al pronóstico. Una adecuada selección de los pacientes, el ajuste del resto del tratamiento farmacológico y una titulación lenta pueden permitir mantener y titular las dosis del fármaco.
- –
El principal efecto adverso del SV recogido en el ensayo PARADIGM-HF fue la HA, aunque su aparición no llevó a una mayor retirada del fármaco con respecto al IECA.
- –
La presencia de HA puede limitar el uso y el ajuste de dosis del SV en la práctica clínica.
- –
No existen suficientes datos en vida real sobre el impacto de la HA en el tratamiento de las pacientes con IC que reciben tratamiento con SV.
- –
En la práctica clínica, la HA es el efecto adverso más frecuente relacionado con SV, aunque su aparición no depende de la PAS basal.
- –
La PAS basal se asocia a las dosis máximas de SV que se alcanzan al final del seguimiento.
- –
La PAS basal no se asoció con una mayor tasa de retirada de SV ni con la aparición de eventos clínicos en el seguimiento.
Este estudio no cuenta con financiación.
Contribución de los autoresConcepción y diseño del manuscrito: A. Esteban-Fernández, M. Martínez-Sellés. Recogida de datos: A. Esteban-Fernández, R. Bover, M. Gómez-Bueno, J. de Juan Bagudá, P. Díez-Villanueva, Á. Manuel Iniesta, A. Ayesta, M. Martínez-Sellés. Análisis e interpretación de los datos: A. Esteban-Fernández, L. Vicent, M. Martínez-Sellés. Redacción, revisión, aprobación del manuscrito remitido: A. Esteban-Fernández, L. Vicent, R. Bover, M. Gómez-Bueno, J. de Juan Bagudá, P. Díez-Villanueva, Á. Manuel Iniesta, A. Ayesta, M. Martínez-Sellés.
Conflicto de interesesA. Esteban-Fernández ha recibido honorarios por asesoría y actividades científicas de Novartis. J. de Juan Bagudá ha percibido honorarios por asesoría y actividades formativas de Novartis, Rovi, AstraZeneca, Vifor Pharma, Almirall, Boehringer Ingelheim, Daiichi Sankyo, Boston Scientific, Impulse Dynamics, ArrhytNeT, OrionPharma, Bayer, Servier. El resto de los autores declaran no tener ningún conflicto de intereses.