El uso del oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) ha experimentado un auge en los últimos años para el tratamiento de diferentes enfermedades en el ámbito de la cardiología. El objetivo del presente estudio fue describir los resultados de la puesta en marcha de un programa de ECMO-VA en un servicio de cardiología, destinado a pacientes con enfermedad médica.
MétodosEstudio observacional. Se incluyó de manera consecutiva a los pacientes tratados con ECMO-VA debido a enfermedad médica en los primeros 5 años del programa. Se analizaron las características de los pacientes y los resultados obtenidos a corto y largo plazo.
ResultadosSe incluyó a 83 pacientes tratados con ECMO-VA durante el periodo de estudio. La supervivencia a 30 días fue del 55,4% y la supervivencia al alta hospitalaria fue del 50,6%. Resultaron predictores independientes de mortalidad a 30 días la edad (odds ratio [OR] por cada 10 años = 1,83; intervalo de confianza del 95% [IC95%], 1,08-2,33; p=0,03), el lactato previo (OR por cada mmol/l 1,27; IC95%, 1,12-1,45; p<0,001) y el tiempo decisión-implante (OR por cada 15min = 1,99; IC95%, 1,12-3,56; p=0,02). La supervivencia a un año de los pacientes que recibieron el alta fue del 100%.
ConclusionesLa aplicación de un programa de ECMO-VA en un servicio de cardiología es factible y aplicable a pacientes con enfermedad cardiológica aguda, con unos resultados favorables en cuanto a supervivencia a corto y largo plazo. El retraso en el tiempo de implante parece jugar un papel importante en el resultado de la terapia, junto con la edad y el lactato previo.
Use of venoarterial extracorporeal membrane oxygenation (VA-ECMO) has expanded in the last few years due to its applicability in different cardiac conditions. The aim of this study is to describe the outcomes of developing a VA-ECMO program in a cardiology department.
MethodsObservational study. We consecutively collected the patients treated with VA-ECMO due to medical pathology during the first 5 years of the program. We analyzed the characteristics and short and long term outcomes of these cases.
ResultsEighty-three patients were supported with VA-ECMO during the study period. Thirty-day survival was 55.4% and survival to hospital discharge was 50.6%. On multivariate logistic regression analysis age (10 years old odds ratio [OR], 1.83; 95% confidence interval [95%CI], 1.08-2.33; P=.03), previous lactate (mmol/L OR, 1.27; 95%CI, 1.12-1.45; P <.001) and time from decision to support (15min OR, 1.99; 95%CI, 1.12-3.56; P=.02). One-year survival of patients who were discharged was 100%.
ConclusionsThe developing of a VA-ECMO program in the cardiology departments is feasible and applicable to patients with medical acute cardiovascular failure. Time from decision to support appears to play an important role in the outcomes, as do lactate and age.
El oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) se puede definir de manera sencilla como una modificación simplificada de la circulación extracorpórea. El sistema extrae sangre desoxigenada desde el sistema venoso mediante una o varias cánulas, bombea la sangre a través de un oxigenador donde tiene lugar el intercambio gaseoso y la devuelve a territorio arterial a través de una cánula de reinfusión1. El ECMO-VA permite una rápida implantación y un soporte mixto circulatorio y respiratorio, lo cual facilita su aplicación en múltiples escenarios de forma temporal como terapia puente hasta una eventual recuperación, un trasplante o la implantación de una asistencia ventricular de mayor duración2.
El uso de ECMO-VA como soporte circulatorio del shock cardiogénico (SC) o en parada cardiaca refractaria como reanimación cardiopulmonar extracorpórea ha crecido de manera sustancial en los últimos años, hasta ser actualmente estas las indicaciones más frecuentes de ECMO-VA, con más de 2.000 implantes anuales1,3. Por otro lado, la indicación de ECMO-VA en el SC ha ido evolucionando con el tiempo; inicialmente se utilizaba en el SC poscardiotomía, mientras que en la actualidad la aplicación más frecuente es el SC de causa médica. De esta forma, hoy en día el ECMO-VA tiene su principal aplicación en enfermedades del ámbito de la cardiología, y en muchas ocasiones es indicado, iniciado y manejado por cardiólogos. Esto ha sido posible gracias al avance tecnológico de estos dispositivos: mayor durabilidad, facilidad de purgado y puesta en marcha, implante percutáneo, retirada con apoyo de cierres vasculares, etc.1.
Aunque existe bastante información acerca del soporte con ECMO-VA en el contexto del SC tras cirugía cardiaca, los datos sobre la terapia en pacientes con shock de causa médica son más escasos, con resultados inconsistentes y frecuentemente provenientes de series pequeñas con seguimientos cortos4–7. Dos metanálisis realizados en este contexto aportan más información8,9, aunque más sobre el uso de ECMO-VA en parada cardiaca que en SC8.
Los objetivos del presente estudio fueron: a) recoger las características de los pacientes asistidos durante los primeros 5 años de la puesta en marcha de un programa de ECMO-VA para enfermedad médica en un servicio de cardiología; b) analizar la supervivencia a corto y largo plazo, y c) estudiar los factores pronósticos de supervivencia a corto plazo.
MétodosSe recogió de forma consecutiva y se analizó a todos los pacientes que recibieron ECMO-VA en la unidad de cuidados cardiológicos agudos de nuestro centro debido a una enfermedad médica no quirúrgica desde la puesta en marcha del programa en julio de 2013 hasta junio de 2018.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de nuestro centro con el código ECMO19 270/19.
La indicación de ECMO-VA se realizó en las siguientes situaciones: a) SC refractario, definido como aquel SC (presión arterial sistólica<90mmHg o necesidad de vasopresores para mantenerla, con volemia adecuada y signos clínicos o analíticos de hipoperfusión) sin respuesta a fármacos vasoactivos en dosis crecientes; b) tromboembolia pulmonar en shock con contraindicación para fibrinólisis o hipotensión persistente a pesar de fármacos vasoactivos a dosis elevadas; c) parada cardiaca intrahospitalaria refractaria a reanimación cardiopulmonar avanzada durante más de 10min, y d) intervencionismo coronario, estructural o electrofisiológico de alto riesgo. Como contraindicaciones absolutas se consideraron la presencia de comorbilidad que condicionase una expectativa de vida reducida, fracaso multiorgánico establecido e irreversible y la presencia de hemorragia activa no controlable.
Una vez tomada la decisión de proporcionar soporte con ECMO-VA, se obtuvo el consentimiento informado y el implante lo realizó el equipo de hemodinámica, con una disponibilidad que cubrió las 24h del día y los 7 días de la semana. La canulación se realizó preferentemente en el laboratorio de hemodinámica, mediante técnica de Seldinger guiada con ultrasonidos y fluoroscopia. En aquellas circunstancias que hacían imposible el traslado del paciente, el implante se realizó «a pie de cama»; en este caso, la canulación fue asistida mediante ultrasonidos. El abordaje se realizó por vía femorofemoral; siempre que fue posible se canalizó la arteria femoral superficial para perfusión anterógrada. Tras administrar un bolo de heparina sódica (50-100UI/kg), se conectó el circuito y se comenzó el soporte.
Una vez realizado el implante, los pacientes ingresaron en la unidad de cuidados cardiológicos agudos. Se mantuvo a todos los pacientes bajo ventilación mecánica invasiva y sedoanalgesia. El soporte vasoactivo se ajustó tras el inicio de la terapia, intentando mantener una dosis baja de inotrópicos y ajustando vasopresores o vasodilatadores para obtener una presión arterial media de 65-90mmHg. La anticoagulación se llevó a cabo mediante infusión continua de heparina sódica, para alcanzar una ratio de tiempo de tromboplastina parcial activado de 1,8-2,2, junto con la monitorización diaria de niveles de inhibidores del factor xa (objetivo 0,3-0,5U/ml). El tratamiento médico del paciente durante la terapia con ECMO-VA lo realizó el cardiólogo adjunto de la unidad de cuidados cardiológicos agudos, con seguimiento de los cuidados por parte del cardiólogo de guardia. Se habilitó un sistema de consultas urgentes para resolver las cuestiones que pudieran surgir a lo largo del periodo de guardia, en el que uno de los cardiólogos adjuntos de la unidad de cuidados cardiológicos agudos se encontraba disponible 24h por vía telefónica. Se realizó un registro de estas consultas para controlar la actividad.
Si tras la terapia de soporte existía recuperación del fallo de órganos y de la función cardiaca y respiratoria, se realizaba una prueba de destete con posterior decanulación en caso de respuesta favorable. La decanulación se realizó de manera quirúrgica o mediante dispositivo de cierre vascular. Esta segunda opción fue la preferida si la canulación se había realizado en la sala de hemodinámica, sin problemas técnicos en la zona de punción, y la misma se realizó mediante 2 dispositivos Perclose ProGlide (Abbott, Estados Unidos) según técnica previamente descrita10.
Dos de los investigadores recopilaron de manera retrospectiva la información contenida en la historia clínica electrónica y los registros de enfermería. En caso de dudas en la asignación de un valor, se discutió el caso entre ambos para determinarlo. Se recogieron variables demográficas y clínicas, variables relacionadas con el implante y variables relacionadas con eventos y resultado de la terapia. De manera general, se utilizaron las definiciones del registro de la Extracorporeal Life Support Organization11 (tabla 1). Se utilizaron 2 variables para medir el tiempo hasta el inicio del soporte con ECMO-VA: a) el tiempo de canulación es el periodo transcurrido desde la primera punción hasta el inicio de soporte con ECMO (incluye el tiempo que se necesitó para el purgado de la ECMO y la canulación del dispositivo y, en su caso, la canalización de la perfusión distal); b) tiempo decisión-implante: tiempo trascurrido desde la indicación hasta el inicio de soporte con ECMO-VA (incluye los tiempos de llegada del equipo de hemodinámica y traslado del paciente, a los que se añade el tiempo de canulación).
Definiciones de las complicaciones según el registro de la ELSO
| Complicación | Definición |
|---|---|
| Fallo del oxigenador | Mal funcionamiento del oxigenador debido a formación de trombo, deterioro de intercambio gaseoso que precisa recambio |
| Evento neurológico | Infarto o hemorragia en sistema nervioso central demostrado con tomografía computarizada o resonancia magnética |
| Insuficiencia renal grave | Desarrollo de insuficiencia renal con cifras de creatinina>2,5mg/dl tras el inicio de terapia con ECMO |
| Depuración extrarrenal | Necesidad de terapia de depuración extrarrenal durante la terapia con ECMO |
| Isquemia distal | Aparición de isquemia de miembro distal a la canulación arterial de la ECMO que precisa de intervención quirúrgica, cambio de lugar de canulación, fasciotomía o amputación |
| Hemorragia | Hemorragia que precisa de transfusión de>3 concentrados de hematíes en 24h, o de intervención para su control (cirugía, cateterismo o endoscopia) |
| Infección | Enfermedad infecciosa que aparece durante la terapia con ECMO o es derivada de la misma |
| Distensión de ventrículo izquierdo | Disminución de pulsatilidad del ventrículo izquierdo que precisa de tratamiento de descarga |
| Hemólisis | Elevación de hemoglobina libre en plasma con cifras>50mg/dl |
ECMO: oxigenador extracorpóreo de membrana.
Fuente: tabla elaborada con datos del Registry Data Definitions de la Extracorporeal Life Support Organization11.
Si el objetivo de la terapia resultaba ser puente a trasplante cardiaco, para plantearlo desde ECMO-VA periférico se realizaba previamente una estricta valoración para asegurar la ausencia de contraindicaciones. Para ello, el paciente debía cumplir los siguientes parámetros: lactato<2mmol/l; filtrado glomerular>30ml/min/1,73m2; ausencia de depuración extrarrenal, razón internacional normalizada<1,5; bilirrubina<2mg/dl; relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno> 200, con una fracción inspirada de oxígeno en respirador≤ 0,6 y una presión positiva al final de la espiración≤10mmHg, y sin sospecha de infección activa (estos datos se comprobaron a diario y en el momento de la aceptación del órgano). En caso de no cumplir las condiciones mencionadas, se optaba por la transición a un dispositivo de asistencia ventricular como puente a trasplante.
Análisis estadísticoLas variables cuantitativas se describieron como media±desviación estándar o mediana y rango intercuartílico [RIC], y la comparación se realizó mediante la prueba de la t de Student si la distribución era normal, o la prueba de Wilcoxon en caso contrario. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov. Las variables cualitativas se describieron como número y porcentaje; la comparación se realizó con la prueba de la χ2 o la prueba exacta de Fisher. Se evaluó la función de supervivencia mediante las curvas de Kaplan-Meier. Se estudiaron los predictores de mortalidad a 30 días del inicio de la terapia ECMO-VA mediante regresión logística; las variables que obtuvieron una p <0,20 en el análisis univariado se incluyeron en el análisis multivariado mediante análisis por pasos hacia atrás. El análisis estadístico se realizó con el programa SPSS 19.0 (IBM, Estados Unidos).
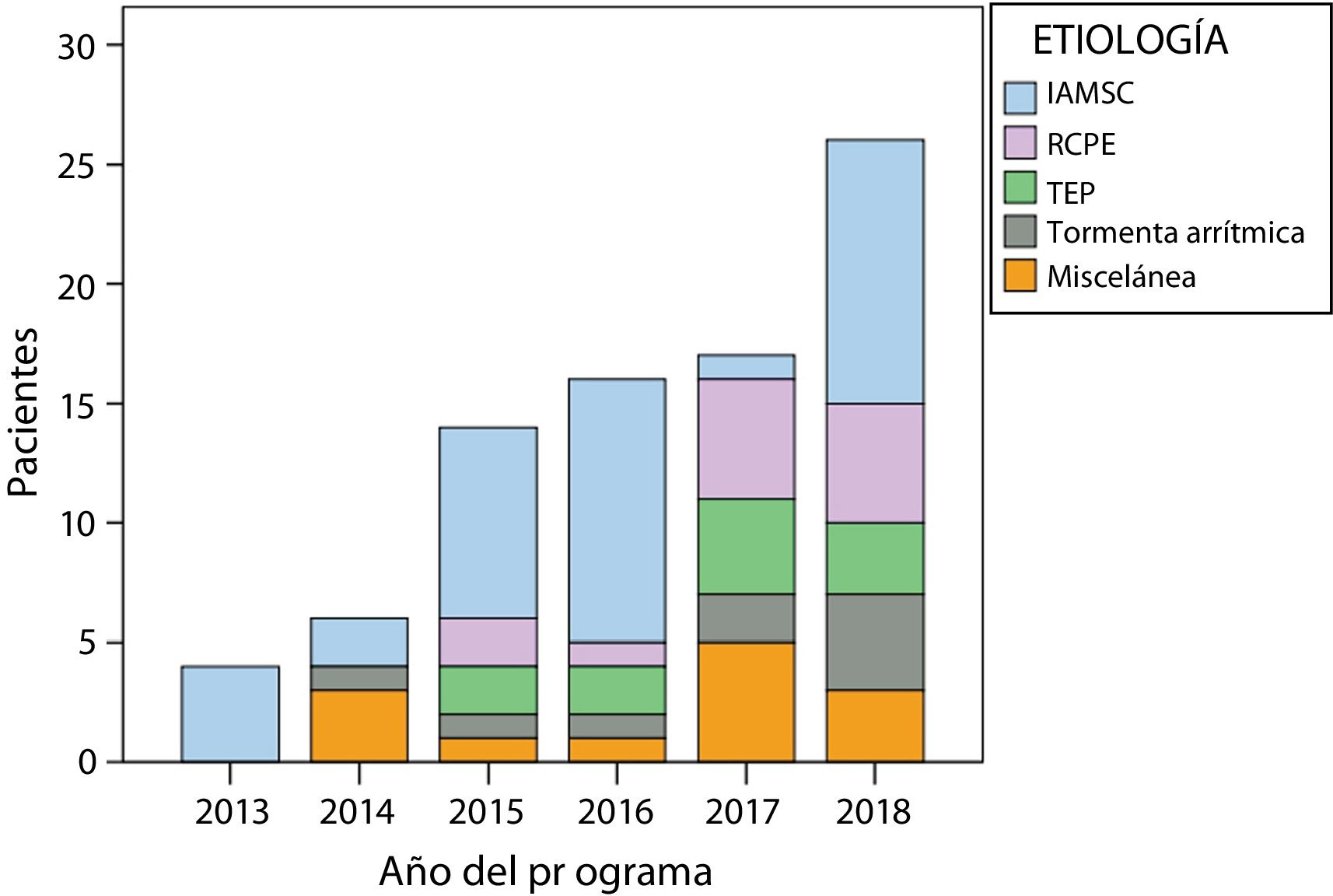
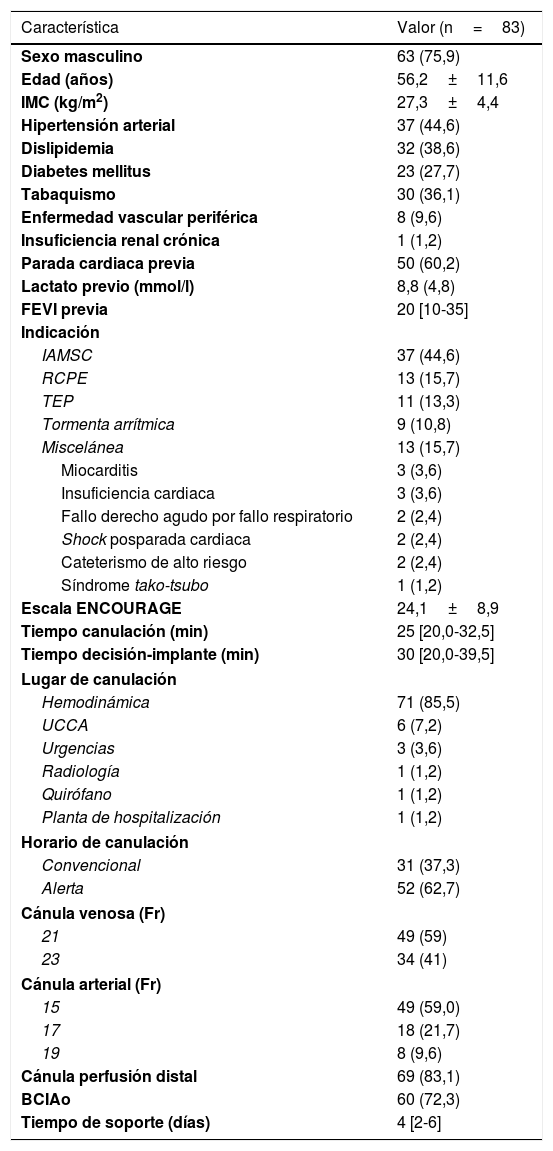
ResultadosCaracterísticas basalesDurante el periodo de estudio, se realizó terapia con ECMO-VA en 83 pacientes, con una edad media de 56,2±11,6 años, 63 de los cuales eran varones (75,9%). La tendencia temporal fue de aumento progresivo del uso, según se indica en la figura 1. Las características de los pacientes se presentan en la tabla 2. La enfermedad que más frecuentemente provocó la necesidad de ECMO-VA fue el infarto agudo de miocardio en SC (n=37; porcentaje del total: 45%). La media de lactato previa al implante fue 8,8±4,8mmol/l y 50 pacientes (60,2%) habían presentado parada cardiaca antes del soporte con ECMO-VA, en 13 de los cuales fue la propia parada cardiaca la que indicó el implante de ECMO-VA como reanimación cardiopulmonar extracorpórea debido a su refractariedad. El implante se llevó a cabo en el laboratorio de hemodinámica en la mayoría de los casos (n=71; 85,5%). En el 65,1% (n=54) de los casos la terapia se inició en horario convencional, con presencia física en el laboratorio de hemodinámica (8:00-21:00 de lunes a viernes). En los casos restantes (29) se inició la terapia en horario de alerta (21:00-8:00 de lunes a viernes o fin de semana); de ellos, en 16 casos (55,2%) se realizó durante el proceso de angioplastia primaria. El tiempo de canulación fue 25min de mediana [20,0-32,5], mientras que el tiempo decisión-implante fue 30min de mediana [20,0-39,5]. No se encontraron diferencias significativas en los tiempos de canulación (odds ratio [OR] = 1,00; intervalo de confianza del 95% [IC95%], 0,98-1,03; p=0,79) ni en los tiempos decisión-implante (OR = 1,00; IC95%, 0,99-1,03; p=0,42) en función del horario convencional o en alerta.
Enfermedad que motivó el implante del oxigenador extracorpóreo de membrana venoarterial (ECMO-VA). IAMSC: infarto agudo de miocardio con shock cardiogénico; RCPE: reanimación cardiopulmonar extracorpórea; TEP: tromboembolia pulmonar. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Características clínicas de los pacientes
| Característica | Valor (n=83) |
|---|---|
| Sexo masculino | 63 (75,9) |
| Edad (años) | 56,2±11,6 |
| IMC (kg/m2) | 27,3±4,4 |
| Hipertensión arterial | 37 (44,6) |
| Dislipidemia | 32 (38,6) |
| Diabetes mellitus | 23 (27,7) |
| Tabaquismo | 30 (36,1) |
| Enfermedad vascular periférica | 8 (9,6) |
| Insuficiencia renal crónica | 1 (1,2) |
| Parada cardiaca previa | 50 (60,2) |
| Lactato previo (mmol/l) | 8,8 (4,8) |
| FEVI previa | 20 [10-35] |
| Indicación | |
| IAMSC | 37 (44,6) |
| RCPE | 13 (15,7) |
| TEP | 11 (13,3) |
| Tormenta arrítmica | 9 (10,8) |
| Miscelánea | 13 (15,7) |
| Miocarditis | 3 (3,6) |
| Insuficiencia cardiaca | 3 (3,6) |
| Fallo derecho agudo por fallo respiratorio | 2 (2,4) |
| Shock posparada cardiaca | 2 (2,4) |
| Cateterismo de alto riesgo | 2 (2,4) |
| Síndrome tako-tsubo | 1 (1,2) |
| Escala ENCOURAGE | 24,1±8,9 |
| Tiempo canulación (min) | 25 [20,0-32,5] |
| Tiempo decisión-implante (min) | 30 [20,0-39,5] |
| Lugar de canulación | |
| Hemodinámica | 71 (85,5) |
| UCCA | 6 (7,2) |
| Urgencias | 3 (3,6) |
| Radiología | 1 (1,2) |
| Quirófano | 1 (1,2) |
| Planta de hospitalización | 1 (1,2) |
| Horario de canulación | |
| Convencional | 31 (37,3) |
| Alerta | 52 (62,7) |
| Cánula venosa (Fr) | |
| 21 | 49 (59) |
| 23 | 34 (41) |
| Cánula arterial (Fr) | |
| 15 | 49 (59,0) |
| 17 | 18 (21,7) |
| 19 | 8 (9,6) |
| Cánula perfusión distal | 69 (83,1) |
| BCIAo | 60 (72,3) |
| Tiempo de soporte (días) | 4 [2-6] |
BCIAo: balón de contrapulsación intraaórtico; FEVI: fracción de eyección de ventrículo izquierdo; IAMSC: infarto agudo de miocardio en shock cardiogénico; IMC: índice de masa corporal; RCPE: reanimación cardiopulmonar extracorpórea; TEP: tromboembolia pulmonar; UCCA: unidad de cuidados cardiológicos agudos.
Los valores expresan n (%) o media±desviación estándar o mediana [RIC].
El ECMO-VA se asoció con balón de contrapulsación intraaórtico en 60 pacientes (72,3%), de los cuales 11 (13,3%) se colocaron previamente al implante de la ECMO-VA. La duración del soporte circulatorio fue de 4 días de mediana [2-6].
Con relación al sistema de consultas clínicas sobre la terapia ECMO-VA habilitado durante el programa, se registraron un total de 257 llamadas relacionadas con la indicación o el manejo del dispositivo, lo que supuso una media de 51,4 consultas al año y 3,1 consultas por paciente.
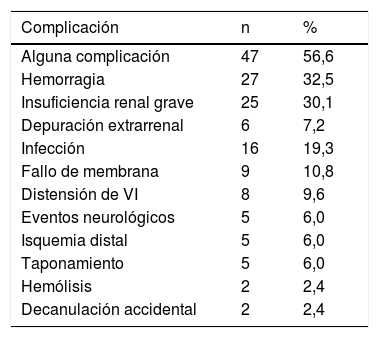
ComplicacionesLa complicación más frecuente fue la hemorragia mayor (n=27; 32,5%). Se registraron infecciones relacionadas con la terapia en 16 pacientes (19,3%), principalmente neumonía relacionada con la ventilación mecánica (n=14), y sendos casos de infección de la herida quirúrgica e infección por Clostridium difficile. Ocurrió distensión del ventrículo izquierdo durante la terapia de ECMO-VA con necesidad de algún sistema de descompresión en 8 pacientes (9,6%): se trató a 5 con Impella-CP (Abiomed, Estados Unidos) implantado por vía femoral, 2 pacientes fueron transferidos a ECMO-VA central con adición de cánula a través de la vena pulmonar para descomprimir el ventrículo, y uno a Berlin Heart EXCOR biventricular (Berlin Heart, Alemania). Cinco pacientes (6%) experimentaron isquemia grave del miembro inferior canulado, que precisó de intervención.
Debido a que con frecuencia las complicaciones se acumularon en un solo caso, se analizó el número de complicaciones por paciente, resultando que el 56,6% (n=47) de ellos presentaron al menos una complicación durante la terapia. En la tabla 3 se presentan las complicaciones ocurridas.
Complicaciones relacionadas con el oxigenador extracorpóreo de membrana venoarterial
| Complicación | n | % |
|---|---|---|
| Alguna complicación | 47 | 56,6 |
| Hemorragia | 27 | 32,5 |
| Insuficiencia renal grave | 25 | 30,1 |
| Depuración extrarrenal | 6 | 7,2 |
| Infección | 16 | 19,3 |
| Fallo de membrana | 9 | 10,8 |
| Distensión de VI | 8 | 9,6 |
| Eventos neurológicos | 5 | 6,0 |
| Isquemia distal | 5 | 6,0 |
| Taponamiento | 5 | 6,0 |
| Hemólisis | 2 | 2,4 |
| Decanulación accidental | 2 | 2,4 |
VI: ventrículo izquierdo.
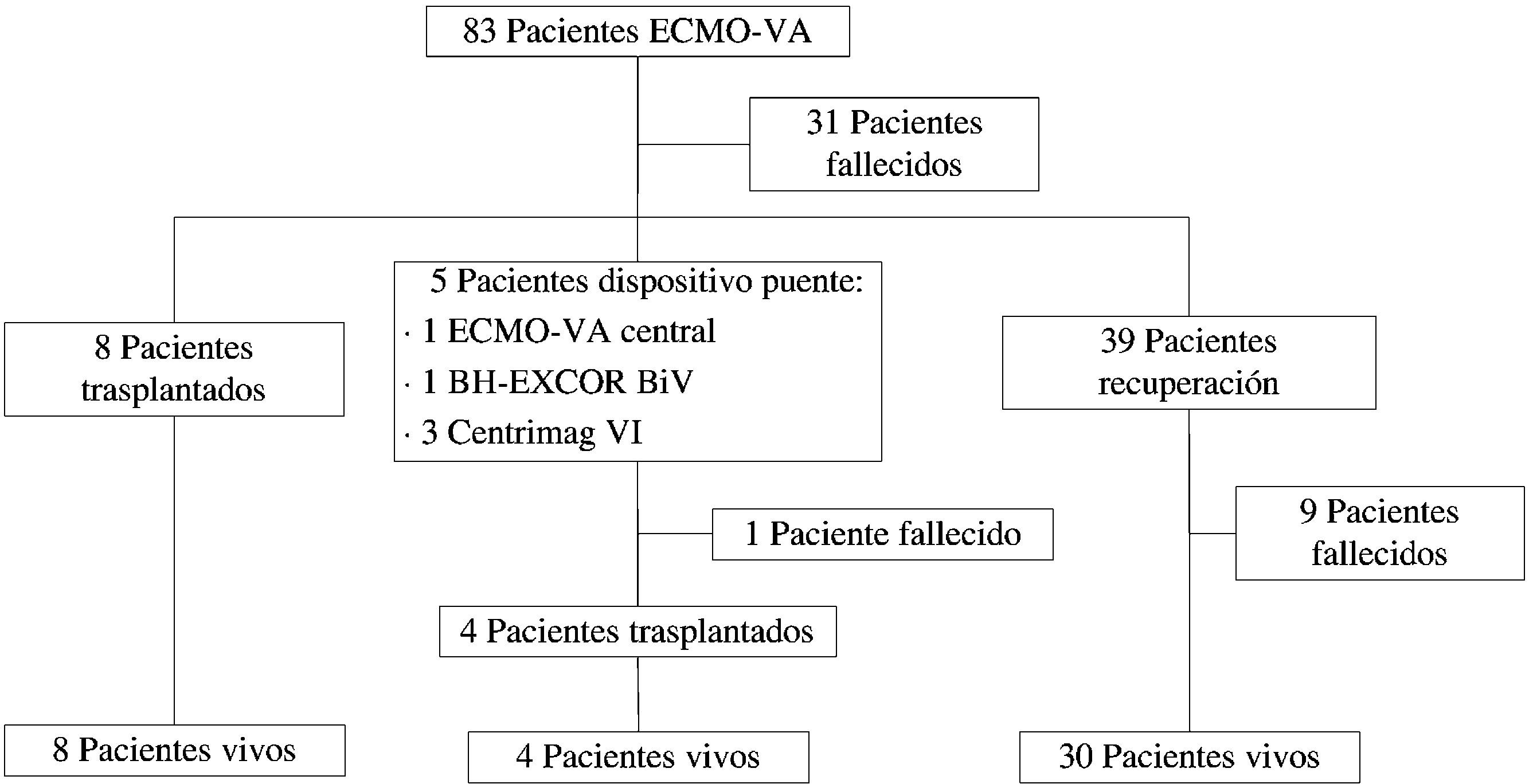
Tras el implante del ECMO-VA, la supervivencia a 30 días fue del 55,4% (n=46), mientras que al alta hospitalaria fue del 50,6% (n=42). Se pudo decanular a 52 pacientes, de los cuales lo fueron por recuperación total o parcial 39 pacientes, 8 porque fueron trasplantados desde ECMO-VA periférico y 5 transferidos a otro dispositivo de asistencia circulatoria como puente a trasplante (un ECMO-VA central, un Berlin Heart EXCOR biventricular y 3 asistencias temporales izquierdas tipo CentriMag [Thoratec, Estados Unidos]), según se muestra en la figura 2.
La causa más frecuente de muerte intrahospitalaria fue fallo multiorgánico (n=22), seguida de la encefalopatía anóxica grave (n=8), la hemorragia incoercible (n=3), la tormenta arrítmica refractaria (n=3), la hemorragia intracraneal (n=2), el distrés respiratorio (n=1) y la insuficiencia cardiaca refractaria (n=1).
Al analizar la supervivencia a 30 días en función de la etiología encontramos que los peores resultados se presentaron en el grupo de reanimación cardiopulmonar extracorpórea, con una supervivencia a 30 días del 23,1%, frente a infarto agudo de miocardio en SC (67,6%), tormenta arrítmica (55,6%), tromboembolia pulmonar (45,5%) y miscelánea (50,0%).
Todos los pacientes que fueron trasplantados (14) sobrevivieron a 30 días y a un año. En concreto, 8 pacientes fueron trasplantados directamente desde ECMO-VA periférico cumpliendo los criterios descritos más arriba, todos ellos bajo mecánica, con supervivencia de todos ellos a 30 días y a un año.
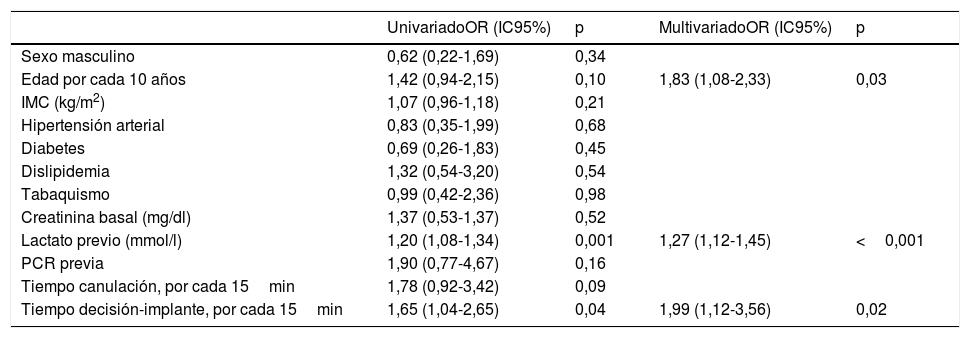
En el análisis univariado resultaron predictores significativos de mortalidad a 30 días la parada cardiaca previa, el lactato previo, el tiempo decisión-implante y la edad. En el estudio multivariado permanecieron como variables predictoras de mortalidad la edad (OR por cada 10 años = 1,83; IC95%, 1,08-2,33; p=0,03), el lactato previo (OR por cada mmol/l = 1,27; IC95%, 1,12-1,45; p <0,001) y el tiempo decisión-implante (OR por cada 15min = 1,99; IC95%, 1,12-3,56; p=0,02) (tabla 4).
Predictores independientes de mortalidad a 30 días
| UnivariadoOR (IC95%) | p | MultivariadoOR (IC95%) | p | |
|---|---|---|---|---|
| Sexo masculino | 0,62 (0,22-1,69) | 0,34 | ||
| Edad por cada 10 años | 1,42 (0,94-2,15) | 0,10 | 1,83 (1,08-2,33) | 0,03 |
| IMC (kg/m2) | 1,07 (0,96-1,18) | 0,21 | ||
| Hipertensión arterial | 0,83 (0,35-1,99) | 0,68 | ||
| Diabetes | 0,69 (0,26-1,83) | 0,45 | ||
| Dislipidemia | 1,32 (0,54-3,20) | 0,54 | ||
| Tabaquismo | 0,99 (0,42-2,36) | 0,98 | ||
| Creatinina basal (mg/dl) | 1,37 (0,53-1,37) | 0,52 | ||
| Lactato previo (mmol/l) | 1,20 (1,08-1,34) | 0,001 | 1,27 (1,12-1,45) | <0,001 |
| PCR previa | 1,90 (0,77-4,67) | 0,16 | ||
| Tiempo canulación, por cada 15min | 1,78 (0,92-3,42) | 0,09 | ||
| Tiempo decisión-implante, por cada 15min | 1,65 (1,04-2,65) | 0,04 | 1,99 (1,12-3,56) | 0,02 |
IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; OR: odds ratio; PCR: parada cardiorrespiratoria.
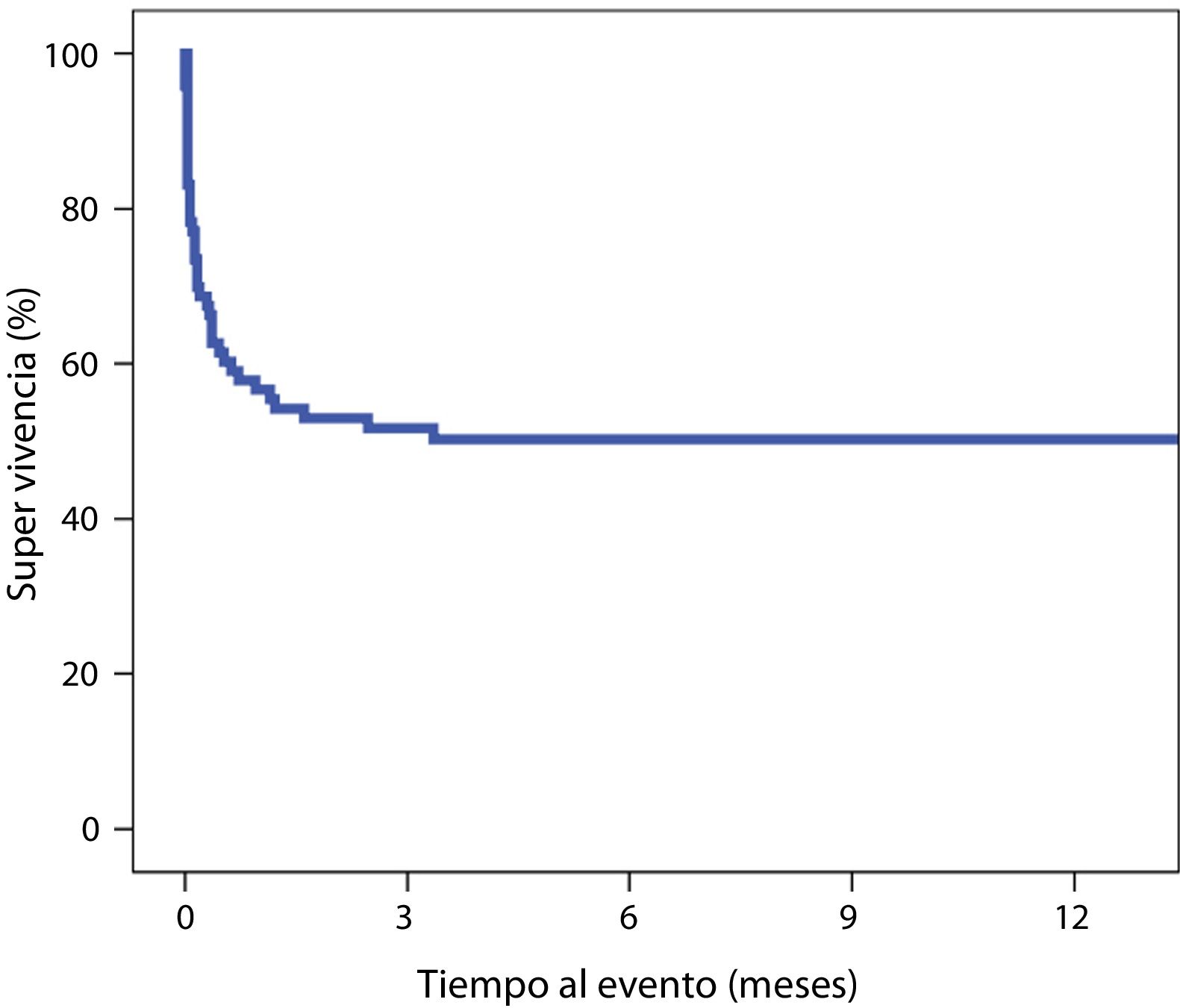
Asimismo, se estudió la supervivencia a largo plazo de los pacientes que sobrevivieron al ingreso índice (n=42) con una mediana de seguimiento de 425 días [395-885]. En el seguimiento realizado solo un paciente falleció, debido a un carcinoma epidermoide de faringe (supervivencia 1.432 días), de forma que en el momento del análisis el 97,6% de los pacientes dados de alta estaban vivos, con una supervivencia a 6 meses y un año del 100% (fig. 3).
DiscusiónEn el presente estudio se muestran las características y resultados tras 5 años del inicio de un programa de ECMO-VA en un servicio de cardiología. La terapia fue aplicada en un amplio espectro de enfermedad médica, en situaciones de extrema gravedad. La supervivencia a 30 días fue del 55,4% y la supervivencia al alta, del 50,6%, y cabe destacar una supervivencia a un año de seguimiento del 100% de los pacientes dados de alta del hospital. Se presentaron como variables predictoras de mortalidad la edad, el lactato y el tiempo decisión-implante.
Hasta el momento, la mayor parte de los estudios realizados sobre la aplicación de ECMO-VA se han centrado en el ámbito posquirúrgico de cirugía cardiaca. Hay menos estudios publicados sobre una población no quirúrgica, con causas médicas de SC5,12,13. Pese a que hay 2 metanálisis realizados en este contexto8,9, el principal aporta información fundamentalmente sobre el uso de ECMO-VA en parada cardiaca (93% de los casos) y da menos datos sobre el SC (7%)8. En las series publicadas con características similares a la nuestra, la supervivencia al alta hospitalaria varió entre 31,3-55,6%3,5,12,13. Es difícil comparar las diferentes series publicadas debido a la heterogeneidad del tipo de pacientes y enfermedades incluidos; en este sentido, hemos aplicado la escala ENCOURAGE14 para reflejar la gravedad de los pacientes tratados, arrojando una supervivencia predicha del 28%. A la vista de estos resultados, los obtenidos en nuestro programa se pueden considerar favorables en el contexto de la gravedad de la enfermedad tratada y son probablemente el fruto de una correcta indicación y tiempos cortos desde la decisión hasta el implante del ECMO-VA, junto con la formación continuada de todo el equipo de cuidados del paciente, así como la estrecha colaboración con los diferentes equipos involucrados en el manejo de esta terapia.
Como se ha recogido previamente en la literatura, la terapia con ECMO expone al paciente a un elevado riesgo de complicaciones graves. En concreto, en nuestro estudio el 57% de los pacientes presentaron una o más complicaciones durante el soporte, cifra comparable a las de otros estudios similares5,12. Este dato subraya la necesidad de optimizar la selección de los pacientes que realmente se benefician del soporte mecánico, evitando el implante en aquellos que podrían sobrevivir con tratamiento convencional, a la vez que eludiendo la futilidad en aquellos casos que no son recuperables de la situación de fracaso multiorgánico15.
Las complicaciones vasculares relacionadas con la canulación son algunas de las complicaciones más frecuentes del ECMO-VA periférico y condicionan el resultado de la terapia. En las series publicadas, este evento adverso presenta una incidencia variable del 7-40%7,10,12,16,17. En nuestra serie, la incidencia fue del 6%; creemos que en ello ha influido el implante sistemático de cánula de perfusión distal, con el apoyo del cirujano vascular en los casos de elevada dificultad para canalizar la arteria femoral superficial tras el implante de la cánula arterial del ECMO.
En presencia de disfunción muy grave del ventrículo izquierdo, el efecto de aumento de poscarga debido a la terapia con ECMO-VA puede provocar un efecto de distensión ventricular que cursa con dilatación, apertura de la válvula aórtica mínima o ausente, edema agudo de pulmón y trombosis de cavidades. Se ha descrito una incidencia de este fenómeno del 9-24%5,16,18. En el presente estudio, la incidencia de distensión ventricular fue del 9,6%; en nuestra opinión, el alto porcentaje de implante de balón de contrapulsación ha podido prevenir la aparición de dicha complicación.
En un estudio previo19 se analizó la aplicación de la escala INTERMACS20 en las primeras horas del tratamiento del shock para establecer el pronóstico del paciente durante el ingreso; la persistencia de situación INTERMACS 1 o 2 tras las primeras horas de tratamiento fue altamente predictora de mortalidad. Por otro lado, la dosis y el número de inotrópicos necesarios para mantener la condición hemodinámica en una situación de SC se han relacionado con la mortalidad hospitalaria21-23. Por ello, hemos introducido ambas informaciones en nuestro criterio para el inicio de ECMO en situación de shock. De esta forma, el programa se diseñó para una detección precoz de los pacientes con SC refractario, junto con un implante con la mínima demora para minimizar el fallo de órganos y el inicio de la espiral de inflamación que se produce en el contexto del shock24.
En nuestra opinión, el implante del dispositivo por parte del cardiólogo intervencionista y el equipo de enfermería de hemodinámica ofrece múltiples ventajas. La mayoría de los pacientes con SC o parada cardiaca se van a someter a un cateterismo cardiaco urgente, pues está bien documentado que la causa más frecuente de ambas entidades es la cardiopatía isquémica. Por otro lado, en muchas ocasiones es en el propio laboratorio de hemodinámica donde se produce el SC o la parada cardiaca14,25. Esta información, junto con la existencia de una alerta ya organizada, con experiencia en interpretación y manejo de la hemodinámica del paciente, así como en la punción vascular y el manejo de guías y catéteres, hace que un programa de implante de ECMO-VA en el laboratorio de hemodinámica sea atractivo para el inicio precoz del soporte25,26.
En concreto, en nuestro estudio el tiempo de canulación fue de 25min de mediana [20-32,5] y, más importante, el tiempo desde la decisión hasta el implante fue tan solo de 30min de mediana [20-39,5]. Los resultados favorables de nuestro programa en cuanto a supervivencia y, particularmente, la baja necesidad de tratamiento de depuración extrarrenal (7,2%) respecto a otros estudios similares (21-39%)5,7,16, parece apoyar que el soporte circulatorio precoz permite proteger del daño severo de los órganos debido a isquemia. En ese sentido, toma importancia el concepto de «tiempo hasta el soporte» en el tratamiento del infarto en shock, con datos que evidencian que la precocidad en el inicio del soporte circulatorio podría favorecer el pronóstico del paciente27,28.
Se ha descrito que el procedimiento de angioplastia primaria en el infarto agudo de miocardio puede tener peores resultados cuando se realiza fuera del horario convencional del laboratorio de hemodinámica29. En cambio, en nuestra serie hemos analizado este aspecto sin encontrar diferencias significativas en los tiempos ni en la mortalidad. Es posible que esto tenga relación con que un porcentaje significativo de los casos fuera de horario convencional se implantaron en el contexto de la angioplastia primaria, en los cuales el equipo de hemodinámica se encontraba ya presente en el hospital y, por tanto, sin retraso adicional en el soporte.
Otro punto importante en este tipo de intervenciones con alta mortalidad intrahospitalaria, costes y consumo de recursos es la supervivencia a largo plazo, la cual es cada vez más valorada en los tratamientos del paciente crítico30,31. En este aspecto, los resultados de nuestra experiencia han sido también positivos, con una supervivencia al año del 100% en los pacientes que recibieron el alta hospitalaria.
En el estudio que presentamos, 3 variables se mostraron predictoras de la mortalidad a 30 días: lactato previo, tiempo decisión-implante y edad. Las cifras de lactato previas al inicio de ECMO-VA se han relacionado ya en estudios anteriores con la profundidad del shock previo al inicio de la terapia y con el pronóstico del shock32, del ECMO33 y de la parada cardiaca34. La edad también se ha mostrado predictora con anterioridad en este tipo de escenarios33. En nuestro estudio hemos incluido una variable novedosa que ha resultado también pronóstica: el tiempo decisión-implante, con la cual se quiso medir el periodo desde que se estableció la indicación de ECMO-VA hasta el inicio del soporte, incluidos los retrasos debidos a la activación del equipo de hemodinámica, el traslado del paciente, la preparación del equipo y el implante propiamente dicho. En concreto, el resultado del análisis multivariado de nuestra serie muestra que aproximadamente por cada 15min de retraso desde la decisión hasta el implante la mortalidad prácticamente se duplica. Creemos que esta variable refleja con bastante fidelidad la progresión del sufrimiento de órganos y del inicio del fenómeno de inflamación asociado a estas situaciones. Este hallazgo parece ir en línea con el citado tiempo hasta el soporte.
Otro aspecto destacable de nuestra serie es la elevada supervivencia de los pacientes sometidos a trasplante cardiaco tras la terapia de ECMO-VA; en concreto, el aspecto de la supervivencia de todos los pacientes trasplantados directamente desde ECMO-VA periférico. Este es un tema controvertido, en el que múltiples estudios previos presentaban una muy alta mortalidad postoperatoria de esta estrategia35,36. Nuestra experiencia se asemeja en cambio a la recientemente presentada por el grupo de Pitié-Salpêtrière37 sobre trasplante cardiaco bajo terapia con ECMO-VA, en los que con una selección estricta del paciente y con solo un 11% de pacientes bajo ventilación mecánica se alcanzó una supervivencia del 85% a un año.
LimitacionesLa principal limitación de este estudio es su carácter observacional, retrospectivo y unicéntrico. Sin embargo, se trata de un grupo de pacientes extremadamente graves en los que es particularmente difícil realizar un estudio aleatorizado multicéntrico. Por ello, los estudios observacionales y los registros tienen su relevancia en este contexto con el propósito de proponer marcadores de gravedad y generar hipótesis para futuros estudios controlados. En cambio, ponemos en valor en el presente estudio que la recogida de datos ha sido exhaustiva y sistemática, con unos criterios de asignación de valores uniformes, además de reflejar los resultados de aplicación de un programa de ECMO-VA «médico» en un entorno determinado, liderado por cardiólogos en todos los aspectos, incluyendo la indicación, el implante, el manejo en una unidad de agudos y la decanulación.
ConclusionesLa aplicación de un programa de ECMO-VA de canulación periférica en un servicio de cardiología es factible, con unos resultados favorables en cuanto a supervivencia a corto y largo plazo. Resultaron factores pronósticos independientes de la mortalidad a 30 días el lactato previo al implante del ECMO-VA, la edad del paciente y el tiempo desde la decisión hasta el implante. Nuestros datos evidencian la necesidad de acortar este tiempo en los pacientes con shock refractario de causa médica.
La ECMO-VA es una terapia en crecimiento. Su aplicación inicial se centraba en el shock poscardiotomía, mientras que en los últimos años se ha ido expandiendo hacia enfermedades del ámbito de la cardiología, como el SC, la parada cardiaca refractaria, la tormenta arrítmica y el tromboembolismo pulmonar.
¿Qué novedades aporta?Presentamos la puesta en marcha de un programa de ECMO-VA orientado al tratamiento de enfermedades cardiológicas, basado en la indicación y el manejo por cardiología, con un implante realizado por parte del equipo de hemodinámica. Los resultados obtenidos son comparables a los de series internacionales de características similares. El lactato, la edad y el tiempo desde la decisión hasta el implante fueron predictores de mortalidad a 30 días.
Este estudio ha sido financiado en parte con la beca Proyecto de investigación con financiación interna 2020/UEM10, Universidad Europea, Madrid, España.
Conflicto de interesesNo existe ningún conflicto de intereses.