Las lipoproteínas de alta densidad (HDL) han sido tradicionalmente consideradas protectoras frente a la enfermedad vascular ateroesclerótica (EVA) debido a su papel en el transporte inverso de colesterol. Sin embargo, estudios recientes han cuestionado la utilidad clínica de los niveles plasmáticos de colesterol unido a HDL (cHDL), y destacan la importancia de su funcionalidad más allá de su cantidad. La evidencia acumulada sugiere que propiedades como su capacidad antioxidante, antiinflamatoria y de eflujo de colesterol podrían ser mejores indicadores de su potencial antiaterogénico. A pesar de los avances, múltiples ensayos clínicos dirigidos a elevar el cHDL han fracasado en reducir eventos cardiovasculares, lo que resalta la necesidad de un enfoque centrado en mejorar la calidad funcional del HDL. En este contexto, nuevos tratamientos como el obicetrapib, un inhibidor de la proteína de transferencia de ésteres de colesterol, han mostrado efectos prometedores al mejorar el perfil lipídico y el eflujo de colesterol, sin comprometer la seguridad, planteando una estrategia más eficaz y global para el manejo de la EVA. Este artículo revisa críticamente la evolución del conocimiento sobre HDL, subraya la relevancia de evaluar su funcionalidad como biomarcador y explora las futuras estrategias terapéuticas basadas en este enfoque.
High-density lipoproteins (HDL) have traditionally been considered protective against atherosclerotic vascular disease (VAD) due to their role in reverse cholesterol transport. However, recent studies have questioned the clinical utility of plasma levels of HDL-cholesterol (HDL-C), highlighting the importance of their functionality beyond their quantity. Accumulating evidence suggests that properties such as its antioxidant, anti-inflammatory, and cholesterol-efflux capacity could be better indicators of its anti-atherogenic potential. Despite the advances, multiple clinical trials aimed at raising HDL-C have failed to reduce cardiovascular events, highlighting the need for a focused approach to improving HDL functional quality. In this context, new treatments such as Obicetrapib, a cholesteryl ester transfer protein inhibitor, have shown promising effects by improving the lipid profile and cholesterol efflux without compromising safety, proposing a more effective and global strategy for the management of VAD. This article critically reviews the evolution of knowledge about HDL, underlines the relevance of evaluating its functionality as a biomarker, and explores future therapeutic strategies based on this approach.
Las lipoproteínas de alta densidad (HDL) han sido durante mucho tiempo un foco de investigación debido a su asociación con la protección de la enfermedad vascular ateroesclerótica (EVA). Aunque tradicionalmente se ha considerado al colesterol unido a HDL (cHDL) como factor protector por su papel en el transporte inverso de colesterol y la reducción del riesgo vascular, estudios recientes han desafiado esta visión limitada. La complejidad de las funciones biológicas de las HDL, que abarcan propiedades antioxidantes, antiinflamatorias y moduladoras del sistema inmune, revela que su calidad funcional puede ser más relevante que sus niveles cuantitativos en sangre.
En este contexto se considera imprescindible revisar críticamente los avances recientes y sintetizar la evidencia disponible sobre las propiedades funcionales de las partículas HDL, los biomarcadores emergentes basados en su actividad biológica y las estrategias terapéuticas dirigidas a mejorar su función. Entre estas últimas, destaca una nueva molécula terapéutica, el obicetrapib, que es un nuevo inhibidor de la proteína de transferencia de ésteres de colesterol (CETP), que ha mostrado resultados prometedores tanto en la reducción de lipoproteínas aterogénicas como en la mejora del perfil funcional del HDL, aunque aún se requieren datos basados en eventos clínicos para establecer su verdadero valor terapéutico
HDL y enfermedad vascularEl cHDL se ha considerado tradicionalmente un factor protector en la enfermedad vascular, debido a su importante papel en el transporte del exceso de colesterol, el cual las partículas HDL movilizan colesterol desde los tejidos periféricos hacia el hígado para su excreción, proceso conocido como transporte reverso del colesterol (TRC).1 Además, el cHDL parece tener propiedades antiinflamatorias,2 antioxidantes3 y antitrombóticas,4 que pueden contribuir a sus efectos ateroprotectores.
Desde una perspectiva epidemiológica, los primeros indicios de la relación entre cHDL y la EVA se remontan a 1953, cuando Esko Nikkilä observó que los niveles de cHDL eran significativamente más bajos en individuos con EVA en comparación con controles sanos.5 Estudios posteriores en distintos países y poblaciones confirmaron esta asociación inversa, consolidando la idea de que niveles bajos de cHDL se relacionaban con un mayor riesgo cardiovascular.6–11 En los años 80, varios estudios prospectivos demostraron que incrementos modestos en cHDL se asociaban a reducciones proporcionales del riesgo de enfermedad coronaria12: un incremento de 1mg/dl en cHDL se asociaba con una reducción del 2% en el riesgo de enfermedad coronaria en los varones y del 3% en las mujeres.12
Sin embargo, análisis epidemiológicos posteriores identificaron una relación no lineal entre cHDL y riesgo cardiovascular. Diversas cohortes han mostrado una meseta de riesgo a partir de valores alrededor de 40mg/dl13,14 y, en algunos casos, un incremento de eventos en concentraciones muy elevadas, configurando una curva en U. Ejemplos relevantes incluyen 2 grandes cohortes danesas,15 que evidenciaron un aumento del riesgo tanto en niveles muy bajos como en valores excepcionalmente altos de cHDL, así como un estudio en veteranos estadounidenses que confirmó dicha asociación con la mortalidad total.16
Los estudios de aleatorización mendeliana aportaron un nuevo enfoque y cuestionaron la causalidad entre los niveles elevados de cHDL y la reducción del riesgo cardiovascular.17 Variantes genéticas que incrementan cHDL no se asociaron consistentemente con menor incidencia de infarto de miocardio. Asimismo, algunas mutaciones que elevan notablemente el cHDL (por ejemplo, en CETP, ABCA1, LIPC o SCARB1) se vincularon paradójicamente con mayor riesgo de enfermedad coronaria.18,19 Estos hallazgos indican que la cantidad de cHDL no necesariamente refleja su capacidad protectora.
Sin embargo, esta evidencia debe interpretarse con precaución, porque la mayoría de las variantes genéticas asociadas con cHDL también se asocian con cambios direccionales opuestos en triglicéridos, colesterol ligado a lipoproteínas de baja densidad (cLDL) o a ambos, lo que dificulta las estimaciones del efecto del cHDL sobre el riesgo de EVA utilizando aleatorización mendeliana.17–19
Parte de estas discrepancias epidemiológicas puede explicarse por la complejidad intrínseca de las partículas HDL.20,21 Su composición, heterogeneidad y grado de funcionalidad están influenciados por numerosos factores metabólicos e inflamatorios, lo que afecta su capacidad para ejercer acciones protectoras,22–24 así como el propio estilo de vida también modula de forma significativa la funcionalidad de HDL.25 Análisis poblacionales como los del UK Biobank indican que los patrones dietéticos y conductuales se reflejan directamente en la calidad de las partículas HDL, lo que podría explicar la asociación entre determinados niveles plasmáticos de cHDL y el riesgo cardiovascular observado en la práctica clínica.25
Estudios recientes muestran que la inflamación sistémica y la elevación de cLDL deterioran la funcionalidad de HDL,26,27 favoreciendo la formación de partículas disfuncionales. De hecho, los pacientes con infarto agudo de miocardio presentan partículas HDL menos eficaces para promover el eflujo de colesterol y con propiedades antioxidantes e inflamatorias alteradas.27
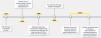
En este contexto, resulta evidente que la medición aislada del cHDL aporta información limitada. La complejidad estructural y funcional de las partículas de HDL, junto con su susceptibilidad a alteraciones en estados inflamatorios o metabólicos. Algunos estudios han demostrado que valores elevados de cLDL y la inflamación alteran directamente la funcionalidad de las partículas HDL y se asocian a mayor tamaño del infarto de miocardio en modelos animales.26 Igualmente, los pacientes que presentan un primer infarto agudo de miocardio presentan característicamente partículas de HDL disfuncionales, en comparación con los pacientes sin infarto,27 y el eflujo de colesterol se relaciona inversamente con marcadores de inflamación como la proteína C reactiva o la interleuquina-6.28 Esto ha impulsado un cambio conceptual: pasar de considerar HDL como un simple marcador cuantitativo a evaluar su funcionalidad como indicador más preciso de riesgo cardiovascular (fig. 1).
Línea temporal en la relación entre el cHDL y la enfermedad cardiovascular. cHDL: colesterol unido a lipoproteínas de alta densidad; EVA: enfermedad vascular ateroesclerótica. Las referencias bibliográficas mencionadas en esta figura corresponden a: Nikkilä5; Brunner et al.6; Keys et al.7; Barr et al.8; Carlson et al.9; Durrum et al.10; Gordon et al.12; Di Angelantonio et al.13; Wilkins et al.14; Madsen et al.15; Bowe et al.16; Haase et al.17; Voight et al.18 y Landmesser et al.19.
La evidencia disponible demuestra que el simple aumento de las concentraciones plasmáticas de cHDL no se traduce necesariamente en una reducción del riesgo cardiovascular. Este hallazgo, respaldado por múltiples ensayos clínicos y estudios genéticos, ha puesto de manifiesto en la actualidad que la funcionalidad de las partículas HDL es más relevante que su cantidad. Pero numerosos fármacos se desarrollaron con el objetivo de incrementar el cHDL bajo esta hipótesis inicial, obteniendo resultados negativos o insuficientes.
Las iniciativas para lograr un aumento en los niveles plasmáticos de HDL como medida terapéutica, se remontan a las estrategias de infusión de apolipoproteína A-I (apoA-I) Milano. La apoA-I es la apolipoproteína predominante en la partícula HDL, y se escogió apoA-I Milano porque se había identificado con anterioridad en las partículas de HDL de una familia del norte de Italia que pese a presentar valores bajos de cHDL, no desarrollaba enfermedad cardiovascular. El régimen de administración se basó en estudios experimentales pioneros que demostraron regresión de placa inyectando la fracción HDL-VHDL (sin colesterol), rica en apoA-I.29 La infusión de apoA-I Milano se asoció con regresión del volumen de placa, evaluado mediante ecografía intravascular coronaria.30 Sin embargo, el elevado coste de producción de esta apolipoproteína y la necesidad de administración intravenosa impidieron su comercialización.
Posteriormente, el ácido nicotínico, que había demostrado elevar los niveles de cHDL a través de un mecanismo no completamente conocido, fue investigado en combinación con laropiprant para reducir sus efectos secundarios, pero sin embargo, no logró demostrar beneficio clínico.31
El conocimiento de la vía metabólica del transporte de colesterol a través de distintas lipoproteínas permitió investigar fármacos dirigidos a la inhibición de CETP, proteína encargada de transferir ésteres de colesterol desde HDL hacia LDL y VLDL. Estos fármacos lograron aumentar significativamente las concentraciones de cHDL, sin embargo, este incremento no se tradujo en beneficios clínicos. Este fue el caso de dalcetrapib32 y anacetrapib,33 que elevaron el cHDL pero no redujeron cLDL ni apoB.
Aumentar el cHDL no garantiza eficacia clínica. Los ensayos con inhibidores de CETP revelaron varios aspectos clave, incluyendo la disociación entre aumentar cHDL y mejorar la funcionalidad de HDL. El HDL generado farmacológicamente mostró menor capacidad de eflujo, menor contenido en apoA-I y un fenotipo oxidado, proinflamatorio o disfuncional. Ninguno de los inhibidores de CETP, salvo parcialmente anacetrapib, consiguió reducciones significativas de apoB.32–34
Varios ensayos aleatorizados también demostraron que los miméticos de HDL administrados por infusión aumentan rápidamente las concentraciones plasmáticas de cHDL, pero no reducen la progresión de la ateroesclerosis evaluada mediante ecografía intravascular.34
A pesar de ello, recientemente el estudio AEGIS-II volvió a evaluar la administración semanal de CSL112, una apoA-I humana derivada de plasma, durante las primeras 4 semanas posteriores al infarto agudo de miocardio. Se planteó la hipótesis de que una rápida infusión de apoA-I podría reducir el riesgo de reinfarto, ictus o muerte cardiovascular en los primeros 90 días. Aunque el estudio fue neutro en su objetivo primario, sí observó reducciones en mortalidad y reinfarto, lo que mantiene cierta expectativa respecto a esta estrategia.35
La convergencia de estos resultados condujo a un cambio conceptual clave: elevar cHDL no es un objetivo terapéutico válido por sí mismo. Lo relevante es mejorar la funcionalidad del HDL, aumentar su capacidad de eflujo de colesterol (CEC) y reducir simultáneamente apoB (tabla 1).
Resumen de los estudios anteriores a obicetrapib con diana terapéutica en cHDL
| Fármaco o estudio | Intervención/tipo de fármaco | Resultado principal |
|---|---|---|
| ApoA-I Milano | Infusión de apoA-I funcional (apoA-I Milano) | Regresión del volumen de placa (no comercialización) |
| Ácido nicotínico + lorapiprant | Ácido nicotínico combinado | No mostró beneficio clínico |
| Dalcetrapib | Inhibidor de CETP | Aumentó el cHDL pero sin beneficio clínico |
| Anacetrapib | Inhibidor de CETP | Aumentó el cHDL con beneficio clínico poco relevante |
| Miméticos de HDL (infusión directa) | HDL mimético | Aumentaron el cHDL pero no redujeron la progresión de la ateroesclerosis |
| AEGIS-II35 | Administración de CSL112 (apoA-I humana) | Resultado neutro en el objetivo primario; reducción en mortalidad y reinfarto |
apoA-I: apolipoproteína A-I; CEPT: porteína de traferencia de ésteres de colesterol; cHDL: colesterol unido a lipoproteína de alta densidad; HDL: lipoproteína de alta densidad.
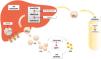
Las partículas de HDL tienen varias funciones antiateroescleróticas, incluido el TRC y sus funciones antiinflamatorias, antioxidantes, vasodilatadoras y antitrombóticas.36 Por tanto, los estudios recientes refuerzan el concepto de que las partículas de HDL no son simplemente un transportador de colesterol, sino que poseen varias propiedades funcionales adicionales que pueden desempeñar un papel clave en la EVA37 (fig. 2).
Funcionalidad de las partículas HDL. ABCA1: transportador de casete de unión a ATP A1; ABCG1: transportador de casete de unión a ATP G1; apoA-I: apolipoproteína A-I; apoA-IV: apolipoproteína A-IV; apoC-I: apolipoproteína C-I; apoC-III; apolipoproteína C-III; apoE: apolipoproteína E; eNOS: sintasa de óxido nítrico endotelial; LDL: lipoproteínas de baja densidad; NF-κB: factor nuclear kappa B; NO: óxido nítrico; PON1: paraoxonasa 1; SR-BI: receptor scavenger clase B tipo I; TRC: transporte reverso de colesterol.
Las partículas de HDL constituyen una familia compleja, integrada por subespecies que difieren en tamaño, densidad, forma, carga y composición, y que experimentan procesos continuos de remodelación en la circulación.38 Esta heterogeneidad explica por qué las HDL no siempre pueden considerarse antiaterogénicas y en determinados contextos pueden volverse disfuncionales o incluso proaterogénicas. A continuación se explican en detalle los marcadores de funcionalidad de las partículas cHDL.
Capacidad de eflujo de colesterolLa CEC es el biomarcador funcional mejor consolidado y describe la habilidad de las partículas de HDL para retirar colesterol de los macrófagos de la placa ateroesclerótica.39
Este proceso se produce a través de distintos transportadores:
- –
ABCA1, que actúa sobre partículas pequeñas y pobres en colesterol (preβ-HDL, HDL3).
- –
ABCG1 y SR-BI, que median el eflujo hacia partículas HDL más maduras.
Numerosos estudios han demostrado que una mayor CEC se asocia de manera independiente con menor riesgo cardiovascular.39,40 Sin embargo, condiciones como inflamación sistémica, hipercolesterolemia o diabetes pueden deteriorarla, generando cHDL disfuncional frecuente en los pacientes con enfermedad cardiovascular. En conjunto, la CEC es el biomarcador funcional más robusto y probablemente el que mejor refleja el potencial antiaterogénico de HDL, pero no medido en la práctica clínica habitual.
Proteómica del HDLLas partículas de HDL transportan decenas de proteínas implicadas en inflamación, inmunidad y metabolismo lipídico. Cambios en esta composición pueden modificar de forma sustancial su función.41 La reducción de apoA-I, proteína esencial para el eflujo de colesterol, se asocia a menor protección cardiovascular, el aumento de proteínas proinflamatorias convierte a HDL en una partícula potencialmente perjudicial y modificaciones como la oxidación de apoA-I por mieloperoxidasa reducen de forma marcada su funcionalidad.42
El análisis proteómico, como el contenido en apoA-I ha permitido identificar patrones asociados a hipercolesterolemia familiar y enfermedad coronaria, abriendo la puerta a su uso como herramienta diagnóstica.41
Subfracciones de HDLLa partícula de HDL no es una lipoproteína uniforme. Existen múltiples subfracciones que difieren en tamaño, densidad y contenido proteico. Entre ellas destacan43:
- –
Preβ-HDL y HDL3, pequeñas y densas, óptimas para el eflujo mediado por ABCA1.
- –
HDL2, partículas más grandes y maduras, asociadas al eflujo vía ABCG1 y SR-BI.
Estudios recientes han demostrado que las partículas pequeñas y medianas se asocian a menor riesgo cardiovascular, las partículas HDL muy grandes no muestran una asociación clara con protección, y el número total de partículas HDL puede aportar más información clínica que el cHDL aislado.29–33
Métodos avanzados como resonancia magnética nuclear o espectrometría están ganando protagonismo para cuantificar subfracciones y podrían convertirse en biomarcadores complementarios.44
Efectos vascularesEL cHDL contribuye al mantenimiento de la función endotelial mediante activación de eNOS y la producción de óxido nítrico, la reducción del estrés oxidativo endotelial, la estimulación de prostaciclina y el refuerzo de la integridad de la barrera endotelial.45,46
En los pacientes con enfermedad cardiovascular, las partículas HDL suelen mostrar menor capacidad para activar eNOS, lo que refleja pérdida funcional y favorece progresión ateroesclerótica.47
Factores que deterioran la funcionalidad del HDLLa funcionalidad del HDL puede verse deteriorada en múltiples estados patológicos, como la diabetes mellitus, la obesidad y el síndrome metabólico, la enfermedad renal crónica, la inflamación crónica y la hipercolesterolemia grave.
Por tanto, la búsqueda de un biomarcador clínico accesible continúa siendo un reto, aunque la concentración plasmática de apoA-I podría ser un candidato relevante dada su relación directa con la estructura y funcionalidad del HDL.41,42,48,49
Direcciones futuras en el control del cLDL y cHDL: evidencias con obicetrapibLa comprensión de que los niveles plasmáticos de cHDL no reflejan adecuadamente la función biológica de HDL ha impulsado el desarrollo de nuevas estrategias orientadas tanto a mejorar la calidad funcional de la partícula como a reducir simultáneamente las lipoproteínas aterogénicas que contienen apoB.50,51 En este contexto, ha surgido obicetrapib, un inhibidor potente y selectivo de CETP cuya característica distintiva es su capacidad para reducir de manera sustancial el cLDL, la apoB y la Lp(a), al tiempo que incrementa las subfracciones de HDL con mayor CEC.52–55
A diferencia de sus predecesores torcetrapib, dalcetrapib y anacetrapib, obicetrapib fue desarrollado con el objetivo explícito de optimizar la reducción global del riesgo lipídico, priorizando la disminución de partículas aterogénicas. Esta diferencia conceptual es relevante, ya que la ausencia de reducciones significativas de apoB fue una de las razones principales del fracaso de terapias anteriores53,55 (tabla 2 y tabla 3).
Estudios con obicetrapib
| Estudio | Fase | Población | Tratamiento evaluado | Resultados principales |
|---|---|---|---|---|
| TULIP58 | Fase II - Ensayo clínico aleatorizado doble ciego | Pacientes con dislipemia leve | Obicetrapib + atorvastatina 20mg o rosuvastatina 10mg | Aumento del eflujo de colesterol (hasta el 72%)aAumento de cHDL (179%)Reducción de cLDL (45%), apoB (30%), Lp(a) (33%)b |
| ROSE59 | Fase II | Pacientes con dislipemia | Obicetrapib | Aumento de apoA-I (165%) |
| ROSE-II60 | Fase II | Pacientes con dislipemia | Obicetrapib | Reducción de partículas pequeñas y densas |
| BROOKLYN61 | Fase III | Pacientes con hipercolesterolemia familiar en tratamiento hipolipemiante máximo | Obicetrapib 10mg | Reducción del cLDL (41%), PCR (8%)Aumento del cHDL (121%) a los 12 meses |
| BROADWAY62 | Fase III | Pacientes con enfermedad cardiovascular establecida | Obicetrapib 10 mg | Reducción LDL (29,9%) sin diferencias en los efectos adversos entre ambos grupos de tratamiento |
| BROOKLYN + BROADWAY64 | Post hoc | Incidencia eventos cardiovasculares | Obicetrapib 10mg | Reducción significativa tras los 6 meses de tratamiento: MACE 4c (HR = 0,60; IC95%, 0,37-0,99) y MACE 3d (HR = 0,68; IC95%, 0,46-1,00) |
| PREVAIL65 | Fase III (en curso/en espera de resultados) | Prevención de eventos cardiovasculares | Obicetrapib 10mg | En curso |
apoA-I: apolipoproteína A-I; apoB: apolipoproteína B; cHDL: colesterol unido a lipoproteínas de alta intensidad; cLDL: colesterol unido a lipoproteínas de baja intensidad; Lp(a): lipoproteína(a); MACE: eventos cardiovasculares mayores; PCR: proteína C reactiva.
Comparativa de los fármacos iCEPT, incluido obicetrapib
| Fármaco | Mecanismo | cLDL | cHDL | apoB | Lp(a) | Funcionalidad HDL (CEC) | Resultados clínicos (eventos) | Limitaciones/comentarios |
|---|---|---|---|---|---|---|---|---|
| Torcetrapib | Inhibidor de CETP (1.ª gen) | Variable | ↑ ∼ 60-70% | ↓ 20% | ↓ 15% | Mejora no demostrada | Aumento de eventos y mortalidad (ensayo interrumpido) | Efectos pleiotrópicos off-target: ↑ PA, activación SRAA; fracaso por toxicidad, no por la diana en sí. |
| Dalcetrapib | Inhibición parcial de CETP | ≈ sin cambios | ↑ ∼ 25-30% | ≈ sin cambios | ≈ sin cambios | HDL generado con baja CEC | Sin beneficio clínico | Eleva cHDL sin reducir partículas con apoB; disociación cantidad-función. |
| Anacetrapib | Inhibición potente de CETP | ↓ 15-20% | ↑ > 100% | ↓ 15-18% | ↓ 25-35% | Datos funcionales limitados | Beneficio modesto en REVEAL, atribuible sobre todo a ↓ apoB | Acumulación en tejido adiposo; dudas de seguridad a largo plazo. |
| Obicetrapib | Inhibidor potente y selectivo de CETP | ↓ 30-45% (fase II);↓ 29,9% (fase III);↓ 48,6% en combinación ezetimibe | ↑ ∼ 120-180% | ↓ 30% | ↓ ∼26,7-36,9%; hasta ↓ 62,9% en combinación | ↑ CEC: total + 38%, ABCA1 no específico + 72%, ABCA1 específico +28% | Análisis conjunto BROOKLYN+BROADWAY: ↓ MACE (HR = 0,68; IC95%, 0,46-1,00) a 12 meses; PREVAIL en curso | Perfil de seguridad favorable; pendiente confirmación de beneficio en eventos. |
ABCA1: transportador de casete de unión a ATP A1; apoB: apolipoproteína B; CEC: capacidad de eflujo de colesterol; CEPT: proteína transportadora de ésteres de colesterol; cHDL: colesterol unido a lipoproteína de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad (HDL); IC95%: intervalo de confianza del 95%; iCEPT: inhibidores de la proteína de transferencia de ésteres de colesterol; Lp(a): lipoproteína(a); MACE: eventos cardiovasculares mayores; PA: presión arterial; SRAA: sistema renina-angiotensina-aldosterona.
Los estudios de fase II (TULIP, ROSE y ROSE2) han mostrado reducciones profundas de cLDL (en torno al 40-45% en monoterapia) y descensos relevantes de apoB y Lp(a), junto con un incremento notable de cHDL.56–60 Más allá del aumento numérico del cHDL, destaca el incremento de las partículas preβ-HDL y HDL3, pobres en colesterol y ricas en apoA-I, esenciales para el eflujo mediado por ABCA1.58
Estos estudios también demostraron una mejora dosis dependiente de la CEC. En el estudio TULIP, la administración de obicetrapib 10mg aumentó el eflujo total en un 38%, el eflujo no específico de ABCA1 en un 72% y el eflujo específico de ABCA1 en un 28%.58 Este incremento de la CEC es especialmente relevante por su estrecha asociación con protección frente a la EVA.
Evidencia en fase III: eficacia y seguridadLos estudios BROOKLYN y BROADWAY, ambos fase III, confirmaron la eficacia de obicetrapib añadido al tratamiento hipolipemiante estándar. En BROOKLYN, en los pacientes con hipercolesterolemia familiar heterocigota, obicetrapib 10mg redujo el cLDL un 41,5% al año, con incrementos relevantes de cHDL y sin diferencias significativas en eventos adversos frente a placebo.61 En BROADWAY, en los pacientes con enfermedad cardiovascular establecida, obicetrapib redujo el cLDL un 29,9% a los 84 días con un perfil de seguridad favorable.62
Además, en el estudio TANDEM, que evaluó la combinación fija de obicetrapib 10mg + ezetimibe 10mg, demostró reducciones del cLDL superiores al 48% frente a placebo y descensos aún mayores de apoB, junto con una reducción relevante de Lp(a).63
Relación entre datos lipídicos y eventos clínicosUn análisis conjunto de los estudios BROOKLYN y BROADWAY (n=2.884) mostró que obicetrapib 10mg/día redujo significativamente cLDL, apoB, no-HDL-c y Lp(a), e incrementó el cHDL en un 140%.64 A los 12 meses se observó una reducción en los eventos coronarios mayores (HR = 0,68; IC95%, 0,46-1,00), con beneficio evidente tras los primeros 6 meses.65
Pese a estos resultados, todavía no se dispone de datos definitivos basados en eventos clínicos duros. El estudio PREVAIL será decisivo para determinar si la reducción de partículas apoB y la mejora de la funcionalidad del HDL con obicetrapib se traducen en un beneficio clínico robusto y sostenido.66
El valor incremental de obicetrapib deberá evaluarse con cautela y demostrar ventajas claras frente a las terapias que ya han demostrado beneficios cardiovasculares. El aumento aislado de cHDL no debe interpretarse como marcador de eficacia por sí mismo y el enfoque terapéutico actual prioriza reducir apoB y mejorar la funcionalidad del HDL.52–55
Papel potencial de obicetrapib en la estrategia terapéutica combinadaObicetrapib podría incorporarse en una estrategia integral para reducir el riesgo residual mediante: a) reducción de apoB con estatinas, ezetimibe o inhibidores PCSK9; b) reducción adicional de cLDL y Lp(a) mediante inhibición de CETP, y c) mejora de la funcionalidad de HDL, incluida la CEC.65
Al actuar por una vía metabólica distinta, obicetrapib se puede combinar con otros agentes sin interferencias farmacodinámicas significativas. Este enfoque podría optimizar el control lipídico en los pacientes de muy alto riesgo o con respuesta insuficiente al tratamiento estándar65 (fig. 3).
Obicetrapib en el abordaje global del tratamiento hipolipemiante. AcetilCoA: acetil coenzima A; CEPT: proteína de transferencia de ésteres de colesterol; HDL: lipoproteínas de alta densidad; HMGCoA: 3-hidroxi-3-metilglutaril-coenzima A; IDL: lipoproteína de densidad intermedia; LDL: lipoproteínas de baja densidad; NPC1L1: Niemann-Pick C1-Like 1; QMh: quilomicrón hepático; QMi: quilomicrón intestinal; tdPCSK9: terapia dirigida a la proproteína convertasa subtilisina/kexina tipo 9.
En conjunto, la evidencia actual apunta hacia un modelo más preciso para la evaluación del riesgo cardiovascular, en el que la funcionalidad del HDL y la reducción de partículas aterogénicas desempeñan un papel complementario. Este enfoque permitirá mejorar la estratificación del riesgo y guiar el desarrollo de terapias más eficaces, especialmente en los pacientes de alto riesgo a pesar del tratamiento convencional.
ConclusionesEl cHDL por sí solo no constituye un marcador fiable del riesgo cardiovascular, especialmente en los pacientes con enfermedad cardiovascular establecida. La verdadera relevancia de las partículas de HDL radica en su funcionalidad, es decir, en su capacidad para ejercer acciones antioxidantes, antiinflamatorias y promover el eflujo de colesterol desde los tejidos periféricos hacia el hígado. Esta función refleja con mayor precisión su potencial protector que su concentración plasmática.
Los ensayos clínicos han demostrado que aumentar cHDL sin mejorar su calidad funcional no se traduce en una reducción de eventos cardiovasculares, lo que obliga a un cambio de paradigma tanto en la investigación como en la práctica clínica. Evaluar la funcionalidad del HDL y su interacción con las lipoproteínas aterogénicas se perfila como un enfoque más útil para la estratificación del riesgo y la monitorización terapéutica.
En este contexto, obicetrapib representa una estrategia innovadora al combinar una potente reducción de lipoproteínas que contienen apoB y Lp(a) con una mejora en la calidad funcional del HDL. No obstante, será necesario confirmar en estudios basados en eventos clínicos si estos efectos bioquímicos se traducen en una reducción sostenida de la morbimortalidad cardiovascular.
FinanciaciónEl artículo ha sido realizado por los autores con una beca no condicionada de Menarini, sin que haya influido en el contenido ni en las conclusiones del manuscrito.
Declaración sobre el uso de inteligencia artificialNo se ha utilizado la inteligencia artificial para la elaboración del artículo.
Contribución de los autoresLa coordinación del manuscrito ha estado a cargo de R. Fernández-Olmo y A. Cordero. Todos los autores han participado en la elaboración, revisión y aprobación del artículo. L. Badimon ha realizado la revisión del artículo como experta.
Conflicto de interesesTodos los autores han recibido una beca no condicionada de Menarini, sin que haya influido en el contenido ni en las conclusiones del manuscrito. R. Fernandez-Olmo ha recibido honorarios no relacionados con el manuscrito de por Novartis, Sanofi, Amgen, Menarini, MSD, Novo Nordisk y Recordati. A. Cordero ha recibido honorarios no relacionados con el manuscrito de AstraZeneca, AMGEN, Bristol-Myers Squibb, Ferrer, Boehringer Ingelheim, MSD, Daiichy Sankio, Novartis, Novo Nordisk, Lilly Sanofi y Amarin.